Феррохелатаза - Ferrochelatase
| Феррохелатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Феррохелатаза человека | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.99.1.1 | ||||||||
| Количество CAS | 9012-93-5 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Феррохелатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Феррохелатаза | ||||||||
| Pfam | PF00762 | ||||||||
| ИнтерПро | IPR001015 | ||||||||
| PROSITE | PDOC00462 | ||||||||
| SCOP2 | 1ak1 / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 129 | ||||||||
| Белок OPM | 1 час | ||||||||
| |||||||||
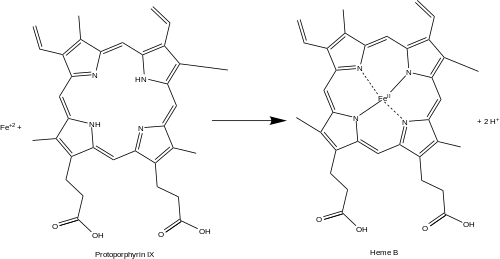
Феррохелатаза (или протопорфирин феррохелатаза) является фермент который закодирован FECH ген у человека.[1] Феррохелатаза катализирует восьмую и конечную стадию биосинтеза гем, преобразование протопорфирин IX в гем B. Катализирует реакцию:
- протопорфирин + Fe+2 ⇌ гем B + 2 часа+
Функция
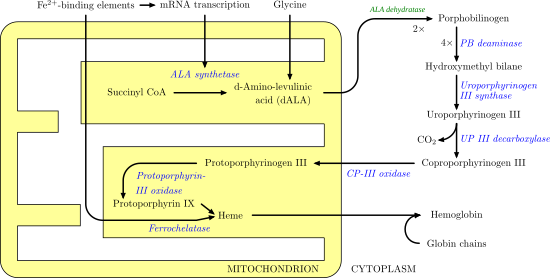
Феррохелатаза катализирует введение железо железо в протопорфирин IX в пути биосинтеза гема с образованием гема B. Фермент локализован на обращенной к матрице стороне внутренней митохондриальной мембраны. Феррохелатаза - самый известный член семейства ферментов, которые добавляют двухвалентный металл катионы тетрапиррольным структурам.[2] Например, хелатаза магния добавляет магний к протопорфирину IX на первом этапе бактериохлорофилл биосинтез.[3]
Heme B является важным кофактор во многих белках и ферментах. В частности, гем b играет ключевую роль переносчика кислорода в гемоглобин в красные кровяные тельца и миоглобин в мышца клетки. Кроме того, гем B находится в цитохром b, ключевой компонент в Q-цитохром с оксидоредуктаза (комплекс III) в окислительного фосфорилирования.[4]
Структура
Феррохелатаза человека представляет собой гомодимер, состоящий из двух полипептидных цепей из 359 аминокислот. Его общая молекулярная масса составляет 85,07 кДа.[5] Каждая субъединица состоит из пяти регионов: последовательность митохондриальной локализации, N-концевой домен, два сложенных домена и С-концевое расширение. Остатки 1–62 образуют домен митохондриальной локализации, который расщепляется на посттрансляционная модификация. Свернутые домены содержат 17 α-спирали и 8 β-листы. Расширение терминала C содержит три из четырех цистеин остатки (Cys403, Cys406, Cys411), координирующие каталитическую железо-серный кластер (2Fe-2S). Четвертый координирующий цистеин находится в N-концевом домене (Cys196).[6]
Активный карман феррохелтазы состоит из двух гидрофобных «губ» и гидрофильной внутренней части. Гидрофобные губы, состоящие из высококонсервативных остатков 300–311, обращены к внутренней митохондриальной мембране и способствуют прохождению малорастворимого субстрата протопорфирина IX и гемового продукта через мембрану. Внутри кармана активного центра находится высококонсервативная кислотная поверхность, которая облегчает экстракцию протонов из протопорфирина. Гистидин и аспартат Остатки примерно в 20 ангстрем от центра активного центра на стороне митохондриального матрикса фермента координируют связывание металла.[6]
Механизм

Механизм металлирования протопорфирина человека остается исследуемым. Многие исследователи предположили, что искажение макроцикла порфирина является ключом к катализу. Исследователи изучают Bacillus subtilis Феррохелатаза предлагает механизм встраивания железа в протопорфирин, при котором фермент плотно захватывает кольца B, C и D, изгибая кольцо A 36о. Обычно плоское, это искажение подвергает неподеленную пару электронов на азоте в кольце A воздействию Fe+2 ион.[2] Последующее расследование выявило 100о искажение протопорфирина, связанного с феррохелатазой человека. Сильно консервированный гистидин остаток (His183 в Б. subtilis, His263 у людей) важен для определения типа искажения, а также действует как начальный акцептор протонов от протопорфирина.[6][7] Анионные остатки образуют путь, облегчающий движение протонов от каталитического гистидина.[6] Фратаксин шапероны железо на матричной стороне феррохелатазы, где остатки аспартата и гистидина на обоих белках координируют перенос железа в феррохелатазу.[8] Два аргинин и тирозин остатки в активном центре (Arg164, Tyr165) могут осуществлять окончательное металлирование.[6]
Клиническое значение
Дефекты феррохелатазы создают накопление протопорфирина IX, вызывая эритропоэтическая протопорфирия (EPP).[9] Заболевание может быть результатом различных мутаций в FECH, большинство из которых проявляются в аутосомный доминирующий манера с низкой клинической пенетрантностью. Клинически пациенты с ПОП имеют целый ряд симптомов, от бессимптомных до очень болезненных. светочувствительность. Менее чем в пяти процентах случаев накопление протопорфирина в печени приводит к холестаз (блокирование оттока желчи от печени к тонкому кишечнику) и терминальное отказ печени.[10]
Взаимодействия
Феррохелатаза взаимодействует с множеством других ферментов, участвующих в биосинтезе гема, катаболизм, и транспорт, в том числе протопорфириногеноксидаза, 5-аминолевулинатсинтаза, ABCB10, ABCB7, сукцинил-КоА синтетаза,[11] и митоферрин-1.[12] Многочисленные исследования подтвердили существование олигомерный комплекс это обеспечивает субстратный канал и координацию общего метаболизма железа и порфирина в клетке.[11][12] N-метилмезопорфирин (N-MeMP) является конкурентным ингибитором с протопорфирином IX и считается аналогом переходного состояния. Таким образом, N-MeMP широко используется в качестве стабилизирующего лиганда для рентгеновская кристаллография определение структуры.[13] Фратаксин действует как Fe+2 шаперон и комплексы с феррохелатазой на его стороне митохондриального матрикса.[8] Феррохелатаза также может вставлять ионы других двухвалентных металлов в протопорфирин. Некоторые ионы, такие как Zn+2, Ni, и Co образуют другие металлопорфирины, в то время как ионы более тяжелых металлов, такие как Mn, Pb, Hg, и CD препятствовать выделению продукта после металлизации.[14]
Смотрите также
Рекомендации
- ^ https://www.uniprot.org/uniprot/P22830
- ^ а б Lecerof, D .; Fodje, M .; Hansson, A .; Hansson, M .; Аль-Карадаги, С. (март 2000 г.). «Структурно-механические основы металлизации порфиринов феррохелатазом». Журнал молекулярной биологии. 297 (1): 221–232. Дои:10.1006 / jmbi.2000.3569. PMID 10704318.
- ^ Липер, Ф. Дж. (1985). «Биосинтез порфиринов, хлорофиллов и витамина B12». Отчеты о натуральных продуктах. 2 (1): 19–47. Дои:10.1039 / NP9850200019. PMID 3895052.
- ^ Берг, Джереми; Тимочко, Джон; Страйер, Люберт (2012). Биохимия (7-е изд.). Нью-Йорк: W.H. Фримен. ISBN 9781429229364.
- ^ http://www.rcsb.org/pdb/explore/explore.do?structureId=1HRK
- ^ а б c d е Ву, Чиа-Куэй; Дэйли, Гарри А .; Роуз, Джон П .; Бремя, Эми; Продавцы, Вера М .; Ван, Би-Чэн (1 февраля 2001 г.). «Структура 2,0 Å феррохелатазы человека, конечного фермента биосинтеза гема». Структурная биология природы. 8 (2): 156–160. Дои:10.1038/84152. PMID 11175906. S2CID 9822420.
- ^ Карлберг, Тобиас; Hansson, Mattias D .; Йенго, Раймонд К .; Йоханссон, Ренцо; Thorvaldsen, Hege O .; Ferreira, Gloria C .; Ханссон, Матс; Аль-Карадаги, Салам (май 2008 г.). «Связывание и искажение порфирина и специфичность субстрата в реакции феррохелатазы: роль остатков активного сайта». Журнал молекулярной биологии. 378 (5): 1074–1083. Дои:10.1016 / j.jmb.2008.03.040. ЧВК 2852141. PMID 18423489.
- ^ а б Bencze, Krisztina Z .; Юн, Тэджин; Миллэн-Пачеко, Цезарь; Брэдли, Патрик Б.; Пастор Нина; Cowan, J. A .; Стеммлер, Тимоти Л. (2007). «Фратаксин человека: поверхность, связывающая железо и феррохелатазу». Химические коммуникации (18): 1798–1800. Дои:10.1039 / B703195E. ЧВК 2862461. PMID 17476391.
- ^ Джеймс, Уильям Д .; Бергер, Тимоти Г. (2006). Кожные болезни Эндрюса: клиническая дерматология. Saunders Elsevier. ISBN 0-7216-2921-0.
- ^ Rüfenacht, U.B .; Gouya, L .; Шнайдер-Инь, X .; Puy, H .; Schäfer, B.W .; Aquaron, R .; Nordmann, Y .; Миндер, E.I .; Дейбах, J.C. (1998). «Систематический анализ молекулярных дефектов в гене феррохелатазы у пациентов с эритропоэтической протопорфирией». Американский журнал генетики человека. 62 (6): 1341–52. Дои:10.1086/301870. ЧВК 1377149. PMID 9585598.
- ^ а б Медлок, Эми Э .; Shiferaw, Mesafint T .; Марсеро, Джейсон Р .; Вашишт, Аджай А .; Wohlschlegel, James A .; Филлипс, Джон Д .; Дэйли, Гарри А .; Лиза, Марк (19 августа 2015 г.). «Идентификация комплекса метаболизма митохондриального гема». PLOS ONE. 10 (8): e0135896. Дои:10.1371 / journal.pone.0135896. ЧВК 4545792. PMID 26287972.
- ^ а б Chen, W .; Dailey, H.A .; По, Б. Х. (28 апреля 2010 г.). «Феррохелатаза образует олигомерный комплекс с митоферрином-1 и Abcb10 для биосинтеза эритроидного гема». Кровь. 116 (4): 628–630. Дои:10.1182 / кровь-2009-12-259614. ЧВК 3324294. PMID 20427704.
- ^ Medlock, A .; Swartz, L .; Dailey, T. A .; Dailey, H.A .; Ланзилотта, В. Н. (29 января 2007 г.). «Взаимодействие субстрата с феррохелатазой человека». Труды Национальной академии наук. 104 (6): 1789–1793. Дои:10.1073 / pnas.0606144104. ЧВК 1794275. PMID 17261801.
- ^ Медлок, Эми Э .; Картер, Майкл; Дейли, Тамара А .; Дэйли, Гарри А .; Ланзилотта, Уильям Н. (октябрь 2009 г.). «Выпуск продукта, а не хелатирование, определяет металло-специфичность феррохелатазы». Журнал молекулярной биологии. 393 (2): 308–319. Дои:10.1016 / j.jmb.2009.08.042. ЧВК 2771925. PMID 19703464.
дальнейшее чтение
- Cox TM (июнь 1997 г.). «Эритропоэтическая протопорфирия». Журнал наследственных метаболических заболеваний. 20 (2): 258–69. Дои:10.1023 / А: 1005317124985. PMID 9211198. S2CID 12493042.
- Бреннер Д.А., Дидье Дж.М., Фрейзер Ф., Кристенсен С.Р., Эванс Г.А., Дейли ГА (июнь 1992 г.). «Молекулярный дефект протопорфирии человека». Американский журнал генетики человека. 50 (6): 1203–10. ЧВК 1682545. PMID 1376018.
- Накахаши Ю., Фудзита Х, Такетани С., Исида Н., Каппас А., Сасса С. (январь 1992 г.). «Молекулярный дефект феррохелатазы у пациента с эритропоэтической протопорфирией». Труды Национальной академии наук Соединенных Штатов Америки. 89 (1): 281–5. Дои:10.1073 / pnas.89.1.281. ЧВК 48220. PMID 1729699.
- Ламорил Дж., Булехфар С., де Верней Х., Грандшан Б., Нордманн Ю., Дейбах Дж. К. (декабрь 1991 г.). «Эритропоэтическая протопорфирия человека: две точечные мутации в гене феррохелатазы». Сообщения о биохимических и биофизических исследованиях. 181 (2): 594–9. Дои:10.1016 / 0006-291X (91) 91231-Z. PMID 1755842.
- Накахаши Ю., Такетани С., Окуда М., Иноуэ К., Токунага Р. (декабрь 1990 г.). «Молекулярное клонирование и анализ последовательности кДНК, кодирующей феррохелатазу человека». Сообщения о биохимических и биофизических исследованиях. 173 (2): 748–55. Дои:10.1016 / S0006-291X (05) 80099-3. PMID 2260980.
- Росси Э., Аттвуд П.В., Гарсия-Уэбб П., Костин К.А. (май 1990 г.). «Ингибирование активности феррохелатазы лимфоцитов человека гемином». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1038 (3): 375–81. Дои:10.1016 / 0167-4838 (90) 90251-А. PMID 2340297.
- Полсон Р.Дж., Лим С.К., Роллес К., Калне Р.Й., Уильямс Р. (сентябрь 1988 г.). «Эффект трансплантации печени 13-летнему мальчику с эритропоэтической протопорфирией». Трансплантация. 46 (3): 386–9. Дои:10.1097/00007890-198809000-00010. PMID 3047929.
- Бонковский Х.Л., Шнед А.Р. (январь 1986 г.). «Смертельная печеночная недостаточность при протопорфирии. Синергизм между избытком этанола и генетическим дефектом». Гастроэнтерология. 90 (1): 191–201. Дои:10.1016/0016-5085(86)90093-4. PMID 3940245.
- Prasad AR, Dailey HA (август 1995 г.). «Влияние клеточного расположения на функцию феррохелатазы». Журнал биологической химии. 270 (31): 18198–200. Дои:10.1074 / jbc.270.31.18198. PMID 7629135.
- Саркани Р.П., Александр Г.Дж., Cox TM (июнь 1994 г.). «Рецессивное наследование эритропоэтической протопорфирии с печеночной недостаточностью». Ланцет. 343 (8910): 1394–6. Дои:10.1016 / S0140-6736 (94) 92525-9. PMID 7910885. S2CID 42243172.
- Тугорес А., Магнесс СТ, Бреннер Д.А. (декабрь 1994 г.). «Один промотор управляет как хозяйственной, так и эритроидной преимущественной экспрессией гена феррохелатазы человека». Журнал биологической химии. 269 (49): 30789–97. PMID 7983009.
- Дейли Х.А., Селлерс В.М., Дейли Т.А. (январь 1994 г.). "Феррохелатаза млекопитающих. Экспрессия и характеристика нормальной и двух протопорфирных феррохелатаз человека". Журнал биологической химии. 269 (1): 390–5. PMID 8276824.
- Ван X, По-Фитцпатрик М., Карриеро Д., Остасевич Л., Чен Т., Такетани С., Пиомелли С. (апрель 1993 г.). «Новая мутация в эритропоэтической протопорфирии: аберрантная мРНК феррохелатазы, вызванная пропуском экзона во время сплайсинга РНК». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1181 (2): 198–200. Дои:10.1016 / 0925-4439 (93) 90112-э. PMID 8481408.
- Накахаши Й, Миядзаки Х, Кадота Й, Найто Й, Иноуэ К., Ямамото М., Хаяси Н., Такетани С. (май 1993 г.). «Молекулярный дефект в эритропоэтической протопорфирии человека со смертельной печеночной недостаточностью». Генетика человека. 91 (4): 303–6. Дои:10.1007 / BF00217346. PMID 8500787. S2CID 5844599.
- Имото С., Танизава Ю., Сато Ю., Каку К., Ока Ю. (июль 1996 г.). «Новая мутация в гене феррохелатазы, связанная с эритропоэтической протопорфирией». Британский журнал гематологии. 94 (1): 191–7. Дои:10.1046 / j.1365-2141.1996.d01-1771.x. PMID 8757534. S2CID 27290533.
- Крауз Б.Р., Селлерс В.М., Финнеган М.Г., Дейли Х.А., Джонсон М.К. (декабрь 1996 г.). «Сайт-направленный мутагенез и спектроскопическая характеристика феррохелатазы человека: идентификация остатков, координирующих кластер [2Fe-2S]». Биохимия. 35 (50): 16222–9. Дои:10.1021 / bi9620114. PMID 8973195.
внешняя ссылка
- UMich Ориентация белков в мембранах белок / pdbid-1hrk
- Феррохелатаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)



