Макроцикл - Macrocycle

Макроциклы часто описываются как молекулы и ионы, содержащие двенадцатичленное или более-членное кольцо. Классические примеры включают краун-эфиры, каликсарены, порфирины, и циклодекстрины. Макроциклы описывают обширную зрелую область химии.[2]
Примечание 1. Циклическая макромолекула не имеет концевых групп, но, тем не менее, может рассматриваться как цепочка.
Примечание 2: в литературе термин макроцикл иногда используется для молекул с низкой относительной молекулярной массой, которые не считаются макромолекулами.[3]Синтез
Образование макроциклов за счет замыкания кольца называется макроцилизация.[4] Сообщалось о новаторской работе по изучению терпеноид макроциклы.[5] Основная проблема макроциклизации состоит в том, что реакции замыкания кольца не способствуют образованию больших колец. Вместо этого, как правило, образуются небольшие кольца или полимеры. Эту кинетическую проблему можно решить, используя реакции с высоким разбавлением, при этом внутримолекулярные процессы предпочтительнее полимеризации.[6]
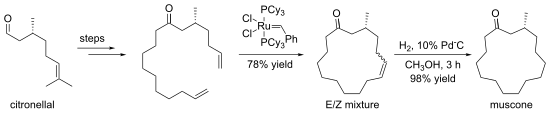
Некоторые макроциклизации предпочтительны при использовании шаблонные реакции. Шаблоны - это ионы, молекулы, поверхности и т. Д., Которые связывают и упорядочивают соединения, направляя их к образованию кольца определенного размера.[7] В краун-эфиры часто образуются в присутствии катиона щелочного металла, который организует конденсирующиеся компоненты путем комплексообразования.[8] Иллюстративной макроциклизацией является синтез (-) -Muscone из (+) -цитронеллаль. 15-членное кольцо образуется метатезис замыкающего кольца.[9]

Возникновение и приложения
Одним из важных приложений являются многие макроциклические антибиотики, макролиды, например кларитромицин. Многие металлокофакторы связаны с макроциклическими лигандами, включая порфирины, Corrins, и хлорины. Эти кольца возникают в результате многоступенчатых биосинтетических процессов, которые также включают макроциклы.
Макроциклы часто связывают ионы и способствуют ионный транспорт через гидрофобные мембраны и растворители. Макроцикл окружает ион гидрофобной оболочкой, которая способствует фазовый переход свойства.[11]

Макроциклы часто биоактивны и могут быть полезны для доставки лекарств.[12][13]
Подразделения
использованная литература
- ^ Гамильтон-Миллер, JM (1973). «Химия и биология полиеновых макролидных антибиотиков». Бактериологические обзоры. 37 (2): 166–196. ЧВК 413810. PMID 4578757.
- ^ Чжичан Лю; Шива Кришна Мохан Наллурия; Дж. Фрейзер Стоддарт (2017). «Обзор макроциклической химии: от гибких краун-эфиров до жестких циклофанов». Обзоры химического общества. 46 (9): 2459–2478. Дои:10.1039 / c7cs00185a. PMID 28462968.
- ^ Р. Дж. Джонс; Я. Каховец; Р. Степто; Э. С. Уилкс; М. Гесс; Т. Китайма; В. В. Метаномский (2008). ИЮПАК. Сборник терминологии и номенклатуры полимеров, Рекомендации ИЮПАК 2008 г. («Фиолетовая книга») (PDF). RSC Publishing, Кембридж, Великобритания.
- ^ Франсуа Дидерих; Питер Дж. Стэнг; Рик Р. Тыквински, ред. (2008). Современная супрамолекулярная химия: стратегии синтеза макроциклов. Wiley ‐ VCH. Дои:10.1002/9783527621484. ISBN 9783527621484.
- ^ Х. Хёкер (2009). «Циклические и макроциклические органические соединения - личный отзыв в честь профессора Леопольда Ружички». Циклические и макроциклические органические соединения, Кем. Ind. 58: 73–80.
- ^ Висенте Марти-Сентеллес; Мритуанджай Д. Пандей; Г-н Изабель Бургете; Сантьяго В. Луис (2015). «Реакции макроциклизации: важность конформационной, конфигурационной и вызванной шаблоном предварительной организации». Chem. Rev. 115 (16): 8736–8834. Дои:10.1021 / acs.chemrev.5b00056. PMID 26248133.
- ^ Гербелеу, Николай В .; Арион, Владимир Б .; Берджесс, Джон (2007). Николай В. Гербелеу; Владимир Б. Арион; Джон Берджесс (ред.). Матричный синтез макроциклических соединений. Wiley ‐ VCH. Дои:10.1002/9783527613809. ISBN 9783527613809.
- ^ Педерсен, Чарльз Дж. (1988). "Макроциклические полиэфиры: простой полиэфир дибензо-18-краун-6 и дициклогексил-18-краун-6 полиэфир". Органический синтез.; Коллективный объем, 6, п. 395
- ^ Камат, В.П .; Hagiwara, H .; Кацуми, Т .; Hoshi, T .; Сузуки, Т .; Андо, М. (2000). «Направленный синтез (R) - (-) - мускон из (+) - цитронеллаля» - метатезис с замыканием кольца ». Тетраэдр. 56 (26): 4397–4403. Дои:10.1016 / S0040-4020 (00) 00333-1.
- ^ Пол Р. Ортис де Монтельяно (2008). «Гемы в биологии». Энциклопедия химической биологии Wiley. Джон Вили и сыновья. Дои:10.1002 / 9780470048672.wecb221. ISBN 978-0470048672.
- ^ Чой, Киханг; Гамильтон, Эндрю Д. (2003). «Макроциклические анионные рецепторы, основанные на направленных взаимодействиях водородных связей». Обзоры координационной химии. 240 (1–2): 101–110. Дои:10.1016 / с0010-8545 (02) 00305-3.
- ^ Эрмерт, Филипп (2017-10-25). «Дизайн, свойства и недавнее применение макроциклов в медицинской химии». Международный химический журнал CHIMIA. 71 (10): 678–702. Дои:10.2533 / chimia.2017.678. PMID 29070413.
- ^ Марсо, Эрик; Петерсон, Марк Л. (14 апреля 2011 г.). «Макроциклы - это большие циклы: приложения, возможности и проблемы синтетических макроциклов в открытии лекарств». Журнал медицинской химии. 54 (7): 1961–2004. Дои:10.1021 / jm1012374. ISSN 0022-2623. PMID 21381769.
дальнейшее чтение
- Chambron, J-C .; Dietrich-Buchecker, C .; Hemmert, C .; Khemiss, A-K .; Mitchell, D .; Sauvage, JP .; Вайс, Дж. (1990). «Переплетение молекулярных нитей на переходных металлах» (PDF). Pure Appl. Chem. 62 (6): 1027–34. Дои:10.1351 / pac199062061027.
- Иода, Масахико; Ямакава, Джун; Рахман, М. Джалилур (2011-11-04). «Сопряженные макроциклы: концепции и приложения». Angewandte Chemie International Edition. 50 (45): 10522–10553. Дои:10.1002 / anie.201006198. ISSN 1521-3773. PMID 21960431.