Химия между хозяином и гостем - Host–guest chemistry
В супрамолекулярная химия,[1] химия между хозяином и гостем описывает комплексы которые состоят из двух или более молекулы или же ионы которые удерживаются вместе в уникальных структурных отношениях силами, отличными от сил полного ковалентные связи. Химия хозяина и гостя включает в себя идею молекулярного распознавания и взаимодействия через нековалентная связь. Нековалентное связывание имеет решающее значение для поддержания трехмерной структуры больших молекул, таких как белки, и участвует во многих биологических процессах, в которых большие молекулы специфически, но временно связываются друг с другом.
Хотя нековалентные взаимодействия можно грубо разделить на те, которые имеют более электростатический или дисперсионный вклад, существует несколько обычно упоминаемых типов нековалентных взаимодействий: ионная связь, водородная связь, силы Ван дер Ваальса и гидрофобные взаимодействия.[2]

Обзор
Хост-гость химия - это ветвь супрамолекулярная химия в котором хозяин молекула образует химическое соединение с гостевой молекулой или ионом. Два компонента соединения удерживаются вместе нековалентными силами, чаще всего за счет водородная связь. Связывание между хозяином и гостем обычно очень специфично для двух рассматриваемых групп. Формирование этих комплексов является центральным вопросом молекулярное распознавание.
Существует равновесие между несвязанным состоянием, в котором хост и гость отделены друг от друга, и связанным состоянием, в котором существует структурно определенный комплекс хост-гость:
- H = "хост", G = "гость", HG = "комплекс хост-гость"
Компонент «хозяин» можно рассматривать как большую молекулу, и он включает меньшую, «гостевую» молекулу. В биологических системах аналогичные термины хозяин и гость обычно называют фермент и субстрат соответственно.[5]
Для создания синтетических систем, выполняющих определенные функции и задачи, очень важно понимать термодинамику связывания между хостом и гостем. Химики сосредотачиваются на обмене энергией различных связывающих взаимодействий и пытаются разработать научные эксперименты для количественной оценки фундаментального происхождения этих нековалентных взаимодействий, используя различные методы, такие как ЯМР-спектроскопия, УФ / видимая спектроскопия и калориметрия изотермического титрования.[6] Количественный анализ значений констант связывания дает полезную термодинамическую информацию.[5]
Термодинамические принципы взаимодействия хозяин-гость
Термодинамические преимущества химии хозяин-гость основаны на идее, что существует более низкий общий Свободная энергия Гиббса из-за взаимодействия между молекулами хозяина и гостя. Химики всесторонне пытаются измерить энергетические и термодинамические свойства этих нековалентных взаимодействий, обнаруживаемых во всей супрамолекулярной химии; и тем самым надеемся получить дальнейшее понимание комбинаторного результата этих многих малых нековалентных сил, которые используются для создания общего воздействия на супрамолекулярную структуру.
An константа ассоциации, можно определить выражением
где {HG} - термодинамическая активность комплекса в равновесии. {H} представляет активность хоста, а {G} активность гостя. Количество , и - соответствующие концентрации и является частным от коэффициенты активности.
На практике константа равновесия обычно определяется в терминах концентраций.
Когда используется это определение, подразумевается, что частное коэффициенты активности имеет числовое значение, равное единице. Тогда оказывается, что константа равновесия, имеет измерение 1 / концентрация, но это не может быть правдой, поскольку стандартное изменение свободной энергии Гиббса пропорциональна логарифму K.
Этот кажущийся парадокс разрешается, когда измерение является определенный быть величиной, обратной величине отношения концентраций. Подразумевается, что считается имеющим постоянное значение во всех соответствующих экспериментальных условиях. Тем не менее, общепринято добавлять размер, такой как миллимоль на литр или микромоль на литр, к значению K что было определено экспериментально.
Большой Значение указывает на то, что молекулы хозяина и гостя сильно взаимодействуют с образованием комплекса хозяин-гость.
Определение значений констант привязки
Простое сочетание хозяина и гостя
Когда молекулы хозяина и гостя объединяются, чтобы сформировать единый комплекс, равновесие представляется как
а константа равновесия K определяется как
где [X] обозначает концентрацию химического вещества X (предполагается, что все коэффициенты активности имеют числовые значения 1). Уравнения баланса массы в любой точке данных,
куда и представляют собой общие концентрации хозяина и гостя, могут быть сведены к одному квадратному уравнению, скажем, в [G], и поэтому могут быть решены аналитически для любого заданного значения K. Затем концентрации [H] и [HG] могут быть выведены .
Следующим шагом в расчете является вычисление значения, , величины, соответствующей наблюдаемой величине . Тогда сумма квадратов U по всем точкам данных np может быть определена как
и это можно свести к минимуму в отношении значения константы стабильности, K, и такого параметра, как химический сдвиг вещества HG (данные ЯМР) или его молярной поглощающей способности (данные УФ / видимого света). Минимизацию можно выполнить в приложении для работы с электронными таблицами, например EXCEL с помощью встроенной утилиты SOLVER.
Эту процедуру следует использовать только в том случае, если точно известно, что аддукт 1: 1 является единственным образующимся комплексом. Простая проверка справедливости этого утверждения состоит в том, что невязки, должен показать случайное распределение; в противном случае следует рассмотреть возможность образования второго вида, используя методы, описанные в следующем разделе.
Данные ядерного магнитного резонанса (ЯМР)
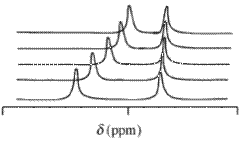
С ядерный магнитный резонанс (ЯМР) спектры наблюдаемых химический сдвиг ценить, δ, возникающие из данного атома, содержащегося в молекуле реагента, и одного или нескольких комплексов этого реагента, будут средневзвешенными по концентрации всех сдвигов этих химических соединений. Химический обмен считается быстрым по шкале времени ЯМР. условия мольные доли,
химический сдвиг яй химический вид, который содержит ядро и - концентрация / мольная доля ( c - концентрация / моль дм−3) этого вида. Это выражение имеет ту же математическую форму, что и Закон пива. Значения химического сдвига могут быть получены для более чем одного ядра аналогичным способом, при котором поглощение может быть измерено на более чем одной длине волны. Типичные изотопы, которые могут использоваться в этом контексте: 1ЧАС,13C и 31P. Обычно используется дейтерированный растворитель при измерении 1Значения химического сдвига H.
Данные по абсорбции

Предполагается, что поглощение каждого вида пропорционален концентрации этого вида в соответствии с Закон Бера-Ламберта.
где λ - длина волны, - длина оптического пути кюветы, содержащей раствор N соединения (хромофоры ), молярное поглощение (также известное как коэффициент экстинкции) яй химический вид на длине волны λ, cя это его концентрация. Когда концентрации были рассчитаны, как указано выше, и оптическая плотность была измерена для образцов с различными концентрациями хозяина и гостя, закон Бера-Ламберта дает набор уравнений для заданной длины волны, которые можно решить линейным методом наименьших квадратов. процесс для неизвестных значений коэффициента экстинкции на этой длине волны.
Данные флуоресценции
Обработка данных этого типа аналогична обработке данных оптической плотности. Фактически уравнение, определяющее связь между интенсивность флуоресценции и концентрации видов очень похожи.
куда - интенсивность флуоресценции i-го вида при единице концентрации.
Калориметрия
Тепло, выделяющееся при добавлении аликвоты раствора хозяина к раствору, содержащему гостя, представляет собой сумму вкладов каждой реакции.
куда - измеренное значение изменения тепла (скорректированное с учетом всех посторонних вкладов тепла) в точке данных j, количество тепла, поглощаемого или выделяемого, когда 1 моль яобразуется й продукт реакции и представляет собой фактическое изменение количества молей этого продукта в данной точке данных. рассчитывается путем решения уравнений баланса масс с заданными значениями констант равновесия. Если значения констант равновесия известны, стандартное изменение энтальпии может быть рассчитано с помощью линейного процесса наименьших квадратов, в противном случае необходимо использовать нелинейный метод подбора данных.
Изотермическая калориметрия титрования обычно используется для определения значений как константы равновесия, так и соответствующей стандартной энтальпии реакции. Производители приборов ITC поставляют некоторое программное обеспечение, с помощью которого эти величины могут быть получены из значений экспериментальных данных.
Общая реакция комплексообразования
Для каждого равновесия с участием хозяина H и гостя G
константа равновесия, , определяется как
Значения свободных концентраций, и получаются путем решения уравнений баланса массы с известными или оценочными значениями констант устойчивости.
Затем концентрации каждого комплексного вида можно также рассчитать как . Взаимосвязь между концентрацией вида и измеряемой величиной зависит от метода измерения, как указано в каждом разделе выше. Используя это соотношение, набор параметров, значения констант стабильности и значения свойств, таких как молярная поглощающая способность или заданные химические сдвиги, могут быть уточнены нелинейным наименьших квадратов процесс доработки. Более подробное изложение теории см. Определение констант равновесия. Некоторые специализированные компьютерные программы перечислены на Реализации.
Определение стандартных значений энтальпии и изменения энтропии
Рассмотрим, во-первых, систему, в которой раствор содержит определенное количество хоста, ЧАС, и гость, грамм, в равновесии с одиночным комплексом HG.
Теперь предположим, что небольшое количество гостя добавлено к смеси хозяина и гостя в состоянии равновесия. Тогда будет установлено новое равновесие и количество тепла, Q будет развиваться. Когда эта величина была измерена и скорректирована с учетом инструментальных факторов, она связана с изменением количества сложного HG что присутствует в растворе.
где ΔЧАС⊖ это стандартная энтальпия образования, то есть энтальпия образования 1 моля комплекса, HG и изменение количества родинок вида HG в растворе.
Если значение константы равновесия, , как известно, величина можно рассчитать, решив уравнения баланса масс до и после добавления (см. # Простое объединение хозяев и гостей, над). Тогда значение ΔЧАС⊖ может быть получен методом линейной аппроксимации методом наименьших квадратов серией экспериментальных значений Q.
Если значение K неизвестно, необходимо выполнить нелинейное уточнение методом наименьших квадратов, чтобы получить два параметра, и . Когда данные получены с использованием Изотермическая калориметрия титрования программное обеспечение, необходимое для расчетов, поставляется производителем прибора.
Примечание: использование уравнение Ван 'т Гоффа для расчета стандартного изменения энтальпии не рекомендуется, поскольку значение, полученное с помощью этого метода, вероятно, будет зависеть от чрезмерная ошибка.
В общем, когда м комплексы образуются теплом, выделяемым на kТочка «титрования» - это сумма вкладов, возникающих в результате изменения концентрации продукта реакции.
Есть 2м параметр, который необходимо определить, стандартное изменение энтальпии и константу равновесия для образования каждого продукта реакции. Производители приборов ITC поставляют несколько специальных программных продуктов, с помощью которых можно рассчитывать несколько значений параметров. Компьютерные программы для общего случая, такие как HypΔH. Affinimeter ITC также доступны.
Когда значения каждого стандартного изменения энтальпии и константы равновесия были определены, значение соответствующего стандартного изменения энтропии может быть получено из выражения
при данной температуре, Т.
Экспериментальные техники
Ядерный магнитный резонанс
Ядерный магнитный резонанс (ЯМР) - один из самых мощных спектроскопических методов в аналитической химии. Это важный инструмент для изучения комплексов хозяин-гость, для выяснения структур различных комплексов, существующих в форме агрегатов, ионная пара или инкапсулированные системы. Как следует из названия, ЯМР идентифицирует различные ядра в молекулах (чаще всего протон ), измеряя их химический сдвиг. Связывающая активность двух молекул вызывает значительное изменение их электронного окружения. Это приводит к сдвигу сигналов в спектре ЯМР, и этот основной принцип используется для изучения явлений химии хозяин-гость. Движущими силами связывания хозяина и гостя являются различные вторичные взаимодействия между молекулами, такие как водородная связь и пи – пи взаимодействие. Таким образом, ЯМР также служит важным методом для установления наличия этих взаимодействий в комплексе хозяин-гость.[7]

Предыдущие исследования ЯМР дали полезную информацию о связывании разных гостей с хозяевами. Fox et al.[8] рассчитал взаимодействия водородных связей между молекулами пиридина и поли (амидоамином) (ПАМАМ) дендример; на основе химического сдвига амин и амид группы. В аналогичном исследовании Xu et al.[9] титрованный карбоксилат основали дендример G4 PAMAM (хозяин) с различными препаратами на основе амина (гости) и контролировали химические сдвиги дендримера. В сочетании с 2D-NOESY С помощью методов ЯМР они смогли точно определить положение лекарств на дендримерах и влияние функциональности на аффинность связывания лекарств. Они нашли убедительные доказательства того, что катионный молекулы лекарства прикрепляются к поверхности анионный дендримеры за счет электростатических взаимодействий, тогда как анионное лекарственное средство локализуется как в ядре, так и на поверхности дендримеров, и что сила этих взаимодействий зависит от pKa значения молекул.
В другом исследовании Sun et al.[9] изучал химию хозяина и гостя рутений молекулы трисбипиридил-виологена с кукурбитурил. При наблюдении за изменением химических сдвигов пиридин протоны на виологен, они обнаружили, что способы связывания комплексов 1: 1 полностью различны для разных молекул кукурбитурила.
Важный фактор, который следует учитывать при анализе привязки между хостом и гостем, - это время, необходимое для сбора данных, по сравнению со временем для события привязки. Во многих случаях события связывания происходят намного быстрее, чем шкала времени сбора данных, и в этом случае выходной сигнал представляет собой усредненный сигнал для отдельных молекул и комплекса. Шкала времени ЯМР составляет порядка миллисекунд, что в некоторых случаях, когда реакция связывания протекает быстро, ограничивает точность метода.[5]
Ультрафиолетовая видимая спектроскопия
Ультрафиолетовая видимая спектроскопия это один из самых старых и быстрых методов изучения связывающей активности различных молекул. Поглощение УФ-излучение происходит в масштабе времени пикосекунды, следовательно, можно наблюдать отдельные сигналы от вида. В то же время интенсивность поглощения напрямую коррелирует с концентрацией веществ, что позволяет легко рассчитать константу ассоциации.[5] Чаще всего либо хозяин, либо гость прозрачны для УФ-света, в то время как другая молекула чувствительна к УФ-излучению. Таким образом, отслеживается изменение концентрации чувствительных к УФ-излучению молекул и устанавливается на прямую линию с помощью Метод Бенези – Хильдебранда, из которого может быть непосредственно вычислена константа ассоциации.
Дополнительная информация о стехиометрии комплексов также получена, поскольку метод Бенези – Хильдербранда предполагает стехиометрию 1: 1 между хозяином и гостем. Данные будут давать прямую линию только в том случае, если образование комплекса также следует аналогичной стехиометрии 1: 1. Недавний пример подобного расчета был сделан Sun et al.,[9] где они титровали молекулы трисбипиридил-виологена рутения кукурбит [7] урилами и строили график относительного поглощения молекул кукурбита как функции его общей концентрации при определенной длине волны. Данные хорошо соответствуют модели связывания 1: 1 с константой связывания .
В качестве расширения можно подогнать данные к разным стехиометриям, чтобы понять кинетику событий связывания между хозяином и гостем.[10] использовали это следствие, чтобы немного изменить обычный график Бенези-Хильдербранда, чтобы получить порядок реакции комплексообразования между барийсодержащим краун-эфирным мостиковым хиральным гетеротринудерным комплексом салена Zn (II) (хозяин) с различными гостевыми имидазолами и метиловыми эфирами аминокислот, наряду с другими параметрами. Они титровали фиксированную концентрацию комплекса цинка с различными количествами имидазолов и метиловых эфиров, отслеживая изменения в оптической плотности переходной полосы пи-пи * при 368 нм. Данные соответствуют модели, в которой отношение гостя к хосту равно 2 в комплексе. Далее они провели эти эксперименты при различных температурах, что позволило им рассчитать различные термодинамические параметры, используя уравнение Ван 'т Гоффа.
Изотермическая калориметрия титрования
Спектроскопические методы дают информацию о константа привязки и Свободная энергия Гиббса, . Чтобы получить полный набор термодинамических параметров, таких как и , анализ Ван 'т Гоффа с использованием уравнение Ван 'т Гоффа потребуется. Однако недавнее появление калориметрических методов позволяет измерять и в одном эксперименте, что позволяет определить все термодинамические параметры с помощью уравнения:
при условии, что эксперимент проводится в изотермических условиях; отсюда и название изотермическая калориметрия. Процедура аналогична традиционной процедуре титрования, в которой хозяин последовательно добавляется к гостю и измеряется поглощенное или выделяемое тепло по сравнению с холостым раствором. Общее выделенное тепло, Q, соответствует константе ассоциации, , и уравнением:
Что можно упростить как
Где
- = Начальная молярная концентрация хозяина
- = Молярная концентрация гостя
- = объем сосуда
Приведенное выше уравнение может быть решено с помощью нелинейного регрессионного анализа для получения значения и и впоследствии и для этой конкретной реакции.[5]Преимущества калориметрии изотермического титрования перед другими широко используемыми методами, помимо предоставления полного набора термодинамических параметров, заключаются в том, что она является более общей и подходит для широкого круга молекул. Нет необходимости иметь соединения с хромофорами или функциональными группами в УФ-видимом диапазоне, чтобы контролировать процесс связывания, поскольку тепловой сигнал является универсальным свойством реакций связывания. В то же время отношение сигнал / шум довольно благоприятное, что позволяет более точно определять константы связывания даже в очень разбавленных условиях.[11]Недавним примером использования этого метода было изучение аффинности связывания белок мембрана, окружающая кишечная палочка к липофильным катионам, используемым в лекарствах в различных мембранных миметических средах. Мотивацией для вышеупомянутого исследования было то, что эти мембраны делают бактерии устойчивыми к большинству соединений на основе катион четвертичного аммония, обладающие антибактериальным действием. Таким образом, понимание явлений связывания позволит разработать эффективные антибиотики для лечения Кишечная палочка. Исследователи поддерживали значительный избыток лиганда над белком, чтобы реакция связывания завершилась. Используя приведенные выше уравнения, исследователи приступили к расчету , , и для каждого препарата в разных средах. Данные показали, что стехиометрия связывания лекарственного средства с мембраной составляла 1: 1 с микромолярным значением . Отрицательные значения , и указали, что процесс был обусловлен энтальпией со значением 8–12 ккал / моль для каждого лекарства.[12]
Приложения
Рамановская спектроскопия
Рамановская спектроскопия это спектроскопический метод, используемый для изучения молекул, проявляющих Рамановское рассеяние эффект, когда монохромный на него падает свет. Основное требование для получения рамановского сигнала заключается в том, что падающий свет вызывает электронный переход химического вещества из его основного состояния в состояние виртуальной энергии, которое будет излучать фотон при возврате в основное состояние. Разница в энергии между поглощенным и испускаемым фотоном уникальна для каждого химического вещества в зависимости от его электронного окружения. Следовательно, этот метод служит важным инструментом для изучения различных событий связывания, поскольку связывание между молекулами почти всегда приводит к изменению их электронного окружения. Однако то, что делает рамановскую спектроскопию уникальной техникой, состоит в том, что только переходы, которые сопровождаются изменением поляризация молекулы являются комбинационно активными. Структурная информация, полученная из спектров комбинационного рассеяния, дает очень конкретную информацию об электронной конфигурации комплекса по сравнению с отдельными молекулами хозяина и гостя.

Рамановская спектроскопия в фазе раствора часто дает слабое сечение рассеяния. Поэтому в последнее время были достигнуты успехи в улучшении рамановских сигналов, например Рамановская спектроскопия с усилением поверхности, и Резонансная рамановская спектроскопия. Такие методы служат дополнительной цели количественной оценки событий связывания анализируемого вещества с рецептором, давая более подробную картину феномена комплексообразования хозяин-гость, где они действительно имеют место; в растворах. В недавнем прорыве Flood et al. определила силу связывания тетратиафульвален (TTF) и циклобис (паракват-п-фенилен) с использованием рамановской спектроскопии[13] а также SERS.[14] Предыдущая работа в этой области была направлена на предоставление информации о связи и структуре полученного комплекса, а не на количественные измерения силы ассоциации. Исследователям пришлось использовать резонансную рамановскую спектроскопию, чтобы иметь возможность получать детектируемые сигналы от растворов с концентрацией всего 1 мМ. В частности, они коррелировали интенсивность полос комбинационного рассеяния с геометрией комплекса в фотовозбужденном состоянии. Подобно титрованию, основанному на ультрафиолетовой и видимой спектроскопии, они рассчитали константу связывания методом "рамановского титрования" и подогнали кривые связывания к моделям 1: 1, давая −5,7 ± 0,6 ккал / моль. В настоящее время это исследование служит основой для аналогичных исследований комплексов с переносом заряда в растворах.
Сотрудничество
Кооперативность определяется как когда лиганд связывается с рецептором с более чем одним сайтом связывания, лиганд вызывает уменьшение или увеличение сродства к входящим лигандам. Если происходит увеличение связывания последующих лигандов, это считается положительной кооперативностью. Если наблюдается уменьшение связывания, то это отрицательная кооперативность. Примеры положительного и отрицательного сотрудничества: гемоглобин и рецептор аспартата соответственно.[15]

В последние годы изучались термодинамические свойства кооперативности, чтобы определить математические параметры, которые различают положительную или отрицательную кооперативность. Традиционное уравнение свободной энергии Гиббса гласит: . Однако, чтобы количественно оценить кооперативность в системе хозяин-гость, необходимо учитывать энергию связи. Схема справа показывает связывание A, связывание B, положительное кооперативное связывание A – B и, наконец, отрицательное кооперативное связывание A – B. Следовательно, альтернативной формой уравнения свободной энергии Гиббса было бы
куда:
- = свободная энергия связи A
- = свободная энергия связи B
- = свободная энергия связи для A и B, связанных
- = сумма свободных энергий связи
Считается, что если больше чем сумма и , это положительно сотрудничество. Если меньше, то отрицательно кооперативен.[16]Химия хозяин-гость не ограничивается взаимодействиями рецептор-лингв. Это также демонстрируется в системах ионного спаривания. В последние годы такие взаимодействия изучаются в водной среде с использованием синтетических металлоорганических хозяев и органических гостевых молекул. Например, поликатионный рецептор, содержащий медь (хозяин), координируется с такими молекулами, как тетракарбоксилаты, трикарбаллат, аспартат и ацетат (гости). Это исследование показывает, что энтропия скорее, чем энтальпия определяет энергию связи системы, приводящую к отрицательной кооперативности. Большое изменение энтропии происходит из-за смещения молекул растворителя, окружающих лиганд и рецептор. Когда несколько ацетатов связываются с рецептором, он выделяет в окружающую среду больше молекул воды, чем тетракарбоксилат. Это привело к уменьшению свободной энергии, что означает, что система взаимодействует отрицательно.[17] В аналогичном исследовании с использованием гуанидиния и Cu (II) и поликарбоксилатных гостей показано, что положительное взаимодействие в значительной степени определяется энтальпией.[18] Помимо термодинамических исследований, химия хозяин-гость также имеет биологические приложения.
Сверхпроводимость
При низких температурах и высоких давлениях висмут обнаруживает структуру «хозяин-гость». Это неожиданно приводит к сильной связи сверхпроводимости.[19]
Биологическое приложение

Дендримеры в системах доставки лекарств - пример различных взаимодействий хозяин-гость. Взаимодействие между хозяином и гостем, дендример и лекарство, соответственно, может быть гидрофобным или ковалентным. Гидрофобное взаимодействие между хозяином и гостем считается «инкапсулированным», в то время как ковалентное взаимодействие считается конъюгированным. Показано, что использование дендримеров в медицине улучшает доставку лекарств за счет увеличения растворимости и биодоступности лекарств. Вместе дендримеры могут увеличивать клеточное поглощение и способность к нацеливанию, а также снижать лекарственную устойчивость.[20]
Растворимость различных НПВП увеличивается, когда они инкапсулируются в дендримеры ПАМАМ.[21] Это исследование показывает усиление НПВП растворимость обусловлена электростатическим взаимодействием между поверхностными аминогруппами в ПАМАМ и карбоксильными группами, обнаруженными в НПВП. Повышению растворимости способствуют гидрофобные взаимодействия между ароматическими группами в лекарствах и внутренними полостями дендримера.[22] Когда лекарство инкапсулируется в дендример, его физические и физиологические свойства остаются неизменными, включая неспецифичность и токсичность. Однако, когда дендример и лекарство ковалентно связаны вместе, его можно использовать для нацеливания на определенные ткани и контролируемых скоростей высвобождения.[23] Ковалентное конъюгирование нескольких лекарственных средств на поверхности дендримеров может создавать проблему нерастворимости.[23][24]
Этот принцип также изучается для применения в лечении рака. Несколько групп инкапсулировали противораковые препараты, такие как: Камптотецин, Метотрексат, и Доксорубицин. Результаты этих исследований показали, что дендримеры обладают повышенной растворимостью в воде, замедленной скоростью высвобождения и, возможно, регулируют цитотоксичность лекарств.[20] Цисплатин был конъюгирован с дендримерами PAMAM, что дало те же фармакологические результаты, что и перечисленные выше, но конъюгация также помогла в накоплении цисплатин при солидных опухолях при внутривенном введении.[25]
Зондирование
Традиционно к химическому зондированию подходили с помощью системы, которая содержит ковалентно связанный индикатор с рецептором через линкер. После связывания аналита индикатор меняет цвет или флуоресцирует. Этот метод называется методом индикатор-спейсер-рецептор (ISR).[26] В отличие от ISR, анализ смещения индикатора (IDA) использует нековалентное взаимодействие между рецептором (хозяином), индикатором и аналитом (гостем). Подобно ISR, IDA также использует колориметрические (C-IDA) и флуоресцентные (F-IDA) индикаторы. В анализе IDA рецептор инкубируется с индикатором. Когда аналит добавляется в смесь, индикатор попадает в окружающую среду. Как только индикатор высвобождается, он либо меняет цвет (C-IDA), либо флуоресцирует (F-IDA).[27]

IDA предлагает несколько преимуществ по сравнению с традиционным методом химического зондирования ISR. Во-первых, не требуется, чтобы индикатор был ковалентно связан с рецептором. Во-вторых, поскольку ковалентной связи нет, с одним и тем же рецептором можно использовать разные индикаторы. Наконец, среды, в которых можно использовать анализ, разнообразны.[28]

Методы химического зондирования, такие как C-IDA, имеют биологические последствия. Например, протамин представляет собой коагулянт, который обычно вводят после сердечно-легочной хирургии, который противодействует антикоагулянтной активности гепина. Для количественного определения протамина в образцах плазмы используется колориметрический анализ замещения. Лазурь Краска синего цвета, когда она не связана, но когда она связана с херапином, она имеет фиолетовый цвет. Связывание между Azure A и гепарином слабое и обратимое. Это позволяет протамину вытеснять лазурь А. Когда краситель высвобождается, он приобретает пурпурный цвет. Степень вытеснения красителя пропорциональна количеству протамина в плазме.[29]
F-IDA использовалась Квальчиковски и его коллегами для мониторинга деятельности геликаза в Кишечная палочка. В этом исследовании они использовали тиазоловый оранжевый в качестве индикатора. Хеликаза раскручивает дцДНК с образованием оцДНК. Интенсивность флуоресценции тиазолового оранжевого имеет большее сродство к дцДНК, чем оцДНК, и его интенсивность флуоресценции увеличивается, когда он связан с дцДНК, чем когда он не связан.[30][31]
Конформационное переключение
А кристаллическое твердое вещество Традиционно рассматривается как статическая сущность, в которой движения ее атомных компонентов ограничены ее колебательным равновесием. Как видно по превращению графита в алмаз, превращение твердого тела в твердое может происходить под физическим или химическим давлением. Недавно было предложено, чтобы переход от одного кристаллического устройства к другому происходил кооперативным образом.[32][33] Большинство этих исследований было сосредоточено на изучении органических или металлоорганических структур.[34][35] Помимо исследований макромолекулярных кристаллических превращений, существуют также исследования монокристаллических молекул, которые могут изменять свою конформацию в присутствии органических растворителей. Было показано, что металлоорганический комплекс трансформируется в различные ориентации в зависимости от того, подвергается ли он воздействию паров растворителя или нет.[36]
Экологические приложения
Хост-гостевые системы использовались для удаления опасных материалов из окружающей среды. Они могут быть разных размеров и разных форм, чтобы улавливать различные химические гости. Одно из применений - способность п-трет-бутикаликс [4] арена улавливать ионы цезия. Цезий-137 радиоактивен, и его необходимо эффективно удалять из ядерных отходов. Химия «хозяин-гость» также использовалась для удаления канцерогенных ароматических аминов и их N-нитрозопроизводных из воды. Эти отходы используются во многих промышленных процессах и содержатся в различных продуктах, таких как пестициды, лекарства и косметика.[37][38]
Рекомендации
- ^ Стид, Джонатан В .; Этвуд, Джерри Л. (2009). Супрамолекулярная химия (2-е изд.). Вайли. п. 1002. ISBN 978-0-470-51234-0.
- ^ Lodish, H .; Берк, А .; Кайзер, К. (2008). Молекулярная клеточная биология. ISBN 978-0-7167-7601-7.
- ^ Фриман, Уэйд А. (1984). "Структуры п-ксилилендиаммонийхлорид и гидросульфат кальция аддукты кавитанда «кукурбитурил», C36ЧАС36N24О12". Acta Crystallographica B. 40 (4): 382–387. Дои:10.1107 / S0108768184002354.
- ^ Вальдес, Карлос; Толедо, Летисия М .; Шпиц, Урс; Ребек, Юлий (1996). «Структура и селективность малых димерных инкапсулирующих сборок». Chem. Евро. J. 2 (8): 989–991. Дои:10.1002 / chem.19960020814.
- ^ а б c d е Анслин, Эрик В .; Догерти, Деннис А. (2005). Современная физико-органическая химия. Макмиллан. ISBN 978-1-891389-31-3.
- ^ Piñeiro, Á .; Банки, X .; Pérez-Casas, S .; Товар, Э .; Гарсия, А .; Вилла, А .; Amigo, A .; Mark, A.E .; Костас, М. (2007). «О характеристике комплексов хозяин-гость: поверхностное натяжение, калориметрия и молекулярная динамика циклодекстринов с неионным поверхностно-активным веществом». Журнал физической химии B. 111 (17): 4383–92. Дои:10.1021 / jp0688815. PMID 17428087.
- ^ Ху, Дж; Cheng, Y; Ву, Q; Чжао, L; Сюй, Т. (2009). "Хозяин-гость химия комплексов дендример-лекарство. 2. Влияние молекулярных свойств гостей и поверхностных функций дендримеров". Журнал физической химии B. 113 (31): 10650–10659. Дои:10.1021 / jp9047055. PMID 19603764.
- ^ Санто, М; Фокс, М. (1999). «Взаимодействие водородных связей между дендримерами Starburst и несколькими молекулами, представляющими биологический интерес». Журнал физической органической химии. 12 (4): 293–307. Дои:10.1002 / (SICI) 1099-1395 (199904) 12: 4 <293 :: AID-POC88> 3.0.CO; 2-Q.
- ^ а б c Солнце, S; Zhang, R; Андерссон, S; Пан, Дж; Zou, D; Окермарк, Бьёрн; Солнце, Licheng (2007). "Химия хозяина-гостя и управляемый светом молекулярный замок Ru (bpy) 3-виологена с кукурбитом [7-8] урилами". Журнал физической химии B. 111 (47): 13357–13363. Дои:10.1021 / jp074582j. PMID 17960929.
- ^ Чжу; и другие. (1989). «Спектроскопия, ЯМР и DFT исследования молекулярного распознавания хирального гетеротриноядерного комплекса салена Zn (II) с мостиковым краун-эфиром». Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия. 62 (4–5): 886–895. Bibcode:2005AcSpA..62..886G. Дои:10.1016 / j.saa.2005.03.021. PMID 15897004.
- ^ Брандтс; и другие. (1989). «Быстрые измерения констант связывания и теплоты связывания с использованием нового калориметра для титрования». Аналитическая биохимия. 179 (1): 131–137. Дои:10.1016/0003-2697(89)90213-3. PMID 2757186.
- ^ Сикора, К; Тернер, Р. (2005). «Исследование связывания лиганда с белком множественной лекарственной устойчивости EmrE с помощью изотермической калориметрии титрования». Биофизический журнал. 88 (1): 475–482. Bibcode:2005BpJ .... 88..475S. Дои:10.1529 / biophysj.104.049247. ЧВК 1305024. PMID 15501941.
- ^ Witlicki, Edward H .; и другие. (2009). «Определение силы связывания комплекса хозяин-гость с использованием резонансного комбинационного рассеяния света». Журнал физической химии А. 113 (34): 9450–9457. Bibcode:2009JPCA..113.9450 Вт. Дои:10.1021 / jp905202x. PMID 19645430.
- ^ Witlicki, Edward H .; и другие. (2010). «Включение резонансного SERRS с использованием связи хромофор-плазмон, созданной комплексообразованием хост-гость на плазмонном наномассиве». Журнал Американского химического общества. 132 (17): 6099–6107. Дои:10.1021 / ja910155b. PMID 20387841.
- ^ Кошланд, Д. (1996). «Структурная основа отрицательной кооперативности: рецепторы и ферменты». Текущее мнение в структурной биологии. 6 (6): 757–761. Дои:10.1016 / S0959-440X (96) 80004-2. PMID 8994875.
- ^ Дженкс, В. П. (1981). «Об атрибуции и аддитивности энергий связи». Труды Национальной академии наук США. 78 (7): 4046–4050. Bibcode:1981PNAS ... 78.4046J. Дои:10.1073 / pnas.78.7.4046. ЧВК 319722. PMID 16593049.
- ^ Добжанская, Л; Lloyd, G; Esterhuysen, C; Барбур, L (2003). "Исследования термодинамического происхождения отрицательной кооперативности в распознавании ионных пар молекул". Журнал Американского химического общества. 125 (36): 10963–10970. Дои:10.1021 / ja030265o. PMID 12952478.
- ^ Hughes, A .; Анслин, Э (2007). «Катионный хозяин, демонстрирующий положительную кооперативность в воде». Труды Национальной академии наук США. 104 (16): 6538–6543. Bibcode:2007PNAS..104.6538H. Дои:10.1073 / pnas.0609144104. ЧВК 1871821. PMID 17420472.
- ^ Браун, Филипп; Семенюк, Константин; Ван, Диандиан; Монсеррат, Бартомеу; Пикард, Крис Дж .; Гроше, Ф. Мальте (1 апреля 2018 г.). «Сверхпроводимость сильной связи в квазипериодической структуре хозяин – гость». Достижения науки. 4 (4): eaao4793. Дои:10.1126 / sciadv.aao4793. ISSN 2375-2548. ЧВК 5898833. PMID 29662950.
- ^ а б Cheng, Y .; Wang, J .; Rao, T .; Он, X .; Сюй, Т. (2008). «Фармацевтическое применение дендримеров: перспективные наноносители для открытия лекарств». Границы биологических наук. 13 (13): 1447–1471. Дои:10.2741/2774. PMID 17981642.
- ^ Cheng, Y .; Сюй, Т. (2005). «Дендримеры как потенциальные переносчики лекарств. Часть I. Солюбилизация нестероидных противовоспалительных лекарств в присутствии дендримеров полиамидоаминов». Европейский журнал медицинской химии. 40 (11): 1188–1192. Дои:10.1016 / j.ejmech.2005.06.010. PMID 16153746.
- ^ Cheng, Y .; Сюй, Т; Фу, Р. (2005). «Дендримеры полиамидоаминов, используемые в качестве усилителей растворимости кетопрофена». Европейский журнал медицинской химии. 40 (12): 1390–1393. Дои:10.1016 / j.ejmech.2005.08.002. PMID 16226353.
- ^ а б Cheng, Y .; Сюй, Z; Ma, M .; Сюй, Т. (2007). «Дендримеры как носители лекарств: применение в различных путях введения лекарств». Журнал фармацевтических наук. 97 (1): 123–143. Дои:10.1002 / jps.21079. PMID 17721949.
- ^ Д’Эмануэль, А; Аттвуд, Д. (2005). «Дендример – лекарственные взаимодействия». Расширенные обзоры доставки лекарств. 57 (15): 2147–2162. Дои:10.1016 / j.addr.2005.09.012. PMID 16310283.
- ^ Малик, Н .; Evagorou, E .; Дункан, Р. (1999). «Дендример-платинат: новый подход к химиотерапии рака». Противораковые препараты. 10 (8): 767–776. Дои:10.1097/00001813-199909000-00010. PMID 10573209.
- ^ de Silva, A.P .; МакКоган, Б. МакКинни, Б.О. F .; Кверол, М. (2003). «Новые оптические молекулярные устройства из старой координационной химии». Dalton Transactions. 10 (10): 1902–1913. Дои:10.1039 / b212447p.
- ^ Анслин, Э. (2007). «Супрамолекулярная аналитическая химия». Журнал органической химии. 72 (3): 687–699. Дои:10.1021 / jo0617971. PMID 17253783.
- ^ Nguyen, B .; Анслин, Э. (2006). «Индикаторно-вытесняющие тесты». Coor. Chem. Ред. 250 (23–24): 3118–3127. Дои:10.1016 / j.ccr.2006.04.009.
- ^ Ян, В .; Fu, Y .; Teng, C .; Ma, S .; Шанберге, Дж. (1994). «Метод количественного определения протамина в плазме» (PDF). Исследование тромбоза. 74 (4): 427–434. Дои:10.1016/0049-3848(94)90158-9. HDL:2027.42/31577. PMID 7521974.
- ^ Eggleston, A .; Rahim, N .; Ковальчиковски, S; Ma, S .; Шанберге, Дж. (1996). «Метод количественного определения протамина в плазме». Исследования нуклеиновых кислот. 24 (7): 1179–1186. Дои:10.1093 / nar / 24.7.1179. ЧВК 145774. PMID 8614617.
- ^ Бьянкарди, Алессандро; Тарита, Бивер; Альберто, Марини; Бенедетта, Меннуччи; Фернандо, Секко (2011). «Тиазоловый оранжевый (ТО) в качестве датчика переключения света: комбинированное квантово-механическое и спектроскопическое исследование». Физическая химия Химическая физика. 13 (27): 12595–12602. Дои:10.1039 / C1CP20812H. PMID 21660321.
- ^ Этвуд, Дж; Barbour, L; Джерга, А; Шоттель, Л. (2002). «Гостевой транспорт в непористом органическом твердом теле посредством динамической ван-дер-ваальсовой кооперативности». Наука. 298 (5595): 1000–1002. Bibcode:2002Наука ... 298.1000A. Дои:10.1126 / science.1077591. PMID 12411698. S2CID 17584598.
- ^ Китагава, S; Уэмура, К. (2005). «Динамические пористые свойства координационных полимеров, вдохновленные водородными связями». Обзоры химического общества. 34 (2): 109–119. Дои:10.1039 / b313997m. PMID 15672175.
- ^ Соццани, П; Бракко, S; Коммоти, А; Ферретти, Р. Симонутти, Р. (2005). «Хранение метана и диоксида углерода в пористом кристалле Ван-дер-Ваальса». Angewandte Chemie. 44 (12): 1816–1820. Дои:10.1002 / anie.200461704. PMID 15662674.
- ^ Уэмура, К; Китагава, S; Фукуи, К; Сайто, К. (2004). «Устройство для динамического пористого каркаса: совместная адсорбция гостя на основе квадратных решеток, соединенных амидно-амидными водородными связями». Варенье. Chem. Soc. 126 (12): 3817–3828. Дои:10.1021 / ja039914m. PMID 15038736.
- ^ Добжанская, Л; Lloyd, G; Esterhuysen, C; Барбур, Л. (2006). «Индуцированное гостем конформационное переключение в монокристалле». Angewandte Chemie. 45 (35): 5856–5859. Дои:10.1002 / anie.200602057. PMID 16871642.
- ^ Эрик Хьюз; Джейсон Джордан; Терри Гуллион (2001). «Структурная характеристика системы [Cs (п-трет-бутилкаликс [4] арен -H) (MeCN)] гость – хозяин с помощью 13C-133Cs REDOR ЯМР». Журнал физической химии B. 105 (25): 5887–5891. Дои:10.1021 / jp004559x.
- ^ Серкан Эрдемир; Муфит Бахадир; Мустафа Йылмаз (2009). «Извлечение канцерогенных ароматических аминов из водного раствора с использованием производных каликс [n] арена в качестве носителей». Журнал опасных материалов. 168 (2–3): 1170–1176. Дои:10.1016 / j.jhazmat.2009.02.150. PMID 19345489.




![{ displaystyle K_ {a} ^ { ominus} = { frac { {HG }} { {H } {G }}} = { frac {[HG]} {[H] [ G]}} times Gamma}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{ displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{ displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{ displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{ displaystyle K_ {a} = { frac {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{ Displaystyle К = { гидроразрыва {[HG]} {[H] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{ displaystyle T_ {H} = [H] + K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{ Displaystyle T_ {G} = [G] + K [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{ displaystyle [H] = T_ {H} -T_ {G} + [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{ Displaystyle [HG] = К [H] [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)




















![{ displaystyle beta _ {pq} = { frac {[H_ {p} G_ {q}]} {[H] ^ {p} [G] ^ {q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{ displaystyle T_ {H} = [H] + sum p beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{ Displaystyle T_ {G} = [G] + sum q beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{ displaystyle [H_ {p} G_ {q}] = beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)













![{ displaystyle Q = {V Delta H_ {0} [H.G]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{ displaystyle Q = { frac {V Delta H_ {0} K_ {a} [H_ {0}] [G]} {1 + K_ {a} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{ displaystyle [H_ {0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)








