Азотный цикл - Википедия - Nitrogen cycle

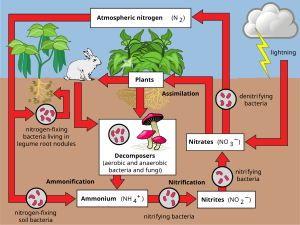
В азотный цикл это биогеохимический цикл по которому азот преобразуется во множество химических форм, поскольку циркулирует среди атмосфера, земной, и морские экосистемы. Конверсия азота может осуществляться как биологическими, так и физическими способами. Важные процессы в круговороте азота включают: фиксация, аммонификация, нитрификация, и денитрификация. Большая часть чего-либо Атмосфера Земли (78%) - атмосфера азот,[16] что делает его крупнейшим источником азота. Однако атмосферный азот имеет ограниченную доступность для биологического использования, что приводит к дефицит пригодного для использования азота во многих типах экосистемы.
Азотный цикл представляет особый интерес для экологи поскольку доступность азота может повлиять на скорость основных экосистемных процессов, в том числе основное производство и разложение. Деятельность человека, такая как сжигание ископаемого топлива, использование искусственных азотных удобрений и выброс азота в сточные воды, резко возросла. изменил глобальный цикл азота.[17][18][19] Модификация человеком глобального азотного цикла может отрицательно сказаться на системе окружающей среды, а также на здоровье человека.[20][21]


Процессы
Азот присутствует в окружающей среде в самых разных химических формах, включая органический азот, аммоний (NH+
4), нитрит (НЕТ−
2), нитрат (НЕТ−
3), оксид азота (N2O), оксид азота (NO) или неорганический азот (N2). Органический азот может быть в форме живого организма, перегной или в промежуточных продуктах разложения органических веществ. Процессы в круговороте азота заключаются в преобразовании азота из одной формы в другую. Многие из этих процессов выполняются микробы либо в их стремлении собрать энергию, либо накапливать азот в форме, необходимой для их роста. Например, азотные отходы в животном моча разбиты на нитрифицирующие бактерии в почве для использования растениями. На диаграмме показано, как эти процессы сочетаются друг с другом и образуют азотный цикл.
Фиксация азота
Конверсия газообразного азота (N2) в нитраты и нитриты в результате атмосферных, промышленных и биологических процессов называется азотфиксацией. Атмосферный азот должен быть обработан, или "фиксированный ", в пригодную для использования растениями форму. От 5 до 10 миллиардов кг в год устанавливаются молния ударов, но в большинстве случаев фиксация осуществляется вольными или симбиотический бактерии известный как диазотрофы. Эти бактерии имеют нитрогеназа фермент который сочетает газообразный азот с водород производить аммиак, который бактерии превращают в другие органические соединения. В большинстве случаев биологическая фиксация азота происходит за счет активности Mo-нитрогеназы, обнаруженной у самых разных бактерий и некоторых Археи. Мо-нитрогеназа - сложный двухкомпонентный фермент который имеет несколько металлсодержащих простетических групп.[22] Примером свободноживущих бактерий является Азотобактер. Симбиотические азотфиксирующие бактерии, такие как Ризобий обычно живут в корневых узелках бобовые (например, горох, люцерна и деревья акации). Здесь они образуют мутуалистический отношения с заводом, производящим аммиак в обмен на углеводы. Из-за этой связи бобовые часто повышают содержание азота в бедных азотом почвах. Некоторые небобовые культуры также могут образовывать такие симбиозы. Сегодня около 30% всего фиксированного азота производится промышленным способом с использованием Haber-Bosch процесс,[23] который использует высокие температуры и давления для преобразования газообразного азота и источника водорода (природного газа или нефти) в аммиак.[24]
Ассимиляция
Растения могут поглощать нитраты или аммоний из почвы своими корневыми волосками. Если нитрат абсорбируется, он сначала восстанавливается до нитрит-ионов, а затем до ионов аммония для включения в аминокислоты, нуклеиновые кислоты и хлорофилл. У растений, которые находятся в симбиотических отношениях с ризобиями, некоторое количество азота ассимилируется в форме ионов аммония непосредственно из клубеньков. Теперь известно, что существует более сложный круговорот аминокислот между Ризобия бактероиды и растения. Растение обеспечивает бактероидами аминокислоты, поэтому ассимиляция аммиака не требуется, и бактероиды передают аминокислоты (с вновь зафиксированным азотом) обратно в растение, таким образом формируя взаимозависимые отношения.[25] В то время как многие животные, грибы и другие гетеротрофный организмы получают азот при приеме внутрь аминокислоты, нуклеотиды, и другие небольшие органические молекулы, другие гетеротрофы (в том числе многие бактерии ) могут использовать неорганические соединения, такие как аммоний, в качестве единственных источников азота. Использование различных источников азота тщательно регулируется всеми организмами.
Аммонификация
Когда растение или животное умирает или животное выбрасывает отходы, исходной формой азота является органический. Бактерии или грибы превращают органический азот в останках обратно в аммоний (NH+
4), процесс, называемый аммонификацией или минерализация. Участвующие ферменты:
- GS: Gln-синтетаза (цитозольная и пластическая)
- GOGAT: Glu 2-оксоглутарат аминотрансфераза (Ферредоксин & НАДН-зависимый)
- GDH: Glu дегидрогеназа:
- Незначительная роль в усвоении аммония.
- Важен в катаболизме аминокислот.
Нитрификация
Превращение аммония в нитрат осуществляется в основном почвенными бактериями и другими нитрифицирующими бактериями. На первичной стадии нитрификации окисление аммония (NH+
4) осуществляется бактериями, такими как Нитросомонады виды, которые превращают аммиак в нитриты (НЕТ−
2 ). Другие виды бактерий, такие как Нитробактер, ответственны за окисление нитритов (НЕТ−
2 ) в нитраты (НЕТ−
3 ). Это важно для аммиака (NH
3) для преобразования в нитраты или нитриты, поскольку газообразный аммиак токсичен для растений.
Из-за их очень высокого растворимость и потому что почвы очень неспособны удерживать анионы, нитраты могут попадать грунтовые воды. Повышенный уровень нитратов в грунтовых водах вызывает беспокойство при использовании питьевой воды, потому что нитраты могут влиять на уровень кислорода в крови у младенцев и вызывать метгемоглобинемия или синдром голубого ребенка.[28] Там, где грунтовые воды пополняют сток ручья, обогащенные нитратами грунтовые воды могут способствовать эвтрофикация, процесс, который приводит к высокой популяции и росту водорослей, особенно популяций сине-зеленых водорослей. Хотя нитрат не является прямым токсичным для рыб, как аммиак, он может оказывать косвенное воздействие на рыбу, если способствует эвтрофикации. Азот вызывает серьезные проблемы эвтрофикации в некоторых водоемах. С 2006 года применение азота удобрение все больше контролируется в Великобритании и США. Это происходит по той же схеме, что и контроль фосфорных удобрений, ограничение которых обычно считается необходимым для восстановления заболоченных водоемов.
Денитрификация
Денитрификация - это восстановление нитратов до газообразного азота (N2), завершая азотный цикл. Этот процесс выполняется такими видами бактерий, как Псевдомонады и Паракокк, в анаэробных условиях. Они используют нитрат в качестве акцептора электронов вместо кислорода во время дыхания. Эти факультативно (то есть необязательно) анаэробные бактерии также могут жить в аэробных условиях. Денитрификация происходит в анаэробных условиях, например. переувлажненные почвы. Денитрифицирующие бактерии используют нитраты в почве для дыхания и, следовательно, производят газообразный азот, который инертен и недоступен для растений.
Диссимиляционное восстановление нитрата до аммония
Диссимиляционное восстановление нитратов до аммония (DNRA) или аммификация нитратов / нитритов - это анаэробное дыхание процесс. Микробы, участвующие в DNRA, окисляют органическое вещество и используют нитрат в качестве акцептора электронов, восстанавливая его донитрит, тогдааммоний (НЕТ3−→ НЕТ2−→ NH4+).[29] И денитрифицирующие, и нитратные аммонифицирующие бактерии будут конкурировать за нитраты в окружающей среде, хотя DNRA сохраняет биодоступный азот в виде растворимого аммония, а не производит газообразный азот.[30]
Анаэробное окисление аммиака
В этом биологическом процессе нитрит и аммиак превращаются непосредственно в молекулярные азот (N2) газ. Этот процесс составляет основную долю превращения азота в океанах. Сбалансированная формула для этого »анаммокс "химическая реакция: NH+
4 + НЕТ−
2 → N2 + 2H2O (Δграмм° = −357 кДж⋅моль−1).[31]
Другие процессы
Хотя азотфиксация является основным источником доступного для растений азота в большинстве экосистемы, в районах с богатым азотом коренная порода, разрушение этой породы также служит источником азота.[32][33][34] Снижение содержания нитратов также является частью железный цикл, в бескислородных условиях Fe (II) может отдавать электрон NO3− и окисляется до Fe (III), а NO3− сводится к НЕТ2−, N2НА2, а NH4+ в зависимости от условий и видов микробов.[35]
Морской азотный цикл

Круговорот азота также является важным процессом в океане. Хотя общий цикл похож, есть разные игроки[36] и способы переноса азота в океане. Азот попадает в воду через осадки, сток или в виде азота.2 из атмосферы. Азот не может использоваться фитопланктон как N2 поэтому он должен подвергаться азотфиксации, которая осуществляется преимущественно цианобактерии.[37] Без поступления фиксированного азота в морской цикл фиксированный азот будет израсходован примерно за 2000 лет.[38] Фитопланктону необходим азот в биологически доступных формах для первоначального синтеза органического вещества. Аммиак и мочевина попадают в воду в результате выделения из планктона. Источники азота удалены из эвфотическая зона движением вниз органического вещества. Это может происходить в результате опускания фитопланктона, вертикального перемешивания или опускания отходов вертикальных мигрантов. В результате опускания аммиак попадает на более низкие глубины ниже эвфотической зоны. Бактерии способны превращать аммиак в нитриты и нитраты, но они подавляются светом, поэтому это должно происходить ниже эвфотической зоны.[39] Аммонификация или Минерализация осуществляется бактериями для преобразования органического азота в аммиак. Нитрификация затем может произойти преобразование аммония в нитрит и нитрат.[40] Нитрат может быть возвращен в эвфотическую зону путем вертикального перемешивания и апвеллинга, где он может быть поглощен фитопланктоном для продолжения цикла. N2 можно вернуть в атмосферу через денитрификация.
Аммоний считается предпочтительным источником фиксированного азота для фитопланктона, поскольку его усвоение не требует редокс реакция и поэтому требует мало энергии. Для ассимиляции нитратов требуется окислительно-восстановительная реакция, но их больше, поэтому большинство фитопланктона адаптировались к ферментам, необходимым для этого сокращения (нитратредуктаза ). Есть несколько заметных и хорошо известных исключений, среди которых большинство Прохлорококк и немного Синехококк которые могут воспринимать только азот как аммоний.[38]
Питательные вещества в океане распределены неравномерно. Области апвеллинга обеспечивают поступление азота снизу эвфотической зоны. Прибрежные зоны обеспечивают азотом сток, и вдоль побережья легко происходит апвеллинг. Однако скорость поглощения азота фитопланктоном снижается в олиготрофный вода круглый год и умеренная вода летом, что приводит к снижению первичной продукции.[41] Распределение различных форм азота также варьируется в океанах.
Нитраты обеднены в приповерхностных водах, за исключением районов апвеллинга. Прибрежные районы апвеллинга обычно отличаются высоким содержанием нитратов и хлорофилл уровни в результате увеличения производства. Однако есть области с высоким содержанием нитратов на поверхности, но с низким содержанием хлорофилла, которые называются HNLC (высокий азот, низкий хлорофилл) регионы. Лучшее объяснение для регионов HNLC связано с дефицитом железа в океане, который может играть важную роль в динамике океана и круговоротах питательных веществ. Поступление железа варьируется в зависимости от региона и доставляется в океан с пылью (от пыльных бурь) и выщелачивается из горных пород. Железо рассматривается как истинный элемент, ограничивающий продуктивность экосистемы океана.
Аммоний и нитрит показывают максимальную концентрацию на высоте 50–80 м (нижний конец эвфотической зоны) с уменьшающейся концентрацией ниже этой глубины. Это распределение можно объяснить тем фактом, что нитрит и аммоний являются промежуточными частицами. Они оба быстро производятся и потребляются через толщу воды.[38] Количество аммония в океане примерно на 3 порядка меньше, чем нитрата.[38] Среди аммония, нитрита и нитрата нитрит имеет самую высокую скорость оборота. Может образовываться при ассимиляции нитратов, нитрификации и денитрификации; однако он сразу же снова потребляется.
Новый и регенерированный азот
Азот, поступающий в эвфотическую зону, называется новым азотом, потому что он вновь поступает из-за пределов продуктивного слоя.[37] Новый азот может поступать из-под эвфотической зоны или из внешних источников. Внешние источники поднимаются из-за глубокой воды и азотфиксации. Если органическое вещество съедается, вдыхается, доставляется в воду в виде аммиака и повторно включается в органическое вещество фитопланктоном, это считается переработанным / регенерированным продуктом.
Новое производство - важная составляющая морской среды. Одна из причин заключается в том, что только постоянное поступление нового азота может определить общую способность океана производить устойчивый улов рыбы.[41] Вылов рыбы из районов с регенерированным азотом приведет к снижению азота и, следовательно, к снижению первичной продукции. Это отрицательно скажется на системе. Однако, если рыбу вылавливают с участков с новым азотом, азот будет восполнен.
Влияние человека на круговорот азота


В результате интенсивного выращивания зернобобовых культур (особенно соя, люцерна, и клевер ), растущее использование Процесс Габера – Боша В результате создания химических удобрений и загрязнения, выбрасываемого транспортными средствами и промышленными предприятиями, люди более чем вдвое увеличили ежегодный перевод азота в биологически доступные формы.[28] Кроме того, люди внесли значительный вклад в перенос микрогазов азота с Земли в атмосферу и с суши в водные системы. Изменения человеком глобального азотного цикла наиболее интенсивны в развитых странах и в Азии, где выбросы транспортных средств и промышленное сельское хозяйство самые высокие.[42]
Генерация Nr, реактивный азот, выросла более чем в 10 раз за последнее столетие из-за глобального индустриализация.[2][43] Эта форма азота следует каскадом через биосфера с помощью различных механизмов и накапливается, поскольку скорость его генерации превышает скорость денитрификация.[44]
Оксид азота (N2O) поднялся в атмосфере в результате сельскохозяйственных удобрений, сжигания биомассы, крупного рогатого скота и откормочных площадок, а также промышленных источников.[45] N2O оказывает вредное воздействие на стратосфера, где он разрушается и действует как катализатор в разрушении атмосферного озон. Закись азота также парниковый газ и в настоящее время является третьим по величине спонсором глобальное потепление, после углекислый газ и метан. Хотя он не так богат в атмосфере, как углекислый газ, при эквивалентной массе он почти в 300 раз сильнее по своей способности согревать планету.[46]
Аммиак (NH3) в атмосфере утроилось в результате деятельности человека. Это реагент в атмосфере, где он действует как аэрозоль, ухудшая качество воздуха и цепляясь за капли воды, что в конечном итоге приводит к азотная кислота (ЧАСНЕТ3 ) который производит кислотный дождь. Атмосферный аммиак и азотная кислота также повреждают органы дыхания.
Очень высокая температура молнии, естественно, производит небольшое количество NO.Икс, NH3, и HNO3, но высокотемпературный горение способствовал увеличению потока NO в 6-7 раз.Икс в атмосферу. Его производство зависит от температуры сгорания - чем выше температура, тем больше NO.Икс производится. Ископаемое топливо основной вклад вносит горение, биотопливо и даже сжигание водорода. Однако скорость, с которой водород непосредственно впрыскивается в камеры сгорания двигателей внутреннего сгорания, можно контролировать, чтобы предотвратить более высокие температуры сгорания, которые производят NO.Икс.
Аммиак и оксиды азота активно изменяют химия атмосферы. Они предшественники тропосферный (нижняя часть атмосферы) производство озона, которое способствует смог и кислотный дождь, убытки растения и увеличивает поступление азота в экосистемы. Экосистема процессы могут увеличиваться с азотные удобрения, но антропогенный вводимые ресурсы также могут привести к насыщению азотом, что снижает продуктивность и может нанести вред здоровью растений, животных, рыб и людей.[28]
Снижается биоразнообразие может также произойти, если более высокая доступность азота увеличивает потребность в азоте трав, вызывая деградацию бедных азотом и разнообразных видов пустоши.[47]
Последствия модификации азотного цикла у человека
Воздействие на природные системы
Повышение уровня осаждение азота показано, что они оказывают ряд негативных воздействий как на наземные, так и на водные экосистемы.[48][49] Азотные газы и аэрозоли могут быть непосредственно токсичными для некоторых видов растений, влияя на физиологию надземной части и рост растений вблизи крупных точечные источники загрязнения азотом. Изменения в видах растений также могут происходить, поскольку накопление соединений азота увеличивает их доступность в данной экосистеме, в конечном итоге изменяя видовой состав, разнообразие растений и круговорот азота. Аммиак и аммоний - две восстановленные формы азота - со временем могут нанести вред из-за повышенной токсичности для чувствительных видов растений,[50] особенно те, которые привыкли использовать нитраты в качестве источника азота, вызывая плохое развитие их корней и побегов. Повышенное осаждение азота также приводит к подкислению почвы, что увеличивает выщелачивание основных катионов в почве и количество алюминий и других потенциально токсичных металлов, наряду с уменьшением количества нитрификация возникновение и увеличение подстилки растительного происхождения. Из-за продолжающихся изменений, вызванных высоким уровнем осаждения азота, восприимчивость окружающей среды к экологическому стрессу и нарушениям, таким как вредители и патогены - может увеличиваться, что делает его менее устойчивым к ситуациям, которые в противном случае мало повлияли бы на его долгосрочную жизнеспособность.
Дополнительные риски, связанные с повышением доступности неорганического азота в водных экосистемах, включают подкисление воды; эвтрофикация систем пресной и морской воды; и вопросы токсичности для животных, включая человека.[51] Эвтрофикация часто приводит к снижению уровня растворенного кислорода в водной толще, включая гипоксические и бескислородные условия, которые могут вызвать гибель водной фауны. Относительно сидячий бентос, или живущие на дне существа, особенно уязвимы из-за своей малоподвижности, хотя массовая гибель рыбы не редкость. Океанический мертвые зоны возле устья Миссисипи в Мексиканский залив являются хорошо известным примером цветение водорослей -индуцированный гипоксия.[52][53] Нью-Йоркские озера Адирондак, Кэтскиллс, Гудзонское нагорье, плато Ренсселер и некоторые части Лонг-Айленда демонстрируют влияние выпадения азотно-кислотных дождей, в результате чего погибает рыба и многие другие водные виды.[54]
Аммиак (NH3) очень токсичен для рыб, поэтому необходимо тщательно контролировать уровень аммиака, сбрасываемого из очистных сооружений. Чтобы предотвратить гибель рыб, нитрификация через аэрация перед выпиской часто желательно. Применение земли может быть привлекательной альтернативой аэрации.
Воздействие на здоровье человека: накопление нитратов в питьевой воде.
Утечка Nr (реактивный азот) в результате деятельности человека может вызвать накопление нитратов в естественной водной среде, что может оказать вредное воздействие на здоровье человека. Чрезмерное использование азотных удобрений в сельском хозяйстве было одним из основных источников загрязнения нитратами подземных и поверхностных вод.[55][56] Из-за своей высокой растворимости и низкого удерживания почвой нитраты могут легко уходить из подпочвенного слоя в грунтовые воды, вызывая загрязнение нитратами. Некоторые другие неточечные источники в качестве источника загрязнения грунтовых вод нитратами являются кормление скота, заражение животных и людей, а также бытовые и промышленные отходы. Поскольку грунтовые воды часто служат основным источником бытовой воды, загрязнение нитратами может распространяться с грунтовых вод на поверхностные и питьевые воды в процессе Питьевая вода производство, особенно для небольших коммунальных систем водоснабжения, где используются плохо регулируемые и антисанитарные воды.[57]
Стандарт ВОЗ для питьевой воды - 50 мг NO.3− L−1 при кратковременном воздействии и на 3 мг NO3− L−1хронические эффекты.[58] Попадая в организм человека, нитрат может реагировать с органическими соединениями посредством реакций нитрозирования в желудке с образованием нитрозамины и нитрозамиды, которые вызывают некоторые виды рака (например, рак ротовой полости и рак желудка ).[59]
Воздействие на здоровье человека: качество воздуха
Деятельность человека также резко изменила глобальный круговорот азота за счет производства азотистых газов, что связано с глобальным загрязнением атмосферы азотом. Есть несколько источников атмосферного реактивный азот (Nr) потоки. Сельскохозяйственные источники химически активного азота могут производить выбросы в атмосферу аммиак (NH3), оксиды азота (НЕТИкс) и оксид азота (N2О). Процессы сжигания в производстве энергии, на транспорте и в промышленности также могут привести к образованию нового реактивного азота через выбросы NO.Икс, продукт непреднамеренных отходов. Когда эти реактивные атомы азота выбрасываются в нижние слои атмосферы, они могут вызвать образование смога, твердые частицы и аэрозоли, которые в значительной степени способствуют неблагоприятному воздействию на здоровье человека загрязнения воздуха.[60] В атмосфере НЕТ2 может быть окислен до азотная кислота (HNO3), и он может далее реагировать с NH3 с образованием нитрата аммония, который способствует образованию определенного нитрата. Кроме того, NH3 может реагировать с другими кислыми газами (серный и соляная кислота ) с образованием аммонийсодержащих частиц, которые являются предшественниками вторичных органических аэрозольных частиц в фотохимический смог.[61]
Смотрите также
Рекомендации
- ^ Фаулер, Дэвид; Койл, Мхайри; Скиба, Юте; Саттон, Марк А .; Кейп, Дж. Нил; Рейс, Стефан; Шеппард, Люси Дж .; Дженкинс, Алан; Гризетти, Бруна; Galloway, JN; Vitousek, P; Выщелачивание, А; Бауман, AF; Butterbach-Bahl, K; Дентенер, F; Стивенсон, Д; Аманн, М; Восс, М. (5 июля 2013 г.). «Глобальный круговорот азота в двадцать первом веке». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 368 (1621): 20130164. Дои:10.1098 / rstb.2013.0164. ЧВК 3682748. PMID 23713126.
- ^ а б Galloway, J. N .; Townsend, A.R .; Erisman, J. W .; Бекунда, М .; Cai, Z .; Freney, J. R .; Мартинелли, Л. А .; Seitzinger, S.P .; Саттон, М.А. (2008). «Трансформация цикла азота: последние тенденции, вопросы и возможные решения» (PDF). Наука. 320 (5878): 889–892. Bibcode:2008Sci ... 320..889G. Дои:10.1126 / science.1136674. ISSN 0036-8075. PMID 18487183. S2CID 16547816. В архиве (PDF) из оригинала от 08.11.2011. Получено 2019-09-23.
- ^ Vitousek, P. M .; Menge, D. N. L .; Reed, S.C .; Кливленд, К. С. (2013). «Биологическая фиксация азота: скорости, закономерности и экологический контроль в наземных экосистемах». Философские труды Королевского общества B: биологические науки. 368 (1621): 20130119. Дои:10.1098 / rstb.2013.0119. ISSN 0962-8436. ЧВК 3682739. PMID 23713117.
- ^ а б Voss, M .; Bange, H.W .; Диппнер, Дж. В .; Мидделбург, Дж. Дж .; Montoya, J.P .; Уорд, Б. (2013). «Морской круговорот азота: недавние открытия, неопределенности и потенциальная значимость изменения климата». Философские труды Королевского общества B: биологические науки. 368 (1621): 20130121. Дои:10.1098 / rstb.2013.0121. ISSN 0962-8436. ЧВК 3682741. PMID 23713119.
- ^ а б Фаулер, Дэвид; Койл, Мхайри; Скиба, Юте; Саттон, Марк А .; Кейп, Дж. Нил; Рейс, Стефан; Шеппард, Люси Дж .; Дженкинс, Алан; Гризетти, Бруна; Galloway, JN; Vitousek, P; Выщелачивание, А; Бауман, AF; Butterbach-Bahl, K; Дентенер, F; Стивенсон, Д; Аманн, М; Восс, М. (5 июля 2013 г.). «Глобальный круговорот азота в двадцать первом веке». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 368 (1621): 20130164. Дои:10.1098 / rstb.2013.0164. ЧВК 3682748. PMID 23713126.
- ^ Вуурен, Детлеф П. ван; Бауман, Лекс Ф; Смит, Стивен Дж; Дентенер, Франк (2011). «Глобальные прогнозы антропогенных выбросов химически активного азота в атмосферу: оценка сценариев в научной литературе». Текущее мнение об экологической устойчивости. 3 (5): 359–369. Дои:10.1016 / j.cosust.2011.08.014. HDL:1874/314192. ISSN 1877-3435.
- ^ Пилегаард, К. (2013). «Процессы регулирования выбросов оксида азота из почв». Философские труды Королевского общества B: биологические науки. 368 (1621): 20130126. Дои:10.1098 / rstb.2013.0126. ISSN 0962-8436. ЧВК 3682746. PMID 23713124.
- ^ Levy, H .; Moxim, W. J .; Касибхатла, П. С. (1996). «Глобальный трехмерный зависящий от времени источник молнии тропосферных NOx». Журнал геофизических исследований: атмосферы. 101 (D17): 22911–22922. Bibcode:1996JGR ... 10122911L. Дои:10.1029 / 96jd02341. ISSN 0148-0227.
- ^ Саттон, М. А .; Reis, S .; Riddick, S.N .; Драгосиц, У .; Nemitz, E .; Theobald, M. R .; Tang, Y. S .; Braban, C.F .; Виено, М. (2013). «На пути к парадигме выбросов и осаждения аммиака, зависящей от климата». Философские труды Королевского общества B: биологические науки. 368 (1621): 20130166. Дои:10.1098 / rstb.2013.0166. ISSN 0962-8436. ЧВК 3682750. PMID 23713128.
- ^ Дентенер, Ф .; Drevet, J .; Lamarque, J. F .; Бей, I .; Eickhout, B .; Fiore, A.M .; Hauglustaine, D .; Horowitz, L.W .; Крол, М. (2006). «Осаждение азота и серы в региональном и глобальном масштабе: многомодельная оценка». Глобальные биогеохимические циклы. 20 (4): н / д. Bibcode:2006GBioC..20.4003D. Дои:10.1029 / 2005GB002672.
- ^ а б c Duce, R.A .; LaRoche, J .; Altieri, K .; Арриго, К. Р .; Baker, A.R .; Capone, D.G .; Cornell, S .; Дентенер, Ф .; Галлоуэй, Дж. (2008). «Воздействие атмосферного антропогенного азота на открытый океан». Наука. 320 (5878): 893–897. Bibcode:2008Sci ... 320..893D. Дои:10.1126 / наука.1150369. ISSN 0036-8075. PMID 18487184. S2CID 11204131.
- ^ Bouwman, L .; Goldewijk, K. K .; Ван дер Хук, К. В .; Beusen, A.H.W .; Ван Вуурен, Д. П .; Willems, J .; Rufino, M.C .; Стефест, Э. (16 мая 2011 г.). «Изучение глобальных изменений в круговоротах азота и фосфора в сельском хозяйстве, вызванных животноводством в период 1900-2050 годов». Труды Национальной академии наук. 110 (52): 20882–20887. Дои:10.1073 / pnas.1012878108. ISSN 0027-8424. ЧВК 3876211. PMID 21576477.
- ^ Соломон, Сьюзен (2007). Изменение климата 2007: основы физических наук. Опубликовано для Межправительственной группы экспертов по изменению климата [издано] Cambridge University Press. ISBN 9780521880091. OCLC 228429704.
- ^ Саттон, Марк А., редактор (14.04.2011). Европейская оценка азота: источники, эффекты и перспективы политики. ISBN 9781107006126. OCLC 690090202.CS1 maint: несколько имен: список авторов (связь)
- ^ Дойч, Кертис; Сармьенто, Хорхе Л .; Сигман, Дэниел М .; Грубер, Николас; Данн, Джон П. (2007). «Пространственная взаимосвязь поступления азота и потерь в океане». Природа. 445 (7124): 163–167. Bibcode:2007Натура.445..163D. Дои:10.1038 / природа05392. ISSN 0028-0836. PMID 17215838. S2CID 10804715.
- ^ Стивен Б. Кэрролл; Стивен Д. Солт (2004). Экология для садоводов. Timber Press. п. 93. ISBN 978-0-88192-611-8. В архиве из оригинала на 2018-02-01. Получено 2016-10-23.
- ^ Кайперс, МММ; Маршан, Гонконг; Картал, Б (2011). "Сеть микробного цикла азота". Обзоры природы Микробиология. 1 (1): 1–14. Дои:10.1038 / nrmicro.2018.9. PMID 29398704. S2CID 3948918.
- ^ Galloway, J. N .; и другие. (2004). «Азотные циклы: прошлые, настоящие и будущие поколения». Биогеохимия. 70 (2): 153–226. Дои:10.1007 / s10533-004-0370-0. S2CID 98109580.
- ^ Рейс, Стефан; Бекунда, Матите; Ховард, Клэр М; Каранджа, Нэнси; Винивартер, Вильфрид; Ян, Сяоюань; Бликер, Альберт; Саттон, Марк А (01.12.2016). «Обобщение и обзор: решение проблемы управления азотом: от глобального к локальному масштабу». Письма об экологических исследованиях. 11 (12): 120205. Bibcode:2016ERL .... 11l0205R. Дои:10.1088/1748-9326/11/12/120205. ISSN 1748-9326.
- ^ Гу, Баоцзин; Ге, Инь; Рен, юань; Сюй, Бен; Ло, Вэйдун; Цзян, Хун; Гу, Биньхэ; Чанг, Джи (17 августа 2012 г.). «Атмосферный реактивный азот в Китае: источники, последние тенденции и стоимость ущерба». Экологические науки и технологии. 46 (17): 9420–9427. Bibcode:2012EnST ... 46.9420G. Дои:10.1021 / es301446g. ISSN 0013-936X. PMID 22852755.
- ^ Ким, Харьюн; Ли, Китак; Лим, Донг-Ил; Нам, Сын-Иль; Ким, Тэ Ук; Ян, Цзинь-Ю Т .; Ко, Ён Хо; Шин, Кён-Хун; Ли, Юнил (2017-05-11). «Широкое распространение антропогенного азота в отложениях северо-западной части Тихого океана». Экологические науки и технологии. 51 (11): 6044–6052. Bibcode:2017EnST ... 51.6044K. Дои:10.1021 / acs.est.6b05316. ISSN 0013-936X. PMID 28462990.
- ^ Мойр, JWB (редактор) (2011). Круговорот азота в бактериях: молекулярный анализ. Caister Academic Press. ISBN 978-1-904455-86-8.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Смит Б., Р. Л. Ричардс и В. Э. Ньютон. 2004. Катализаторы азотфиксации: нитрогеназы, соответствующие химические модели и коммерческие процессы. Kluwer Academic Publishers, Дордрехт; Бостон.
- ^ Смил, В (2000). Циклы жизни. Научная американская библиотека, Нью-Йорк.
- ^ Уилли, Джоан М. (2011). Микробиология Прескотта, 8-е изд.. Нью-Йорк, Нью-Йорк: Макгроу Хилл. п. 705. ISBN 978-0-07-337526-7.
- ^ Спарацино-Уоткинс, Кортни; Штольц, Джон Ф .; Басу, Партха (2013-12-16). «Нитрат и периплазматические нитратредуктазы». Chem. Soc. Rev. 43 (2): 676–706. Дои:10.1039 / c3cs60249d. ISSN 1460-4744. ЧВК 4080430. PMID 24141308.
- ^ Саймон, Йорг; Клотц, Мартин Г. (2013). «Разнообразие и эволюция биоэнергетических систем, участвующих в трансформации микробных соединений азота». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1827 (2): 114–135. Дои:10.1016 / j.bbabio.2012.07.005. PMID 22842521.
- ^ а б c Витоусек, П.М. Абер, Дж; Ховарт, RW; Likens, GE; Matson, PA; Шиндлер, DW; Шлезингер, WH; Тильман, GD (1997). «Антропогенное изменение глобального круговорота азота: источники и последствия» (PDF). Экологические приложения. 1 (3): 1–17. Дои:10.1890 / 1051-0761 (1997) 007 [0737: HAOTGN] 2.0.CO; 2. HDL:1813/60830. ISSN 1051-0761.
- ^ Лам, Филлис и Кайперс, Марсель М. М. (2011). «Микробные азотные процессы в зонах минимального содержания кислорода». Ежегодный обзор морской науки. 3: 317–345. Bibcode:2011 ОРУЖИЕ .... 3..317Л. Дои:10.1146 / annurev-marine-120709-142814. PMID 21329208.CS1 maint: несколько имен: список авторов (связь)
- ^ Марчант, Х. К., Лавик, Г., Холтаппельс, М., и Кайперс, М. М. М. (2014). «Судьба нитратов в проницаемых приливных отложениях». PLOS ONE. 9 (8): e104517. Bibcode:2014PLoSO ... 9j4517M. Дои:10.1371 / journal.pone.0104517. ЧВК 4134218. PMID 25127459.CS1 maint: несколько имен: список авторов (связь)
- ^ «Анаммокс». Анамокс - MicrobeWiki. MicrobeWiki. В архиве из оригинала 27.09.2015. Получено 5 июля 2015.
- ^ «Исследование азота может« потрясти »мир растений». 2011-09-06. В архиве из оригинала от 05.12.2011. Получено 2011-10-22.
- ^ Шур, Э.А.Г. (2011). «Экология: азот из глубины». Природа. 477 (7362): 39–40. Bibcode:2011Натура 477 ... 39S. Дои:10.1038 / 477039a. PMID 21886152. S2CID 2946571.
- ^ Morford, S.L .; Houlton, B.Z .; Дальгрен, Р. А. (2011). «Увеличение запасов углерода и азота в лесных экосистемах из богатых азотом коренных пород». Природа. 477 (7362): 78–81. Bibcode:2011Натура 477 ... 78 млн. Дои:10.1038 / природа10415. PMID 21886160. S2CID 4352571.
- ^ Бургин, Эми Дж .; Ян, Венди Х .; Гамильтон, Стивен К .; Сильвер, Whendee L. (2011). «Помимо углерода и азота: как микробная энергетическая экономика объединяет элементные циклы в различных экосистемах». Границы экологии и окружающей среды. 9 (1): 44–52. Дои:10.1890/090227. HDL:1808/21008. ISSN 1540-9309.
- ^ Moulton, Orissa M; Altabet, Mark A; Беман, Дж. Майкл; Диган, Линда А; Льорет, Хавьер; Lyons, Meaghan K; Нельсон, Джеймс А; Пфистер, Кэтрин А (май 2016 г.). «Микробные ассоциации с макробиотой в прибрежных экосистемах: закономерности и последствия для круговорота азота». Границы экологии и окружающей среды. 14 (4): 200–208. Дои:10.1002 / плата.1262. HDL:1912/8083. ISSN 1540-9295.
- ^ а б Миллер, Чарльз (2008). Биологическая океанография. 350 Main Street, Malden, MA 02148 США: Blackwell Publishing Ltd., стр. 60–62. ISBN 978-0-632-05536-4.CS1 maint: location (связь)
- ^ а б c d Грубер, Николас (2008). Азот в морской среде. Корпоративный Драйв 30, Люкс 400, Берлингтон, Массачусетс 01803: Эльзевир. С. 1–35. ISBN 978-0-12-372522-6.CS1 maint: location (связь)
- ^ Миллер, Чарльз (2008). Биологическая океанография. 350 Main Street, Malden, MA 02148 США: Blackwell Publishing Ltd., стр. 60–62. ISBN 978-0-632-05536-4.CS1 maint: location (связь)
- ^ Бойс, Эллиот, Сьюзен, Майкл. «Учебный модуль: морская среда с азотным циклом». Архивировано из оригинал 15 апреля 2012 г.. Получено 22 октября 2011.
- ^ а б Лалли, Парсонс, Кэрол, Тимоти (1997). Биологическая океанография: введение. Баттерворт-Хайнеманн. ISBN 978-0-7506-3384-0.
- ^ Голландия, Элизабет А .; Дентенер, Франк Дж .; Braswell, Bobby H .; Сульцман, Джеймс М. (1999). «Современные и доиндустриальные глобальные бюджеты химически активного азота». Биогеохимия. 46 (1–3): 7. Дои:10.1007 / BF01007572. S2CID 189917368.
- ^ Гу, Баоцзин; Ге, Инь; Рен, юань; Сюй, Бен; Ло, Вэйдун; Цзян, Хун; Гу, Биньхэ; Чанг, Джи (04.09.2012). «Атмосферный реактивный азот в Китае: источники, последние тенденции и стоимость ущерба». Экологические науки и технологии. 46 (17): 9420–9427. Bibcode:2012EnST ... 46.9420G. Дои:10.1021 / es301446g. ISSN 0013-936X. PMID 22852755.
- ^ Косби, Б. Джек; Каулинг, Эллис Б.; Ховарт, Роберт В .; Seitzinger, Sybil P .; Эрисман, Ян Виллем; Абер, Джон Д .; Галлоуэй, Джеймс Н. (2003-04-01). «Азотный каскад». Бионаука. 53 (4): 341–356. Дои:10.1641 / 0006-3568 (2003) 053 [0341: TNC] 2.0.CO; 2. ISSN 0006-3568.
- ^ Чапин, С. Ф. III, Мэтсон, П. А., Муни Х. А. 2002. Принципы экологии наземных экосистем. В архиве 2014-06-28 в Wayback Machine Спрингер, Нью-Йорк, 2002 г. ISBN 0-387-95443-0, стр.345
- ^ Труды Научного комитета по проблемам окружающей среды (SCOPE) Быстрая оценка Международного проекта по биотопливу, 22–25 сентября 2008 г., Гуммерсбах, Германия, редакторы Р. В. Ховарт и С. Бринджезу. 2009 г. Краткое содержание, стр. 3 В архиве 2009-06-06 на Wayback Machine
- ^ Aerts, Риен и Берендсе, Франк (1988). «Влияние увеличения доступности питательных веществ на динамику растительности во влажных пустошах». Vegetatio. 76 (1/2): 63–69. JSTOR 20038308.
- ^ Bobbink, R .; Hicks, K .; Galloway, J .; Spranger, T .; Alkemade, R .; Ashmore, M .; Bustamante, M .; Cinderby, S .; Дэвидсон, Э. (01.01.2010). «Глобальная оценка воздействия осаждения азота на разнообразие наземных растений: синтез» (PDF). Экологические приложения. 20 (1): 30–59. Дои:10.1890/08-1140.1. ISSN 1939-5582. PMID 20349829. В архиве (PDF) из оригинала на 2019-09-30. Получено 2019-09-30.
- ^ Лю, Сюэцзюнь; Дуань, Лэй; Мо, Цзянмин; Ду, Энзай; Шен, Цзяньлинь; Лу, Сянькай; Чжан, Инь; Чжоу, Сяобин; Он, Чуне (2011). «Отложение азота и его экологическое воздействие в Китае: обзор». Загрязнение окружающей среды. 159 (10): 2251–2264. Дои:10.1016 / j.envpol.2010.08.002. PMID 20828899.
- ^ Britto, Dev T .; Кронзукер, Герберт Дж. (2002). «Токсичность NH4 + для высших растений: критический обзор». Журнал физиологии растений. 159 (6): 567–584. Дои:10.1078/0176-1617-0774.
- ^ Камаргоа, Хулио А .; Алонсо, Альваро (2006). «Экологические и токсикологические последствия загрязнения неорганическим азотом в водных экосистемах: глобальная оценка». Environment International. 32 (6): 831–849. Дои:10.1016 / j.envint.2006.05.002. PMID 16781774.
- ^ Рабале, Нэнси Н., Р. Юджин Тернер и Уильям Дж. Уайзман-младший (2002). "Гипоксия Мексиканского залива", также известная как "Мертвая зона""". Анну. Rev. Ecol. Syst. 33: 235–63. Дои:10.1146 / annurev.ecolsys.33.010802.150513. JSTOR 3069262.CS1 maint: несколько имен: список авторов (связь)
- ^ Дибас, Шерил Лин. (2005). «Мертвые зоны, распространяющиеся в Мировом океане». Бионаука. 55 (7): 552–557. Дои:10.1641 / 0006-3568 (2005) 055 [0552: DZSIWO] 2.0.CO; 2.
- ^ Охрана окружающей среды штата Нью-Йорк, Воздействие кислотных отложений на окружающую среду: Озера [1] В архиве 2010-11-24 на Wayback Machine
- ^ Power, J.F .; Schepers, J.S. (1989). «Загрязнение нитратами подземных вод в Северной Америке». Сельское хозяйство, экосистемы и окружающая среда. 26 (3–4): 165–187. Дои:10.1016/0167-8809(89)90012-1. ISSN 0167-8809.
- ^ Strebel, O .; Duynisveld, W.H.M .; Бёттчер, Дж. (1989). «Загрязнение грунтовых вод нитратами в Западной Европе». Сельское хозяйство, экосистемы и окружающая среда. 26 (3–4): 189–214. Дои:10.1016/0167-8809(89)90013-3. ISSN 0167-8809.
- ^ Фьютрелл, Лорна (2004). «Нитраты питьевой воды, метгемоглобинемия и глобальное бремя болезней: обсуждение». Перспективы гигиены окружающей среды. 112 (14): 1371–1374. Дои:10.1289 / ehp.7216. ISSN 0091-6765. ЧВК 1247562. PMID 15471727.
- ^ Глобальная обсерватория здравоохранения: (GHO). Всемирная организация здоровья. OCLC 50144984.
- ^ Кантер, Ларри В. (2019-01-22), «Иллюстрации загрязнения подземных вод нитратами», Нитраты в подземных водах, Routledge, стр. 39–71, Дои:10.1201/9780203745793-3, ISBN 9780203745793
- ^ Кампа, Марилена; Кастанас, Элиас (2008). «Влияние загрязнения воздуха на здоровье человека». Загрязнение окружающей среды. 151 (2): 362–367. Дои:10.1016 / j.envpol.2007.06.012. ISSN 0269-7491. PMID 17646040.
- ^ Erisman, J. W .; Galloway, J. N .; Зейтцингер, S .; Bleeker, A .; Dise, N. B .; Петреску, А. М. Р .; Leach, A.M .; де Фрис, В. (27 мая 2013 г.). «Последствия модификации глобального азотного цикла человеком». Философские труды Королевского общества B: биологические науки. 368 (1621): 20130116. Дои:10.1098 / rstb.2013.0116. ISSN 0962-8436. ЧВК 3682738. PMID 23713116.

