Нитрификация - Nitrification
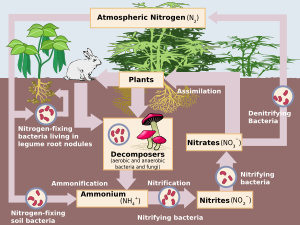
Нитрификация биологический окисление из аммиак к нитрит с последующим окислением нитрит к нитрат.[1] Превращение аммиака в нитрит обычно является этапом нитрификации, ограничивающим скорость. Нитрификация - важный шаг в азотный цикл в почва. Нитрификация - это аэробный процесс выполняется небольшими группами автотрофный бактерии и археи. Этот процесс открыл российский микробиолог Сергей Виноградский.
Микробиология и экология
Окисление аммиака в нитрит осуществляется двумя группами организмов: аммиакокисляющие бактерии (AOB) и окисляющие аммиак археи (АОА[2]).[3] AOB можно найти среди β-протеобактерии и гаммапротеобактерии.[4] В настоящее время два АОА, Nitrosopumilus maritimus и Nitrososphaera viennensis, были выделены и описаны.[5] В почвах наиболее изученные АОБ относятся к родам Нитросомонады и Нитрозококк. Хотя в почвах окисление аммиака происходит за счет АОБ и АОА, АОА преобладает как в почвах, так и в морской среде,[2][6][7] предполагая, что Таумархеота могут вносить больший вклад в окисление аммиака в этих средах.[2]
Второй этап (окисление нитрита в нитрат) выполняется (в основном) бактериями рода Нитробактер и Нитроспира. Обе стадии производят энергию, которая связана с синтезом АТФ. Нитрифицирующие организмы хемоавтотрофы, и используйте углекислый газ как их углерод источник роста. Некоторые АОБ обладают ферментом, уреаза, который катализирует превращение молекулы мочевины в две молекулы аммиака и одну молекулу диоксида углерода. Nitrosomonas europaea, а также популяции обитающих в почве АОБ, как было показано, ассимилируют углекислый газ, выделяющийся в результате реакции, чтобы произвести биомасса через Цикл Кальвина и собирают энергию, окисляя аммиак (другой продукт уреазы) до нитрита. Эта особенность может объяснять усиленный рост АОБ в присутствии мочевины в кислой среде.[8]
В большинстве сред присутствуют организмы, которые завершают оба этапа процесса, давая нитрат в качестве конечного продукта. Однако можно спроектировать системы, в которых образуется нитрит ( Шарон процесс ).
Нитрификация важна в сельскохозяйственных системах, где удобрения часто вносятся в виде аммиака. Превращение аммиака в нитрат увеличивает выщелачивание азота, поскольку нитрат более растворим в воде, чем аммиак.
Нитрификация также играет важную роль в удалении азот из муниципальных Сточные Воды. Обычное удаление - это нитрификация, за которой следует денитрификация. Стоимость этого процесса заключается в основном в аэрация (подача кислорода в реактор) и добавление внешнего источника углерода (например, метанол ) для денитрификации.
Нитрификация также может происходить в питьевой воде. В системах распределения, где хлорамины используются в качестве вторичного дезинфицирующего средства, наличие свободного аммиака может действовать как субстрат для окисляющих аммиак микроорганизмов. Связанные с этим реакции могут привести к истощению остатков дезинфицирующего средства в системе.[9] Было показано, что добавление хлорит-иона к воде, обработанной хлорамином, контролирует нитрификацию.[10][11]
Вместе с аммонификация, нитрификация образует минерализация процесс, который относится к полному разложению органического материала с выделением доступных соединений азота. Это пополняет азотный цикл.
Химия и энзимология
Нитрификация - это процесс соединения азота окисление (эффективно, потеря электронов из азот атом к кислород атомов) и постепенно катализируется рядом ферментов.
- (Нитросомонады, Comammox )
- (Нитробактер, Нитроспира, Comammox )
ИЛИ
В Nitrosomonas europaea, первая стадия окисления (аммиак до гидроксиламин ) осуществляется ферментом аммиачная монооксигеназа (AMO).
Вторая стадия (от гидроксиламина до нитрита) осуществляется поэтапно двумя разными ферментами. Гидроксиламин оксидоредуктаза (HAO) превращает гидроксиламин в оксид азота.[12]
Еще один пока неизвестный фермент, который превращает оксид азота в нитрит.
Третий этап (от нитрита к нитрату) завершается в другом организме.
Нитрификация в морской среде
в морская среда, азот часто ограничение питательных веществ, так что азотный цикл в океане представляет особый интерес.[13][14] Этап нитрификации цикла представляет особый интерес для океана, потому что он создает нитрат, основная форма азота, отвечающая за «новое» производство. Кроме того, по мере того, как океан обогащается антропогенный CO2, в результате чего pH может привести к снижению скорости нитрификации. Нитрификация потенциально может стать «узким местом» в азотном цикле.[15]
Нитрификация, как указано выше, формально представляет собой двухэтапный процесс; на первом этапе аммиак является окисленный к нитрит, а на второй стадии нитрит окисляется до нитрата. За каждый шаг в морской среде отвечают разные микробы. Несколько групп аммиакокисляющие бактерии (AOB) известны в морской среде, в том числе Нитросомонады, Нитроспира, и Нитрозококк. Все содержат функциональный ген аммиачная монооксигеназа (AMO), который, как следует из названия, отвечает за окисление аммиака.[2][14] Более свежий метагеномный исследования показали, что некоторые Таумархеота (ранее Crenarchaeota) обладают AMO. Таумархеоты многочисленны в океане, и некоторые виды имеют в 200 раз большее сродство к аммиаку, чем АОБ, что заставляет исследователей оспаривать предыдущее мнение о том, что АОБ в первую очередь ответственны за нитрификацию в океане.[13] Кроме того, хотя классически считается, что нитрификация отделена от основное производство потому что окисление азота бактерии ингибируется светом, нитрификация AOA, по-видимому, не ингибируется светом, что означает, что нитрификация происходит на протяжении всего столб воды, бросая вызов классическим определениям «новое» и «переработанное» производство.[13]
На втором этапе нитрит окисляется до нитрата. В океанах этот шаг не так хорошо изучен, как первый, но бактерии Нитроспина и Нитробактер как известно, выполняют этот шаг в море.[13]
Почвенные условия, контролирующие скорость нитрификации
- Наличие субстрата (наличие NH4+)
- Аэрация (наличие O2)
- Хорошо дренированные почвы с влажностью почвы 60%
- pH (близкий к нейтральному)
- Температура (лучше всего 20-30 ° C) => Нитрификация носит сезонный характер и зависит от практики землепользования.
Ингибиторы нитрификации
Нитрификация ингибиторы химические соединения, замедляющие нитрификацию аммиак, содержащие аммоний или мочевину удобрения, которые вносятся в почву как удобрения. Эти ингибиторы могут помочь снизить потери азота в почве, которые в противном случае использовались бы для сельскохозяйственных культур. Ингибиторы нитрификации широко используются, их добавляют примерно в 50% применяемых осенью. безводный аммиак в штатах США, таких как Иллинойс.[16] Обычно они эффективны в увеличении извлечения азотных удобрений в пропашных культурах, но уровень эффективности зависит от внешних условий, и их преимущества, скорее всего, будут заметны при менее чем оптимальных нормах азота.[17]
Экологические проблемы нитрификации также вызывают интерес к использованию ингибиторов нитрификации: основного продукта, нитрат, вымывается в подземные воды, вызывая острую токсичность для многих видов диких животных и способствуя эвтрофикация стоячей воды. Некоторые ингибиторы нитрификации также подавляют образование метан, парниковый газ.
Ингибированию процесса нитрификации в первую очередь способствует отбор и ингибирование / уничтожение бактерий, которые окислять аммиачные соединения. Множество соединений, ингибирующих нитрификацию, которые можно разделить на следующие области: активный центр аммиачная монооксигеназа (AMO), механистические ингибиторы и процесс N-гетероциклические соединения. Процесс для последнего из трех еще не до конца понят, но заметен. Присутствие AMO было подтверждено на многих субстратах, которые являются ингибиторами азота, такими как дициандиамид, тиосульфат аммония, и нитрапирин.
Превращение аммиака в гидроксиламин - первая ступень нитрификации, где AH2 представляет собой ряд потенциальных доноров электронов.
- NH3 + AH2 + О2 → NH2ОЙ + А + ЧАС2О
Эта реакция катализируется АМО. Ингибиторы этой реакции связываются с активным центром AMO и предотвращают или задерживают процесс. Процесс окисления аммиака AMO считается важным из-за того, что для других процессов требуется совместное окисление NH3 на поставку восстанавливающих эквивалентов. Обычно это обеспечивается соединением гидроксиламин оксидоредуктаза (HAO), который катализирует реакцию:
- NH2ОЙ + ЧАС2О → Нет2− + 5 часов+ + 4 е−
Механизм торможения усложняется этим требованием. Кинетический анализ ингибирования NH3 окисление показало, что субстраты АМО показали кинетику в диапазоне от конкурентоспособный к неконкурентоспособный. Связывание и окисление могут происходить в двух разных местах на AMO: в конкурентных субстратах связывание и окисление происходит в NH3 сайт, в то время как в неконкурентоспособных субстратах он встречается на другом сайте.
Ингибиторы, основанные на механизме, можно определить как соединения, которые прерывают нормальную реакцию, катализируемую ферментом. Этот метод происходит путем инактивации фермента через ковалентный модификация продукта, которая в конечном итоге тормозит нитрификацию. В ходе этого процесса AMO деактивируется, и один или несколько белков ковалентно связываются с конечным продуктом. Обнаружено, что это наиболее заметно в широком диапазоне сера или ацетиленовые соединения.
Установлено, что серосодержащие соединения, в том числе тиосульфат аммония (популярный ингибитор), производят летучие соединения с сильным ингибирующим действием, такие как сероуглерод и тиомочевина.
В частности, заметным добавлением стал тиофосфорилтриамид, имеющий двойную цель ингибирования как продукции уреаза и нитрификация.[18] При исследовании ингибирующих эффектов окисления бактериями Nitrosomonas europaea, использование тиоэфиры привело к окислению этих соединений до сульфоксиды, где атом S является первичным сайтом окисления AMO. Это наиболее сильно коррелирует с областью конкурентного торможения.
N-гетероциклические соединения также являются высокоэффективными ингибиторами нитрификации и часто классифицируются по их кольцевой структуре. Механизм действия этих соединений не совсем понятен: хотя нитрапирин, широко используемый ингибитор и субстрат AMO, является ингибитором указанного фермента, основанным на слабом механизме, эффекты указанного механизма не могут напрямую коррелировать со способностью соединения к подавляют нитрификацию. Предполагается, что нитрапирин действует против фермента монооксигеназы в бактериях, предотвращая рост и CH4/ NH4 окисление.[19] Соединения, содержащие два или три соседних кольцевых атома N (пиридазин, пиразол, индазол ), как правило, обладают значительно более сильным ингибирующим действием, чем соединения, содержащие несмежные атомы N или одиночные кольцевые атомы азота (пиридин, пиррол ).[20] Это говорит о том, что присутствие атомов азота в кольце напрямую коррелирует с ингибирующим эффектом этого класса соединений.
Ингибирование метана
Некоторые ингибиторы ферментативной нитрификации, такие как уреаза, также могут ингибировать производство метана в метанотрофный бактерии. AMO показывает аналогичные скорости кинетического оборота метанмонооксигеназа (MMO), обнаруженный у метанотрофов, что указывает на то, что MMO является катализатором, аналогичным AMO для окисления метана. Кроме того, метанотрофные бактерии имеют много общего с NH
3 окислители, такие как Нитросомонады.[21] Профиль ингибитора твердых частиц MMO (pMMO) показывает сходство с профилем AMO, что приводит к сходству свойств MMO у метанотрофов и AMO у автотрофы.
Проблемы окружающей среды

Ингибиторы нитрификации также представляют интерес с экологической точки зрения из-за образования нитратов и оксид азота от процесса нитрификации. Закись азота (N2O), хотя его концентрация в атмосфере намного ниже, чем у CO2, имеет глобальное потепление потенциал примерно в 300 раз больше, чем углекислый газ, и вносит вклад в 6% планетарного потепления за счет парниковых газов. Это соединение также примечательно катализирующий распад озона в стратосфера.[22] Нитраты, токсичное соединение для диких животных и животных и продукт нитрификации, также вызывают озабоченность.
Почва, состоящая из полианионный глины и силикаты, как правило, имеет чистый анионный заряд. Следовательно, аммоний (NH4+) прочно связывается с почвой, но нитрат-ионы (NO3−) не. Поскольку нитрат более подвижен, он выщелачивает в запасы грунтовых вод через сельскохозяйственные стоки. Нитраты в грунтовых водах могут влиять на концентрацию в поверхностных водах либо за счет прямого взаимодействия грунтовых вод с поверхностными водами (например, набегающие участки ручьев, родники), либо из-за их извлечения для использования на поверхности. Например, большая часть питьевой воды в США поступает из грунтовых вод, но большинство очистных сооружений сбрасывают в поверхностные воды.
Дикие животные, такие как земноводные, пресноводные рыбы и насекомые, чувствительны к уровню нитратов и, как известно, вызывают смерть и аномалии развития у пораженных видов.[23] Уровни нитратов также способствуют эвтрофикация, процесс, при котором крупное цветение водорослей снижает уровень кислорода в водоемах и приводит к смерти потребляющих кислород существ из-за аноксии. Считается также, что нитрификация способствует образованию фотохимический смог, приземный озон, кислотный дождь, изменения в видовое разнообразие, и другие нежелательные процессы. Кроме того, ингибиторы нитрификации также подавляют окисление метана (CH4), мощный парниковый газ, в CO2. И то и другое нитрапирин и ацетилен показано, что они являются особенно сильными супрессорами обоих процессов, хотя способы их различения неясны.
Смотрите также
- f-соотношение
- Процесс Габера
- Нитрифицирующие бактерии
- Фиксация азота
- Одновременная нитрификация-денитрификация
- Comammox
использованная литература
- ^ Сеть нитрификации. «Праймер нитрификационный». nitrificationnetwork.org. Государственный университет Орегона. Архивировано из оригинал 2 мая 2018 г.. Получено 21 августа 2014.
- ^ а б c d Hatzenpichler, R (2012). «Разнообразие, физиология и дифференциация ниш аммиакокисляющих архей». Appl Environ Microbiol. 78 (21): 7501–7510. Дои:10.1128 / aem.01960-12. ЧВК 3485721. PMID 22923400.
- ^ Treusch, A.H .; Leininger, S .; Клецин, А .; Schuster, S.C .; Klenk, H.P .; Шлепер, К. (2005). «Новые гены нитритредуктазы и родственных Amo белков указывают на роль некультивируемых мезофильных кренархей в круговороте азота». Экологическая микробиология. 7 (12): 1985–95. Дои:10.1111 / j.1462-2920.2005.00906.x. PMID 16309395.
- ^ Purkhold, U .; Pommerening-Roser, A .; Юречко, С .; Schmid, M.C .; Koops, H.-P .; Вагнер, М. (2000). «Филогения всех известных видов окислителей аммиака на основе сравнительного анализа 16S рРНК и последовательности amoA: значение для исследований молекулярного разнообразия». Appl Environ Microbiol. 66 (12): 5368–5382. Дои:10.1128 / aem.66.12.5368-5382.2000. ЧВК 92470. PMID 11097916.
- ^ Martens-Habbena, W .; Berube, P.M .; Urakawa, H .; де ла Торре, J. R .; Шталь, Д. А. (2009). «Кинетика окисления аммиака определяет разделение ниш нитрифицирующих архей и бактерий». Природа. 461 (7266): 976–981. Bibcode:2009Натура.461..976М. Дои:10.1038 / природа08465. PMID 19794413. S2CID 1692603.
- ^ Wuchter, C .; Аббас, Б .; Coolen, M.J.L .; Herfort, L .; van Bleijswijk, J .; Timmers, P .; и другие. (2006). «Нитрификация архей в океане». Proc Natl Acad Sci USA. 103 (33): 12317–12322. Bibcode:2006PNAS..10312317W. Дои:10.1073 / pnas.0600756103. ЧВК 1533803. PMID 16894176.
- ^ Leininger, S .; Урих, Т .; Schloter, M .; Schwark, L .; Qi, J .; Nicol, G.W .; Проссер, Дж. И.; Schuster, S.C .; Шлепер, К. (2006). «Среди прокариот, окисляющих аммиак, в почвах преобладают археи» (PDF). Природа. 442 (7104): 806–809. Bibcode:2006 Натур.442..806L. Дои:10.1038 / природа04983. PMID 16915287. S2CID 4380804.
- ^ Marsh, K. L .; Sims, G.K .; Малвани, Р. Л. (2005). "Доступность мочевины для автотрофных аммиакокисляющих бактерий в связи с судьбой 14C- и 15N-меченая мочевина добавлена в почву ». Биол. Fert. Почва. 42 (2): 137–145. Дои:10.1007 / s00374-005-0004-2. S2CID 6245255.
- ^ Zhang, Y; Любовь, N; Эдвардс, М (2009). «Нитрификация в системах питьевой воды». Критические обзоры в области науки об окружающей среде и технологий. 39 (3): 153–208. Дои:10.1080/10643380701631739. S2CID 96988652.
- ^ Макгуайр, Майкл Дж .; Лиу, Нэнси I .; Пиртри, Мари С. (1999). «Использование хлорит-иона для контроля нитрификации». Журнал - Американская ассоциация водопроводных сооружений. 91 (10): 52–61. Дои:10.1002 / j.1551-8833.1999.tb08715.x.
- ^ Макгуайр, Майкл Дж .; У, Сюэин; Blute, Николь К .; Аскенайзер, Даниэль; Цинь, Банда (2009). «Предотвращение нитрификации с помощью хлорит-иона: результаты демонстрационного проекта в Глендейле, Калифорния». Журнал - Американская ассоциация водопроводных сооружений. 101 (10): 47–59. Дои:10.1002 / j.1551-8833.2009.tb09970.x.
- ^ Каранто, Джонатан Д.; Ланкастер, Кайл М. (2017-08-01). «Оксид азота является облигатным промежуточным продуктом бактериальной нитрификации, продуцируемым гидроксиламиноксидоредуктазой». Труды Национальной академии наук. 114 (31): 8217–8222. Дои:10.1073 / pnas.1704504114. ЧВК 5547625. PMID 28716929.
- ^ а б c d Zehr, J. P .; Кудела, Р. М. (2011). «Азотный цикл открытого океана: от генов к экосистемам». Ежегодный обзор морской науки. 3: 197–225. Bibcode:2011 ОРУЖИЕ .... 3..197Z. Дои:10.1146 / annurev-marine-120709-142819. PMID 21329204. S2CID 23018410.
- ^ а б Уорд, Б. Б. (1996). «Нитрификация и денитрификация: исследование круговорота азота в водной среде» (PDF). Микробная экология. 32 (3): 247–61. Дои:10.1007 / BF00183061. PMID 8849421. S2CID 11550311.
- ^ Хатчинс, Дэвид; Малхолланд, Маргарет; Фу, Feixue (2009). «Круговорот питательных веществ и морские микробы в СО2-обогащенный океан ». Океанография. 22 (4): 128–145. Дои:10.5670 / oceanog.2009.103.
- ^ Czapar, Джордж Ф .; Пэйн, Жан; Тейт, Джоди (2007). «Образовательная программа по правильному выбору времени для внесения азотных удобрений осенью». Управление урожаем. 6: 1–4. Дои:10.1094 / CM-2007-0510-01-RS.
- ^ Фергюсон, Р. Жаворонок, R; Слейтер, Г. (2003). «Подходы к определению зоны управления применением ингибиторов нитрификации». Почвоведение. Soc. Am. J. 67 (3): 937–947. Bibcode:2003SSASJ..67..937F. Дои:10.2136 / sssaj2003.0937.
- ^ Маккарти, Дж. У. (1999). «Способы действия ингибиторов нитрификации». Биология и плодородие почв. 29: 1–9. Дои:10.1007 / s003740050518. S2CID 38059676.
- ^ Topp, E; Ноулз, Р. (1984). «Влияние нитрапирина [2-хлор-6- (трихлорметил) пиридин] на облигатный метанотроф» Methylosinus trichosporium OB3б ". Appl. Environ. Микробиол. 47 (2): 258–262. Дои:10.1007 / BF01576048. ЧВК 239655. PMID 16346465. S2CID 34551923.
- ^ Маккарти, Г. (1998). «Способы действия ингибиторов нитрификации». Биология и плодородие почв. 29 (1): 1–9. Дои:10.1007 / s003740050518. S2CID 38059676.
- ^ Ноулз, Б. (1989). «Физиология, биохимия и специфические ингибиторы CH4, NH4+, и окисление СО метанотрофами и нитрификаторами ». Microbiol. Rev. 53 (1): 68–84. Дои:10.1128 / MMBR.53.1.68-84.1989. ЧВК 372717. PMID 2496288.
- ^ Singh, S. N .; Верма, Амитош (2007). «Экологический обзор: потенциал ингибиторов нитрификации для управления эффектом загрязнения азотными удобрениями в сельскохозяйственных и других почвах: обзор». Экологическая практика. 9 (4): 266–279. Дои:10.1017 / S1466046607070482. S2CID 128612680.
- ^ Роуз, Дж; Бишоп, C; Struger, J (1999). «Азотное загрязнение: оценка его угрозы выживанию амфибий». Environ. Перспектива здоровья. 107 (10): 799–803. Дои:10.2307/3454576. JSTOR 3454576. ЧВК 1566592. PMID 10504145.
внешние ссылки
- Нитрификация в основе фильтрации на fishdoc.co.uk
- Нитрификация в Университете Абердина · Королевский колледж
- Основы нитрификации для операторов вентилируемых лагун на lagoonsonline.com