Изотермическая микрокалориметрия - Isothermal microcalorimetry
 | |
| Акроним | IMC |
|---|---|
| Классификация | Термический анализ |
| Другие техники | |
| Связанный | Изотермическая калориметрия титрования Дифференциальная сканирующая калориметрия |
Изотермическая микрокалориметрия (IMC) представляет собой лабораторный метод мониторинга и динамического анализа химических, физических и биологических процессов в реальном времени. В течение нескольких часов или дней IMC определяет начало, скорость, степень и энергетику таких процессов для образцов в небольших помещениях. ампулы (например, 3–20 мл) при постоянной заданной температуре (примерно 15–150 ° C).
IMC выполняет этот динамический анализ, измеряя и записывая в зависимости от прошедшего времени чистую скорость теплового потока (мкДж / сек = мкВт) к или от ампулы с образцом, а также совокупное количество потребляемого или произведенного тепла (Дж).
IMC - мощный и универсальный аналитический инструмент по четырем тесно связанным причинам:
- Все химические и физические процессы являются либо экзотермическими, либо эндотермическими - производят или потребляют тепло.
- В скорость теплового потока пропорциональна скорости происходящего процесса.
- IMC достаточно чувствителен, чтобы обнаруживать и отслеживать либо медленные процессы (реакции, протекающие с частотой несколько процентов в год) в нескольких граммах материала, либо процессы, которые генерируют незначительное количество тепла (например, метаболизм нескольких тысяч живых клеток).
- Инструменты IMC обычно имеют огромный динамический диапазон - тепловые потоки не превышают ок. 1 мкВт и прибл. 50 000 мкВт можно измерить тем же прибором.
Таким образом, метод IMC для изучения скорости процессов широко применим, обеспечивает непрерывные данные в реальном времени и является чувствительным. Измерение просто выполнить, оно выполняется автоматически и не мешает (например, флуоресцентные или радиоактивные маркеры не требуются).
Однако есть два основных предостережения, которые необходимо учитывать при использовании IMC:
- Пропущенные данные: Если используются ампулы с образцами, приготовленные извне, требуется ок. 40 минут, чтобы медленно ввести ампулу в прибор без значительного нарушения заданной температуры в измерительном модуле. Таким образом, никакие процессы, происходящие в это время, не отслеживаются.
- Посторонние данные: IMC регистрирует совокупный чистый тепловой поток, производимый или потребляемый всеми процессами, происходящими в ампуле. Следовательно, чтобы быть уверенным, какой процесс или процессы производят измеряемый тепловой поток, необходимо проявлять большую осторожность как при планировании эксперимента, так и при первоначальном использовании соответствующих химических, физических и биологических анализов.
В общем, возможные применения IMC ограничены только воображением человека, который решает использовать его в качестве аналитического инструмента, и физическими ограничениями метода. Помимо двух общих ограничений (основных предостережений), описанных выше, эти ограничения включают размер образца и ампулы, а также температуры, при которых можно проводить измерения. IMC обычно лучше всего подходит для оценки процессов, которые происходят в течение нескольких часов или дней. IMC используется в чрезвычайно широком диапазоне приложений, и в этой статье обсуждается множество примеров, подкрепленных ссылками на опубликованную литературу. Обсуждаемые области применения варьируются от измерения медленного окислительного разложения полимеров и нестабильности опасных промышленных химикатов до обнаружения бактерий в моче и оценки воздействия лекарств на паразитических червей. В данной статье основное внимание уделяется приложениям последнего типа - биологии и медицине.
Обзор
Определение, цель и сфера применения
Калориметрия это наука об измерении теплота химических реакций или физические изменения. Калориметрия выполняется с помощью калориметр.
Изотермическая микрокалориметрия (IMC) - это лабораторный метод для непрерывного измерения в реальном времени скорости теплового потока (мкДж / сек = мкВт) и совокупного количества тепла (Дж), потребляемого или производимого при практически постоянной температуре образцом, помещенным в IMC. инструмент. Такое нагревание происходит из-за химических или физических изменений, происходящих в образце. Тепловой поток пропорционален совокупной скорости изменений, происходящих в данный момент времени. Суммарное тепло, произведенное в течение заданного интервала времени, пропорционально совокупному количеству произошедших совокупных изменений.
Таким образом, IMC является средством динамической количественной оценки скорости и энергии широкого диапазона процессов скорости, включая биологические процессы. Скорость процесса определяется здесь как физическое и / или химическое изменение, развитие которого во времени может быть описано либо эмпирически, либо с помощью математической модели (Библиография: Glasstone и др. 1941 и Джонсон и др. 1974 и Уравнение оценки ).
Самым простым способом использования IMC является обнаружение того, что в образце происходит один или несколько процессов скорости, потому что тепло выделяется или потребляется со скоростью, превышающей предел обнаружения используемого прибора. Это может быть полезно, например, в качестве общего индикатора того, что твердый или жидкий материал не инертен, а вместо этого изменяется при заданной температуре. В биологических образцах, содержащих питательную среду, появление с течением времени обнаруживаемого и возрастающего сигнала теплового потока является простым общим индикатором присутствия некоторого типа реплицирующихся клеток.

рисунок 1
Однако для большинства приложений крайне важно знать, каким-либо образом, какой процесс или процессы измеряются путем мониторинга теплового потока. В общем, это влечет за собой сначала подробные физические, химические и биологические знания предметов, помещенных в ампулу IMC, прежде чем они будут помещены в прибор IMC для оценки теплового потока с течением времени. Также необходимо проанализировать содержимое ампулы после того, как IMC измерения теплового потока были сделаны в течение одного или нескольких периодов времени. Кроме того, для определения конкретного источника или источников теплового потока можно использовать логические вариации содержимого ампулы. Когда соотношение между темпами и тепловым потоком установлено, можно напрямую полагаться на данные IMC.
То, что IMC может измерять на практике, частично зависит от размеров образца, и они обязательно ограничиваются конструкцией прибора. Данный коммерческий инструмент обычно принимает образцы до фиксированного диаметра и высоты. Инструменты, принимающие образцы размером до прибл. 1 или 2 см в диаметре x ок. 5 см высотой. В данном приборе более крупные образцы данного типа обычно производят более сильные сигналы теплового потока, и это может повысить точность обнаружения и точность.
Часто образцы представляют собой простые цилиндрические ампулы объемом от 3 до 20 мл (рис. 1), содержащие материалы, скорость процесса которых представляет интерес, например. твердые вещества, жидкости, культивируемые клетки - или любая комбинация этих или других элементов, которая, как ожидается, приведет к производству или потреблению тепла. Многие полезные измерения IMC могут быть выполнены с использованием простых запечатанных ампул, а стеклянные ампулы являются обычным явлением, поскольку стекло не подвержено тепловым химическим или физическим изменениям. Однако иногда используются металлические или полимерные ампулы. Также доступны системы инструмент / ампула, которые позволяют впрыскивать или контролировать поток газов или жидкостей и / или обеспечивают механическое перемешивание образца.
Коммерческие приборы IMC позволяют измерять тепловой поток в диапазоне температур от прибл. 15 ° С - 150 ° С. Диапазон для данного инструмента может несколько отличаться.
IMC чрезвычайно чувствителен - например, тепло от медленных химических реакций в образцах массой несколько граммов, происходящих при расходе реагентов в несколько процентов в год, может быть обнаружено и количественно определено в течение нескольких дней. Примеры включают постепенное окисление полимерных материалов имплантатов и исследования срока годности твердых фармацевтических лекарственных форм (Применение: твердые материалы ).
Также скорость метаболического производства тепла, например, можно измерить несколько тысяч живых клеток, микроорганизмов или простейших в культуре в ампуле IMC. Количество такого метаболического тепла может быть коррелировано (экспериментально) с количеством присутствующих клеток или организмов. Таким образом, данные IMC можно использовать для мониторинга в реальном времени количества присутствующих клеток или организмов и чистой скорости роста или уменьшения этого количества (Область применения: биология и медицина. ).
Хотя обсуждаются некоторые небиологические применения IMC (Применение: твердые материалы ) настоящий акцент в этой статье делается на использовании IMC в связи с биологическими процессами (Область применения: биология и медицина. ).
Полученные данные

Рис. 2
Графическое изображение общего типа данных IMC показано на рис. 2. Вверху представлен график зависимости зарегистрированного теплового потока (μ W = μ Дж / с) от времени для образца в запаянной ампуле из-за экзотермический процесс, который начинается, ускоряется, достигает пикового теплового потока и затем стихает. Такие данные непосредственно полезны (например, обнаружение процесса и его продолжительности при фиксированных условиях), но данные также легко оцениваются математически для определения параметров процесса. Например, на рис. 2 также показано объединение данных теплового потока, показывающее накопленное тепло (Дж) в зависимости от времени. Как показано, такие параметры, как максимальная скорость роста (тепловыделения) процесса и продолжительность лаг-фазы до того, как процесс достигнет максимального тепловыделения, могут быть рассчитаны на основе интегрированных данных.[1] Расчеты с использованием данных о тепловом потоке, хранящихся в компьютерных файлах, легко автоматизировать. Такой анализ данных IMC для определения параметров роста имеет важные приложения в биологических науках (Область применения: биология и медицина. ). Кроме того, скорости теплового потока, полученные при серии температур, можно использовать для получения энергии активации оцениваемого процесса (Hardison et al. 2003).[2]
История развития
Лавуазье и Лапласу приписывают создание и использование первого изотермического калориметра ок. 1780 (Библиография: Lavoisier A & Laplace PS 1780 ). В их инструменте использовался лед, чтобы обеспечить относительно постоянную температуру в ограниченном пространстве. Они поняли, что когда они помещали на лед выделяющий тепло образец (например, живое животное), масса жидкой воды, производимой тающим льдом, была прямо пропорциональна теплу, производимому образцом.
Многие современные конструкции инструментов IMC являются результатом работ, выполненных в Швеции в конце 1960-х - начале 1970-х годов (Wadsö 1968,[3] Сууркууск и Вадсё 1974[4]). В этой работе использовались преимущества параллельной разработки твердотельных электронных устройств, в частности коммерческая доступность небольших термоэлектрический эффект (Пельтье-Зеебека) устройства для преобразования теплового потока в напряжение и наоборот.
В 1980-х годах появились многоканальные конструкции (Сууркууск, 1982),[5] которые позволяют проводить параллельную оценку нескольких образцов. Это значительно увеличило мощность и полезность IMC и привело к усилиям по тонкой настройке метода (Thorén et al. 1989).[6] Большая часть дальнейшего проектирования и развития, выполненных в 1990-х годах, также была выполнена в Швеции Вадсё и Сууркууском и их коллегами. В этой работе использовались преимущества параллельного развития технологий персональных компьютеров, которые значительно расширили возможности простого хранения, обработки и интерпретации данных о тепловом потоке в зависимости от времени.
Работа по разработке приборов с 1990-х годов позволила получить дальнейшие преимущества от непрерывного развития твердотельной электроники и технологий персональных компьютеров. В результате были созданы инструменты IMC с повышенной чувствительностью и стабильностью, количеством параллельных каналов и еще большей способностью удобно записывать, хранить и быстро обрабатывать данные IMC. В связи с более широким использованием, значительное внимание было уделено созданию стандартов для описания характеристик инструментов IMC (например, точность, точность, чувствительность) и методов калибровки (Wadsö and Goldberg 2001).[7]
Инструменты и принципы измерения
Конфигурации инструментов
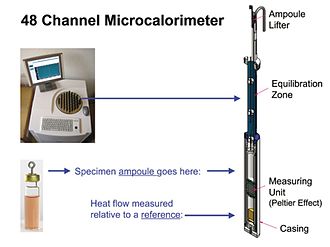
Рис. 3
Современные инструменты IMC фактически полуадиабатические, т.е. теплообмен между образцом и его окружением не равен нулю (адиабатический), поскольку измерение теплового потока IMC зависит от наличия небольшого перепада температур - ок. 0,001 ° С.[7] Однако, поскольку разница настолько мала, измерения IMC по существу изотермические. На рис. 3. показан обзор прибора IMC, который содержит 48 отдельных модулей измерения теплового потока. Показан один модуль. Измерительным блоком модуля обычно является устройство Пельтье-Зеебека. Устройство создает напряжение, пропорциональное разнице температур между образцом, который выделяет или потребляет тепло, и термически неактивным эталоном, который находится при температуре радиатора. Разница температур, в свою очередь, пропорциональна скорости, с которой образец производит или потребляет тепло (см. Калибровка ниже). Все модули в приборе используют один и тот же радиатор и термостат и, таким образом, все выдают данные при одинаковой заданной температуре. Однако обычно можно запускать и останавливать измерения в каждой ампуле независимо. В высокопараллельном (например, 48-канальном) приборе, таком как показанный на рис.3, это позволяет проводить (запускать и останавливать) несколько различных экспериментов, когда это удобно.
В качестве альтернативы инструменты IMC могут быть оснащены дуплексными модулями, которые выдают сигналы, пропорциональные разнице теплового потока между двумя ампулами. Одна из двух таких дуплексных ампул часто бывает пустой или контрольной, т.е. образец, который не содержит материала, вызывающего интересующий процесс скорости, но содержание которого в остальном идентично тому, что находится в ампуле образца. Это обеспечивает средства для устранения незначительных реакций с выделением тепла, которые не представляют интереса, например постепенных химических изменений в течение нескольких дней в среде для культивирования клеток при температуре измерения. Многие полезные измерения IMC можно выполнить с помощью простых запечатанных ампул. Однако, как упоминалось выше, доступны системы инструмент / ампула, которые позволяют или даже регулируют поток газов или жидкостей к образцам и / или от них и / или обеспечивают механическое перемешивание образцов.
Справочные вставки
Тепловой поток обычно измеряется относительно эталонной вставки, как показано на рис. 3. Обычно это металлический купон который химически и физически стабилен при любой температуре в рабочем диапазоне прибора и, следовательно, сам не выделяет и не потребляет тепло. Для достижения наилучших результатов эталон должен иметь теплоемкость, близкую к теплоемкости образца (например, ампула IMC с содержимым).
Режимы работы
Режим теплопроводности (hc)
Коммерческие приборы IMC часто работают как калориметры теплопроводности (hc), в которых тепло, выделяемое образцом (т.е. материалом в ампуле), течет к радиатору, обычно к алюминиевому блоку, содержащемуся в термостате (например, бане с постоянной температурой). Как упоминалось выше, прибор IMC, работающий в режиме hc, не является точно изотермическим, потому что обязательно существуют небольшие различия между заданной температурой и температурой образца - так что существует измеримый тепловой поток. Однако небольшие колебания температуры образца не оказывают существенного влияния на температуру радиатора, поскольку теплоемкость радиатора намного выше, чем у образца - обычно около 10%. 100 ×.
Теплообмен между образцом и радиатором происходит через Пельтье-Зеебек устройство, позволяющее динамическое измерение произведенного или потребляемого тепла. В приборах исследовательского качества температура термостата / радиатора обычно имеет точность <± 0,1 K и поддерживается в пределах прибл. <± 100 мкК / 24ч. Точность, с которой температура радиатора поддерживается с течением времени, является основным определяющим фактором точности измерений теплового потока с течением времени. Преимущество режима hc - большой динамический диапазон. Тепловые потоки ок. 50 000 мкВт можно измерить с точностью прибл. ± 0,2 мкВт. Таким образом, измеряя тепловой поток ок. > 0,2 мкВт выше базовой линии означает обнаружение теплового потока, хотя часто используется более консервативное определение 10-кратного предела точности.
Режим компенсации мощности (ПК)
Некоторые приборы IMC работают (или могут также работать) как калориметры компенсации мощности (ПК). В этом случае, чтобы поддерживать образец при заданной температуре, выделяемое тепло компенсируется с помощью устройства Пельтье-Зеебека. Потребляемое тепло компенсируется либо электрическим нагревателем, либо изменением полярности устройства (van Herwaarden, 2000).[8] Если данный прибор работает в режиме ПК, а не в режиме hc, точность измерения теплового потока остается прежней (например, приблизительно ± 0,2 мкВт). Преимущество режима компенсации заключается в меньшей постоянной времени, т. Е. Время, необходимое для обнаружения данного импульса теплового потока, примерно в 10 раз меньше, чем в режиме теплопроводности. Недостаток - ок. В 10 раз меньший динамический диапазон по сравнению с режимом hc.
Калибровка
Для работы в режиме hc или pc обычная калибровка коммерческих приборов обычно выполняется с помощью встроенных электрических нагревателей. Рабочие характеристики электрических нагревателей, в свою очередь, могут быть подтверждены с использованием образцов с известной теплоемкостью или образцов, которые производят химические реакции, тепловыделение которых на единицу массы известно из термодинамики (Wadsö and Goldberg 2001).[7] В режиме hc или pc результирующий сигнал представляет собой регистрируемое компьютером напряжение, откалиброванное для представления теплового потока в диапазоне μ W в зависимости от времени. В частности, если в образце не существует значительных температурных градиентов, то P = eC [U + t (dU / dt)], где P - тепловой поток (т.е. μ Вт), εC - калибровочная постоянная, U - измеренная разность потенциалов на термобатареи, а t - постоянная времени. В установившемся режиме - например, при выпуске постоянного электрического калибровочного тока, это упрощается до P = eC У. (Вадсё, Гольдберг, 2001).[7]
Ампулы
Многие очень полезные измерения IMC можно проводить в запечатанных ампулах (рис. 1), которые предлагают преимущества простоты, защиты от загрязнения и (при необходимости) значительного запаса биобезопасности для людей, которые работают с ампулами или контактируют с ними. Закрытая ампула может содержать любую желаемую комбинацию твердых веществ, жидкостей, газов или предметов биологического происхождения. Исходный состав газа в свободном пространстве ампулы можно контролировать путем герметизации ампулы в требуемой газовой среде.
Однако существуют также конструкции инструментов / ампул IMC, которые позволяют контролировать поток газа или жидкости через ампулу во время измерения и / или механического перемешивания. Кроме того, при наличии соответствующих принадлежностей некоторые приборы IMC могут работать как приборы ITC (изотермической калориметрии титрования). Тема ITC рассматривается в другом месте (см. Изотермическая калориметрия титрования ). Кроме того, некоторые приборы IMC могут регистрировать тепловой поток при медленном изменении (сканировании) температуры с течением времени. Скорость сканирования должна быть низкой. ± 2 K ° / ч - для того, чтобы образцы с шкалой IMC (например, несколько граммов) были достаточно близки к температуре радиатора (<примерно 0,1 ° C). Быстрое сканирование температуры - прерогатива дифференциальная сканирующая калориметрия (DSC) инструменты, которые обычно используют гораздо меньшие образцы. Некоторые инструменты DSC могут работать в режиме IMC, но небольшой размер ампулы (и, следовательно, образца), необходимый для сканирования, ограничивает полезность и чувствительность инструментов DSC, используемых в режиме IMC.
Базовая методология
Установка температуры
Измерения скорости теплового потока (мкДж / сек = мкВт) выполняются, сначала устанавливая термостат прибора IMC на выбранную температуру и позволяя радиатору прибора стабилизироваться при этой температуре. Если прибор IMC, работающий при одной температуре, настроен на новую температуру, повторная стабилизация при новой настройке температуры может занять несколько часов или даже день. Как объяснялось выше, достижение и поддержание точно стабильной температуры имеет основополагающее значение для достижения точных измерений теплового потока в диапазоне мкВт в течение длительного времени (например, дней).
Представляем образец
После стабилизации температуры, если используется приготовленная извне ампула (или какой-либо твердый образец с размерами ампулы), ее медленно вводят (например, опускают) в измерительный модуль прибора, как правило, поэтапно. Цель состоит в том, чтобы гарантировать, что к тому времени, когда ампула / образец окажется в положении измерения, его температура будет близка (в пределах 0,001 ° C) к температуре измерения. Это сделано для того, чтобы любой измеренный затем тепловой поток был вызван процессами изменения скорости образца, а не продолжающимся процессом доведения образца до заданной температуры. Время введения образца в ампуле IMC объемом 3–20 мл в положение измерения составляет ок. 40 минут на многих инструментах. Это означает, что тепловой поток от любых процессов, происходящих в образце в течение периода введения, не регистрируется.
Если используется ампула на месте и вводится какой-либо агент или образец, это также вызывает период нестабильности, но это примерно примерно так. 1 минута. На рис. 5 представлены примеры как длительного периода, необходимого для стабилизации инструмента, если ампула вводится напрямую, так и короткого периода нестабильности из-за инъекции.
Запись данных
После процесса введения тепловой поток образца можно непрерывно точно регистрировать до тех пор, пока он представляет интерес. Чрезвычайная стабильность приборов исследовательского уровня (<± 100 мкК / 24 ч) означает, что точные измерения могут (и часто проводятся) в течение нескольких дней. Поскольку сигнал теплового потока по существу считывается в реальном времени, он служит средством для принятия решения о том, существует ли интересующий тепловой поток по-прежнему. Кроме того, современные приборы хранят данные о тепловом потоке в зависимости от времени в виде компьютерных файлов, поэтому возможно графическое отображение как в реальном времени, так и ретроспективное, а также математический анализ данных.
Удобство использования
Как указано ниже, IMC имеет много преимуществ в качестве метода анализа тарифных процессов, но есть также некоторые предостережения, которые необходимо учитывать.
Преимущества
Широко применимо
Может быть изучен любой процесс изменения скорости - если подходящие образцы будут соответствовать геометрии модуля инструмента IMC и продолжаться со скоростью, соответствующей методологии IMC (см. Выше). Как показано под Приложения, IMC используется для количественной оценки чрезвычайно широкого диапазона скоростных процессов in vitro, например. от твердотельной стабильности полимеров (Hardison et al. 2003)[2] эффективности лекарственных соединений против паразитических червей (Maneck et al. 2011).[9] IMC также может определять совокупную скорость неописанных, сложных или множественных взаимодействий (Lewis & Daniels).[10] Это особенно полезно для сравнительного скрининга, например. влияние различных комбинаций состава материалов и / или процессов изготовления на общую физико-химическую стабильность.
В реальном времени и непрерывно
Данные теплового потока IMC получаются как колебания напряжения во времени, хранятся в компьютерных файлах и могут отображаться практически в реальном времени - по мере того, как происходит процесс изменения скорости. Напряжение, связанное с тепловым потоком, непрерывно во времени, но в современных приборах оно обычно измеряется в цифровом виде. Частоту цифровой выборки можно контролировать по мере необходимости, т.е. частая выборка быстрых изменений теплового потока для лучшего разрешения по времени или более медленная выборка медленных изменений для ограничения размера файла данных.
Чутко и быстро
IMC достаточно чувствителен, чтобы обнаруживать и количественно определять за короткое время (часы, дни) реакции, которые потребляют лишь несколько процентов реагентов в течение длительного времени (месяцы). Таким образом, IMC позволяет избежать длительного ожидания, которое часто требуется, пока не накопится достаточно продукта реакции для обычных (например, химических) анализов. Это относится как к физическим, так и к биологическим образцам (см. Приложения ).
Прямой
Для каждой комбинации переменных образца и заданной температуры, представляющей интерес, IMC обеспечивает прямое определение кинетики теплового потока и совокупной теплоты скоростных процессов. Это избавляет от необходимости предполагать, что процесс изменения скорости остается неизменным при изменении температуры или других контролируемых переменных перед измерением IMC.
Простой
Для сравнения влияния экспериментальных переменных (например, начальных концентраций) на процессы скорости IMC не требует разработки и использования химических или других методов анализа. Если требуются абсолютные данные (например, количество продукта, произведенного в процессе), тогда анализы можно проводить параллельно на образцах, идентичных тем, которые использовались для IMC (и / или на образцах IMC после прогонов IMC). Полученные данные анализа используются для калибровки данных скорости, полученных IMC.
Не мешающий
IMC не требует добавления маркеров (например, флуоресцентных или радиоактивных веществ) для определения скорости процесса. Можно использовать чистые образцы, и после прогона IMC образец остается неизменным (кроме процессов, которые имели место). Образец post-IMC может быть подвергнут любой физической, химической, морфологической или другой оценке, представляющей интерес.
Предостережения
Пропущенные данные
Как указано в описании методологии, когда используется метод IMC для введения запечатанной ампулы, невозможно уловить тепловой поток в течение первых ок. 40 минут, пока образец медленно доводится до заданной температуры. Таким образом, в этом режиме IMC лучше всего подходит для изучения процессов, которые начинаются медленно или медленно при заданной температуре. Это предостережение касается и времени. перед вставка - т.е. время, прошедшее между подготовкой образца (в котором затем может начаться процесс измерения скорости) и запуском процесса введения IMC (Charlebois et al. 2003).[11] Этот последний эффект обычно сводится к минимуму, если температура, выбранная для IMC, значительно выше (например, 37 ° C), чем температура, при которой готовится образец (например, 25 ° C).
Посторонние данные
IMC фиксирует совокупность производство или потребление тепла в результате всех процессов, происходящих в образце, включая, например,
- Возможные изменения физико-химического состояния самой ампулы с образцом; например снятие напряжений в металлических компонентах, окисление полимерных компонентов.
- Деградация питательной среды, в которой изучается метаболизм и рост живых клеток.
Таким образом, при планировании и разработке экспериментов необходимо проявлять большую осторожность, чтобы определить все возможные процессы, которые могут иметь место. Часто бывает необходимо разработать и провести предварительные исследования, предназначенные для систематического определения того, имеют ли место несколько процессов, и если да, то их вклад в совокупный тепловой поток. Одна из стратегий, позволяющая исключить посторонние данные о тепловом потоке, состоит в том, чтобы сравнить тепловой поток для образца, в котором происходит интересующий процесс скорости, с потоком от пустого образца, который включает в себя все в интересующем образце, кроме предмета, который будет пройти процесс процентной ставки. Это может быть достигнуто напрямую с помощью инструментов, имеющих дуплексные модули IMC, которые сообщают чистую разницу теплового потока между двумя ампулами.
Приложения
После обсуждения некоторых специальных источников информации о применении IMC, рассматриваются несколько конкретных категорий IMC-анализа тарифных процессов, а недавние примеры (со ссылками на литературу) обсуждаются в каждой категории.
Специальные источники информации о приложении IMC
Справочники
В Библиография перечисляет четыре обширных тома Справочника по термическому анализу и калориметрии: Vol. 1 Принципы и практика (1998), Vol. 2 Приложения к неорганическим и другим материалам (2003), Vol. 3 Applications to Polymers and Plastics (2002), и Vol. 4 От макромолекул к человеку (1999). Они представляют собой основной источник информации о приложениях и примерах IMC (и ссылки на них), опубликованных до ок. 2000 г.
Примечания к применению
Некоторые производители приборов IMC собрали примечания по применению и сделали их общедоступными.Заметки часто (но не всегда) являются переработкой журнальных статей. Примером может служить Microcalorimetry Compendium Vol. I и II предлагаются TA Instruments, Inc. и перечислены в Библиография.
«Белки» первый раздел заметок в Vol. I, здесь не представляет интереса, поскольку описывает исследования, в которых используются Изотермическая калориметрия титрования. В следующих разделах Vol. I, Life & Biological Sciences и Pharmaceuticals содержат примечания по применению для IMC и Дифференциальная сканирующая калориметрия. Vol. Вторая часть сборника почти полностью посвящена приложениям IMC. Его разделы называются Цемент, Энергетика, Материалы и Прочее. Возможным недостатком этих двух конкретных сборников является то, что ни одна из заметок не датирована. Хотя сборники были опубликованы в 2009 году, некоторые из примечаний описывают инструменты IMC, которые использовались много лет назад и больше не доступны. Таким образом, некоторые из заметок, хотя и актуальны и поучительны, часто описывают исследования, проведенные до 2000 года.
Примеры приложений
В общем, возможные применения IMC ограничиваются только воображением человека, который решает использовать IMC в качестве аналитического инструмента - в рамках ранее описанных ограничений, представленных существующими инструментами и методологией IMC. Это потому, что это универсальное средство для мониторинга любого химического, физического или биологического процесса. Ниже приведены некоторые категории приложений IMC с примерами в каждой. В большинстве категорий опубликованных примеров гораздо больше, чем упомянутых и упомянутых. Категории несколько произвольны и часто пересекаются. Другой набор категорий может быть столь же логичным, и можно добавить больше категорий.
Твердые материалы
Формирование
IMC широко используется для изучения скорости образования различных материалов с помощью различных процессов. Он лучше всего подходит для изучения процессов, которые происходят медленно, т. Е. в течение нескольких часов или дней. Ярким примером является изучение реакций гидратации и схватывания кальциевых минеральных цементных составов. В одной статье представлен обзор (Gawlicki, et al. 2010).[12] а другой описывает простой подход (Evju 2003).[13] Другие исследования посвящены анализу гидратации цемента, предоставленному IMC в сочетании с ИК спектроскопия (Илмен и др., 2010)[14] и об использовании IMC для изучения влияния переменных состава на гидратацию и время схватывания цемента (Xu et al. 2011).[15]
IMC также можно удобно использовать для изучения скорости и количества гидратации (в воздухе с известной влажностью) минералов кальция или других минералов. Чтобы обеспечить воздух известной влажности для таких исследований, небольшие емкости с насыщенными солевыми растворами можно поместить в ампулу IMC вместе с образцом негидратированного минерала. Затем ампулу запаивают и вводят в инструмент IMC. Насыщенный солевой раствор поддерживает воздух в ампуле при известной относительной влажности, а различные обычные солевые растворы обеспечивают влажность в диапазоне от, например, 32-100% относительной влажности. Такие исследования проводились в диапазоне размеров мкм. гидроксиапатит кальция частицы и кальцийсодержащие «наночастицы» биоактивного стекла (Doostmohammadi et al. 2011).[16]
Стабильность
IMC хорошо подходит для быстрой количественной оценки скорости медленных изменений материалов (Willson et al. 1995).[17] Такие оценки по-разному описываются как исследования стабильности, деградации или срок годности.

Рис. 4
Например, IMC в течение многих лет широко использовался в исследованиях срока годности твердых лекарственных форм в фармацевтической промышленности (Pikal et al. 1989,[18] Hansen et al. 1990 г.,[19] Konigbauer et al. 1992 г.[20]IMC обладает способностью обнаруживать медленную деградацию при моделировании хранения на полке намного раньше, чем традиционные аналитические методы, и без необходимости использования методов химического анализа. IMC также является быстрым и чувствительным методом для определения часто функционально важного аморфного содержания лекарств, таких как нифедипин (Vivoda et al. 2011).[21]
IMC можно использовать для быстрого определения скорости медленных изменений в промышленных полимерах. Например, стерилизация гамма-излучением материала, часто используемого для хирургических имплантатов -полиэтилен сверхвысокой молекулярной массы (UHMWPE) - известно, что в полимере образуются свободные радикалы. В результате происходит медленное окисление и постепенное нежелательное охрупчивание полимера на полке или in vivo. IMC может обнаруживать тепло, связанное с окислением, и количественно определять скорость окисления ок. 1% в год в облученном СВМПЭ при комнатной температуре на воздухе (Charlebois et al. 2003).[11] В соответствующем исследовании энергия активации была определена на основе измерений при ряде температур (Hardison et al. 2003).[2]
IMC также очень полезен при оценке «потенциала выхода из-под контроля» материалов, которые представляют значительную опасность пожара или взрыва. Например, его использовали для определения автокаталитической кинетики гидропероксид кумола (ТЭЦ), полупродукт, который используется в химической промышленности и внезапное разложение которого вызвало ряд пожаров и взрывов. На рис. 4 показаны данные IMC, подтверждающие термическое разложение ГПК при 5 различных температурах (Chen et al. 2008).[22]
Биология и медицина
Термин метаболизм может быть использован[нужна цитата ] для описания исследований количественного измерения скорости производства или потребления тепла в зависимости от времени клетками (включая микробы) в культуре, образцами тканей или небольшими целыми организмами. Как описано ниже, метаболизм может быть полезен в качестве диагностического инструмента; особенно в (а) определении природы образца по его тепловому потоку в зависимости от размера при заданном наборе условий, либо (б) определении эффектов, например, фармацевтические соединения на метаболические процессы, органический рост или жизнеспособность. Метаболизм связан с метаболомика. Последний представляет собой систематическое изучение уникальных химических отпечатков пальцев, которые оставляют после себя определенные клеточные процессы; то есть изучение их профилей низкомолекулярных метаболитов. Когда IMC используется для определения метаболизма, продукты изученных метаболических процессов впоследствии становятся доступными для исследований метаболомики. Поскольку IMC не использует биохимические или радиоактивные маркеры, образцы после IMC состоят только из продуктов метаболизма и оставшейся культуральной среды (если таковая использовалась). Если метаболизм и метаболомика используются вместе, они могут обеспечить исчерпывающую запись метаболического процесса, происходящего in vitro: его скорость и энергию, а также продукты его метаболизма.
Для определения метаболизма с использованием IMC, конечно, должно быть достаточно клеток, тканей или организмов, изначально присутствующих (или присутствующих позже, если репликация происходит во время измерений IMC), чтобы генерировать сигнал теплового потока выше предела обнаружения данного прибора. Знаменательная общая статья 2002 года по теме метаболизма дает прекрасную перспективу для рассмотрения метаболических исследований IMC (см. Библиография, West, Woodruff and Brown 2002). Он описывает, как связаны скорости метаболизма и как они масштабируются во всем диапазоне от «молекул и митохондрий до клеток и млекопитающих». Что важно для IMC, авторы также отмечают, что, хотя скорость метаболизма данного типа клеток млекопитающих in vivo заметно снижается с увеличением размера (массы) животного, размер животного-донора не влияет на скорость метаболизма клетки при культивировании. in vitro.
Клеточная и тканевая биология
Клетки млекопитающих в культуре имеют скорость метаболизма ок. 30 × 10−12 Вт / элемент (рис. 2 и 3 в Библиография: Вест, Вудрафф и Браун, 2002 г. ). По определению, инструменты IMC имеют чувствительность не менее 1 × 10−6 Вт (т.е. 1 мкВт). Таким образом, метаболическое тепло ок. Обнаруживается 33000 клеток. Основываясь на этой чувствительности, IMC использовался для выполнения большого количества новаторских исследований метаболизма культивируемых клеток млекопитающих в 1970-х и 1980-х годах в Швеции. Одна статья (Монти, 1990)[23] служит обширным руководством по работе, проделанной до 1990 года. Он включает пояснительный текст и 42 ссылки на исследования IMC теплового потока от культурного человека. эритроциты, тромбоциты, лимфоциты, клетки лимфомы, гранулоциты, адипоциты, скелетные мышцы и ткань миокарда. Исследования были проведены, чтобы определить, как и где IMC можно использовать в качестве метода клинической диагностики и / или дать представление о метаболических различиях между клетками здоровых людей и людей с различными заболеваниями или проблемами со здоровьем.
Разработки с ок. 2000 г. в IMC (например, массивно-параллельные инструменты, компьютерное хранение и анализ данных теплового потока в реальном времени) стимулировали дальнейшее использование IMC в биологии культивируемых клеток. Например, IMC был оценен для оценки антиген-индуцированной пролиферации лимфоцитов (Murigande et al. 2009)[24] и выявили аспекты пролиферации, не наблюдаемые при использовании обычного метода анализа прерывистых радиоактивных маркеров. IMC также применяется в области тканевая инженерия. Одно исследование (Санторо и др., 2011)[25] продемонстрировали, что IMC можно использовать для измерения скорости роста (т. е. распространения) в культуре человека. хондроциты собирают для использования в тканевой инженерии. Он показал, что IMC потенциально может служить для определения эффективности различных составов питательной среды, а также для определения того, могут ли клетки, пожертвованные данным человеком, расти достаточно эффективно, чтобы рассмотреть возможность их использования для производства сконструированной ткани.
IMC также использовался для измерения метаболического ответа культивируемых макрофаги для хирургического имплантата износа мусора. IMC показал, что реакция была сильнее на частицы полиэтилена с диапазоном размеров мкм, чем на частицы сплава Co аналогичного размера (Charlebois et al. 2002).[26] В соответствующей статье рассматривается общая тема применения IMC в области синтетических твердых материалов, используемых в хирургии и медицине (Lewis and Daniels 2003).[10]
По крайней мере, два исследования показали, что IMC может иметь существенное значение при опухолевой патологии. В одном исследовании (Bäckman 1990),[27] измеряли скорость производства тепла клетками Т-лимфомы, культивируемыми в суспензии. Изменения температуры и pH вызывали значительные колебания, но не скорость перемешивания и концентрация клеток. Более прямое исследование возможного диагностического использования (Kallerhoff et al. 1996)[28] дала многообещающие результаты. Для исследованных образцов биопсии мочеполовой ткани результаты показали:
«можно различать образцы нормальной и опухолевой ткани с помощью микрокалориметрического измерения, основанного на явно более высокой метаболической активности злокачественной ткани. Более того, микрокалориметрия позволяет дифференцировать и классифицировать образцы тканей по их гистологической классификации».
Токсикология
По состоянию на 2012 год IMC не получил широкого распространения в токсикологии культивируемых клеток, хотя он периодически и успешно использовался с 1980-х годов. IMC полезен в токсикологии, когда желательно наблюдать метаболизм культивируемых клеток в реальном времени и количественно оценить скорость метаболического снижения как функцию концентрации возможно токсического агента. Один из самых ранних отчетов (Ankerst et al. 1986)[29] Использование IMC в токсикологии представляло собой исследование антителозависимой клеточной токсичности (ADCC) против клеток меланомы человека различных комбинаций антисыворотки, моноклональных антител, а также лимфоцитов периферической крови в качестве эффекторных клеток. Кинетику метаболического теплового потока клеток меланомы в зависимости от времени в закрытых ампулах измеряли в течение 20 часов. Авторы пришли к выводу, что
«... микрокалориметрия - чувствительный и особенно подходящий метод анализа кинетики цитотоксичности».
IMC также используется в токсикологии окружающей среды. В одном из ранних исследований (Thorén 1992)[30] токсичность в отношении монослоев альвеолярных макрофагов частиц MnO2, TiO2 и SiO2 (кремнезем). Результаты IMC соответствовали результатам, полученным путем окрашивания сложным эфиром флуоресцеина и анализа микроскопических изображений, за исключением того, что IMC показала токсические эффекты кварца, не различимые при анализе изображений. Последнее наблюдение - в соответствии с известными альвеолярными эффектами - показало авторам, что IMC является более чувствительной техникой.

Гораздо позже (Лю и др., 2007)[31] Было показано, что IMC предоставляет динамические метаболические данные, которые оценивают токсичность Cr (VI) из хромата калия в отношении фибробластов. На рис. 5 показаны исходные результаты определения метаболического теплового потока от культивированных фибробластов до оценки эффектов Cr (VI). Авторы пришли к выводу, что
«Микрокалориметрия представляется удобным и простым методом измерения метаболических процессов ... в ... живых клетках. В отличие от стандартных процедур биоанализа, этот метод позволяет непрерывно измерять метаболизм живых клеток. Таким образом, мы показали, что Cr ( VI) нарушает метаболические пути фибробластов человека и особенно утилизацию глюкозы ».
Простые закрытые ампулы IMC также использовались и пропагандировались для оценки токсичности культивируемых клеток потенциальных материалов для хирургических имплантатов и, таким образом, служат в качестве метода скрининга биосовместимости. В одном исследовании (Xie et al. 2000)[32] клетки почечных канальцев свиней в культуре подвергались воздействию как полимеров, так и металлического титана в виде «микропланшетов» с известной площадью поверхности в несколько см.2. Авторы пришли к выводу, что IMC
«... это быстрый метод, удобный в использовании и с хорошей воспроизводимостью. Настоящий метод в большинстве случаев может заменить более трудоемкие световые и электронные микроскопические исследования для количественного определения прилипших клеток».
В другом исследовании материалов имплантатов (Doostmohammadi et al.2011)[33] как быстрорастущую культуру дрожжей, так и культуру хондроцитов человека подвергали воздействию частиц (диаметром <50 мкм) гидроксиапатита кальция (НА) и биоактивного (содержащего кальций) кварцевого стекла. Стеклянные частицы замедляли или ограничивали рост дрожжей в зависимости от увеличения концентрации частиц. Частицы ГК имели гораздо меньший эффект и никогда полностью не подавляли рост дрожжей при тех же концентрациях. Влияние обоих типов частиц на рост хондроцитов было минимальным при применяемой концентрации. Авторы пришли к выводу, что
«Цитотоксичность твердых частиц, таких как биоактивное стекло и частицы гидроксиапатита, можно оценить с помощью метода микрокалориметрии. Это современный метод исследования биосовместимости и цитотоксичности биоматериалов in vitro, который можно использовать наряду со старыми традиционными анализами».
Микробиология

Публикации, описывающие использование IMC в микробиологии, начались в 1980-х годах (Jesperson 1982).[34] Хотя некоторые микробиологические исследования IMC были направлены на вирусы (Heng et al. 2005)[35] и грибы (Antoci et al. 1997),[36] большинство из них были озабочены бактериями. Недавняя статья (Braissant et al. 2010)[37] содержит общее введение в методы метаболизма IMC в микробиологии и обзор приложений в медицинской микробиологии и микробиологии окружающей среды. В документе также объясняется, как данные о тепловом потоке в зависимости от времени для бактерий в культуре являются точным выражением (по мере их возникновения во времени) колебаний метаболической активности микроорганизмов и скорости репликации в данной среде (рис. 6).

В общем, бактерии составляют примерно 1/10 размера клеток млекопитающих и производят, возможно, 1/10 метаболического тепла, т.е. ок. 3x10−12 Вт / сот. Таким образом, по сравнению с клетками млекопитающих (см. Выше) ок. В 10 раз больше бактерий - ок. 330 000 - должны присутствовать для создания заметного теплового потока, т.е. 1 мкВт.[37] Однако многие бактерии размножаются в культуре на порядки быстрее, чем клетки млекопитающих, часто удваивая свое количество за считанные минуты (см. Бактериальный рост ). В результате небольшое начальное количество бактерий в культуре, изначально не обнаруживаемых IMC, быстро дает обнаруживаемое количество. Например, 100 бактерий, удваивающихся каждые 20 минут, менее чем за 4 часа произведут> 330 000 бактерий и, таким образом, тепловой поток, обнаруживаемый IMC. Следовательно, IMC можно использовать для простого и быстрого обнаружения бактерий в области медицины. Примеры включают обнаружение бактерий в продуктах тромбоцитов крови человека (Trampuz et al. 2007)[38] и моча (Bonkat et al.2011)[39] и быстрое выявление туберкулеза (Braissant et al. 2010,[40] Родригес и др. 2011 г.[41]). На рис. 7 показан пример времени обнаружения туберкулез бактерий в зависимости от исходного количества бактерий, присутствующих в закрытой ампуле IMC, содержащей питательную среду.
Для микробов в питательной среде в закрытых ампулах данные теплового потока IMC также можно использовать для точной оценки основных параметров роста микробов; т.е. максимальная скорость роста и продолжительность лаг-фазы до достижения максимальной скорости роста. Это важное специальное приложение базового анализа этих параметров, описанного ранее (Обзор: полученные данные ).
К сожалению, в литературе IMC есть некоторые опубликованные статьи, в которых связь между данными теплового потока и ростом микробов в закрытых ампулах была неправильно понята. Однако в 2013 году было опубликовано подробное разъяснение, описывающее (а) детали взаимосвязи между данными теплового потока IMC и ростом микробов, (b) выбор математических моделей, которые описывают рост микробов и (c) определение параметров роста микробов из данных IMC. используя эти модели (Braissant et al. 2013).[42]
Фармакодинамика
В качестве логического расширения способности IMC обнаруживать и количественно определять рост бактерий, известные концентрации антибиотиков могут быть добавлены к бактериальной культуре, и IMC затем может использоваться для количественной оценки их влияния на жизнеспособность и рост. IMC в закрытой ампуле может легко получить основную фармакологическую информацию, например. минимальная ингибирующая концентрация (МПК) антибиотика, необходимая для остановки роста данного организма. Кроме того, он может одновременно обеспечивать параметры динамического роста - время задержки и максимальную скорость роста (см. Рис. 2, Howell et al. 2011, Braissant et al. 2013),[1][42] которые оценивают механизмы действия. Бактерицидное действие (см. Бактерицид ) на это указывает увеличение времени задержки в зависимости от увеличения концентрации антибиотика, в то время как бактериостатическое действие (см. Бактериостатическое средство ) обозначается уменьшением скорости роста с концентрацией. Подход IMC к оценке антибиотиков был продемонстрирован для ряда типов бактерий и антибиотиков (von Ah et al. 2009).[43] IMC в закрытых ампулах также может быстро различать нормальные и устойчивые штаммы бактерий, таких как Золотистый стафилококк (фон Ах и др., 2008 г.,[44] Baldoni et al. 2009 г.[45]). IMC также использовался для оценки воздействия дезинфицирующих средств на жизнеспособность бактерий полости рта, прилипших к материалам дентальных имплантатов (Astasov-Frauenhoffer et al. 2011).[46] В более раннем исследовании IMC использовался для измерения теплоты адгезии стоматологических бактерий к стеклу (Hauser-Gerspach et al. 2008).[47]
Было продемонстрировано аналогичное успешное использование IMC для определения эффектов противоопухолевых препаратов на опухолевые клетки в культуре в течение нескольких часов (Schön and Wadsö 1988).[48] Вместо подхода с закрытыми ампулами использовалась установка IMC, которая позволяла вводить лекарство в перемешиваемые образцы.
По состоянию на 2013 год IMC менее широко использовался в фармакодинамических исследованиях клеток млекопитающих in vitro, чем в микробных исследованиях.
Многоклеточные организмы
Можно использовать IMC для проведения метаболических исследований живых многоклеточных организмов - если они достаточно малы, чтобы их можно было поместить в ампулы IMC (Lamprecht & Becker 1988).[49] Были проведены исследования IMC метаболизма куколки насекомых во время дыхательных движений (Harak et al. 1996).[50] и влияние химических агентов на рост куколок (Kuusik et al. 1995).[51] IMC также оказался эффективным в оценке влияния старения на метаболизм нематодных червей (Braekman et al. 2002).[52]
IMC также оказался весьма полезным для in vitro оценки воздействия фармацевтических препаратов на тропических паразитических червей (Manneck et al. 2011-1,[53] Maneck et al. 2011-2,[9] Кирххофер и др. 2011).[54] Интересной особенностью этих исследований является использование простой ручной системы инъекций для введения фармацевтических препаратов в запечатанные ампулы, содержащие глистов. Кроме того, IMC документирует не только общее снижение метаболизма с течением времени из-за лекарств, но также общую частоту моторной активности червя и ее снижение амплитуды с течением времени, что отражается в колебаниях данных теплового потока.
Экологическая биология
Благодаря своей универсальности IMC может быть эффективным инструментом в области биологии растений и окружающей среды. В одном из ранних исследований (Hansen et al. 1989)[55] измеряли скорость метаболизма образцов ткани клона лиственницы. Скорость была предсказуемой для долгосрочных темпов роста деревьев, была согласована для образцов с данного дерева и, как было обнаружено, коррелировала с известными вариациями в долгосрочном росте клонов с разных деревьев.
Бактериальный оксалотрофный метаболизм обычен в окружающей среде, особенно в почвах. Оксалотрофные бактерии способны использовать оксалат в качестве единственного источника углерода и энергии. IMC в закрытых ампулах использовался для изучения метаболизма оксалотрофных почвенных бактерий, подвергнутых воздействию как оптимизированной среды, содержащей оксалат калия в качестве единственного источника углерода, так и модельной почвы (Bravo et al. 2011).[56] Используя оптимизированную среду, рост шести различных штаммов почвенных бактерий легко отслеживался, воспроизводился количественно и дифференцировался в течение нескольких дней. Измерение теплового потока метаболического метаболизма бактерий в модельной почве с помощью ИМС было более трудным, но была продемонстрирована проверка концепции.
Лунное молоко белый кремовый материал, найденный в пещерах. Это незатвердевающий мелкокристаллический осадок известняка, состоящий в основном из карбонатов кальция и / или магния. В его формировании могут участвовать микробы. Трудно сделать вывод о микробной активности лунного молока на основе стандартных статических химических и микроскопических анализов состава и структуры лунного молока. Для решения этой проблемы использовалась закрытая ампульная IMC (Braissant, Bindscheidler et al. 2011).[57] Было возможно определить скорость роста хемогетеротрофных микробных сообществ на лунном молоке после добавления различных источников углерода, имитирующих смеси, которые вступили бы в контакт с лунным молоком из-за таяния снега или дождя. Метаболическая активность была высокой и сравнима с таковой в некоторых почвах.
Harris et al. (2012),[58] изучение различных режимов внесения удобрений показало, что при выражении тепловыделения на единицу микробной биомассы почвы микробные сообщества при режимах органических удобрений производят меньше отходящего тепла, чем при неорганических режимах.
Наука о еде
Было показано, что IMC имеет разнообразное применение в наука о еде и технологии. Обзор (Wadsö and Galindo 2009)[59] обсуждает успешные применения в оценке дыхания при резке овощей, гибели клеток от бланширования, ферментации молока, предотвращения микробиологической порчи, термической обработки и срока хранения. Другая публикация (Галиндо и др., 2005)[60] рассматривает успешное использование IMC для мониторинга и прогнозирования изменений качества при хранении минимально обработанных фруктов и овощей.
IMC также доказала свою эффективность в проведении ферментативных анализов оротовой кислоты в молоке (Anastasi et al. 2000).[61] и яблочная кислота во фруктах, винах и других напитках, а также в косметических продуктах (Antonelli et al. 2008).[62] IMC также использовался для оценки эффективности агентов против потемнения на свежесрезанном картофеле (Rocculi et al. 2007).[63] IMC также доказала свою эффективность в оценке степени, в которой импульсные электрические поля низкой энергии (PEF) влияют на тепло прорастание семян ячменя, что важно в связи с их использованием в производстве солодовых напитков (Dymek et al. 2012).[64]
Смотрите также
- Калориметрия
- Химическая термодинамика
- Дифференциальная сканирующая калориметрия
- Изотермическая калориметрия титрования
- Уравнение оценки
- Термоэлектрический эффект
Библиография
- Harris, JA; Ритц, К; Coucheney, E; Грайс, С.М. Лерх, Т.З .; Полетт, М; Херрманн, AM (2012). «Термодинамическая эффективность почвенных микробных сообществ, подверженных длительному стрессу, ниже, чем при обычных режимах ввода». Биология и биохимия почвы. 47: 149–157. Дои:10.1016 / j.soilbio.2011.12.017.
- Glasstone S, Laidler KJ, Eyring H (1941) Теория скоростных процессов: кинетика химических реакций, вязкость, диффузия и электрохимические явления. Макгроу-Хилл (Нью-Йорк). 611стр.
- Джонсон Ф. Х., Эйринг Х, Стовер Б. Дж. (1974) Теория скоростных процессов в биологии и медицине. Wiley (Нью-Йорк), ISBN 0-471-44485-5, 703с.
- Лавуазье А и Лаплас PS (1780) Мемуар-сюр-ла-Шалёр. Академия наук, Париж.
- Браун ME, редактор (1998) Vol. 1 Принципы и практика (691 стр.), Справочник по термическому анализу и калориметрии. Галлахер П.К. (редактор серии). Эльзевир (Лондон).
- Браун М.Э. и Галлахер П.К., Редакторы (2003) Vol. 2 Приложения к неорганическим и другим материалам (905 стр.), Справочник по термическому анализу и калориметрии. Галлахер П.К. (редактор серии). Эльзевир (Лондон). ISBN 978-0-444-82086-0
- Ченг СЖД, редактор (2002) Vol. 3 Приложения к полимерам и пластмассам (828 стр.) В Справочнике по термическому анализу и калориметрии. Галлахер П.К. (редактор серии). Эльзевир (Лондон).
- Кемп РБ, редактор (1999) Vol. 4 От макромолекул к человеку (1032 стр.), Справочник по термическому анализу и калориметрии. Галлахер П.К. (редактор серии). Эльзевир (Лондон).
- Microcalorimetry Compendium Vol. 1: Белки, биологические и биологические науки, фармацевтика (2009). TA Instruments, Inc. (Ньюкасл, Делавэр, США).
- Microcalorimetry Compendium Vol. 2: Цемент, Энергетика, Материалы, Прочее (2009). TA Instruments, Inc. (Ньюкасл, Делавэр, США).
- Запад, Великобритания; Вудрафф, WH; Браун, JH (2002). «Аллометрическое масштабирование скорости метаболизма от молекул и митохондрий до клеток и млекопитающих». PNAS. 99: 2473–2478. Bibcode:2002PNAS ... 99,2473 Вт. Дои:10.1073 / pnas.012579799. ЧВК 128563. PMID 11875197.
Рекомендации
- ^ а б Хауэлл, М; Wirz D; Daniels AU; Braissant O (ноябрь 2011 г.). «Применение микрокалориметрического метода для определения лекарственной чувствительности видов Mycobacterium». Журнал клинической микробиологии. 50 (1): 16–20. Дои:10.1128 / JCM.05556-11. ЧВК 3256699. PMID 22090404.
- ^ а б c Хардисон, А; Льюис GW; Дэниэлс AU (2003). «Определение энергий активации и совокупных скоростей экзотермических физико-химических изменений в СВМПЭ с помощью изотермической теплопроводной микрокалориметрии (IHCMC)». Биоматериалы. 24 (28): 5145–5151. Дои:10.1016 / S0142-9612 (03) 00461-7. PMID 14568431.
- ^ Wadsö, L (1968). «Разработка и испытание калориметра микрореакции» (PDF). Acta Chemica Scandinavica. 22: 927–937. Дои:10.3891 / acta.chem.scand.22-0927.
- ^ Сууркууск, Дж; Wadsö, L (1974). «Разработка и испытание усовершенствованного точного капельного калориметра для измерения теплоемкости малых образцов». J. Chem. Термодинамика. 6 (7): 667–679. Дои:10.1016/0021-9614(74)90117-7.
- ^ Сууркууск, Дж (1982). «Многоканальная система микрокалориметрии». Chem. Scr. 20: 155–163.
- ^ Thorén, SA; Сууркууск Я; Холма Б. (1989). «Эксплуатация многоканальной системы микрокалориметрии в микросубмикроваттном диапазоне: некоторые методологические аспекты». Журнал биохимических и биофизических методов. 18 (2): 149–156. Дои:10.1016 / 0165-022X (89) 90076-6. PMID 2745930.
- ^ а б c d Wadsö, I; Гольдберг, RN (2001). «Стандарты изотермической микрокалориметрии». Pure Appl. Chem. 73 (10): 1625–1639. Дои:10.1351 / pac200173101625. S2CID 44976071.
- ^ van Herwaarden S (2000) Калориметрические измерения. в: Измерение механических переменных (Webster JG, ed), стр. 17.1–17.16. CRC Press, Бока-Ратон, Флорида.
- ^ а б Маннек, Т; Braissant O; Haggenmueller Y; Кейзер Дж. (2011). «Изотермическая микрокалориметрия для изучения лекарственных средств против Schistosoma mansoni». Журнал клинической микробиологии. 49 (4): 1217–1225. Дои:10.1128 / JCM.02382-10. ЧВК 3122815. PMID 21270220.
- ^ а б Льюис, G; Дэниэлс AU (2003). «Использование изотермической микрокалориметрии теплопроводности (IHCMC) для оценки синтетических биоматериалов». J. Biomed. Материалы Res.-B. 66B (2): 487–501. CiteSeerX 10.1.1.517.6452. Дои:10.1002 / jbm.b.10044. PMID 12861599.
- ^ а б Шарлебуа, SJ; Daniels AU; Льюис Дж. (2003). «Изотермическая микрокалориметрия: аналитический метод оценки динамической химической стабильности UHMWPE». Биоматериалы. 24 (2): 91–296. Дои:10.1016 / S0142-9612 (02) 00317-4. PMID 12419630.
- ^ Gawlicki, M; Nocun-Wczelik, W; Бак, L (2010). «Калориметрия в исследованиях гидратации цемента». J Therm анальный калорим. 100 (2): 571–6. Дои:10.1007 / s10973-009-0158-5. S2CID 137241273.
- ^ Эвджу, К. (2003). «Первичная гидратация цементных систем с использованием простого изотермического калориметра и динамической коррекции». J Therm анальный калорим. 71 (3): 829–40. Дои:10.1023 / А: 1023374125778. S2CID 93452683.
- ^ Ylmen, R; Wadso, L; Панас, I (2010). «Понимание ранней гидратации портландского известнякового цемента с помощью инфракрасной спектроскопии и изотермической калориметрии». Cem Concr Res. 40 (10): 1541–6. Дои:10.1016 / j.cemconres.2010.06.008.
- ^ Xu L, Wang P, Zhang G (2011) Калориметрическое исследование влияния сульфата кальция на гидратацию смесей портландцемент-алюминат кальция. J. Термический анализ и калориметрия (опубликовано, 5 октября 2011 г.).
- ^ Дустмохаммади, А; Монши, А; Фатхи, Массачусетс; Braissant, O (2011). «Сравнительное физико-химическое исследование биоактивного стекла и гидроксиапатита костного происхождения». Керамика Интернэшнл. 37 (5): 1601–1607. Дои:10.1016 / j.ceramint.2011.03.009.
- ^ Уилсон, Р.Дж.; Beezer, AE; Mitchell, JC; Ло, В. (1995). «Определение термодинамических и кинетических параметров из изотермической микрокалориметрии теплопроводности: приложения к долгосрочным исследованиям реакций». J. Phys. Chem. 99 (18): 7108–7113. Дои:10.1021 / j100018a051.
- ^ Пикал, MJ; Деллерман, К.М. (1989). «Тестирование стабильности фармацевтических препаратов с помощью высокочувствительной изотермической калориметрии при 25 ° C: цефалоспорины в твердом и водном растворах». Int J Pharmacol. 50 (3): 233–252. Дои:10.1016/0378-5173(89)90127-0.
- ^ Hansen, LD; Ешьте, ди-джей; Льюис, EA; Bergstrom, RG; Деграфт-Джонсон, Д; Кэссиди-Томпсон, К. (1990). «Прогнозирование срока годности на основе калориметрических измерений в индукционном периоде материалов, подвергающихся автокаталитическому разложению». Канадский химический журнал. 68 (11): 2111–2114. Дои:10.1139 / v90-321.
- ^ Кенигбауэр, MJ; Brooks SH; Rullo G; Диван РА (1992). «Твердотельное испытание стабильности лекарственных средств методом изотермической калориметрии». Фармацевтические исследования. 9 (7): 933–44. Дои:10.1023 / а: 1015865319250. PMID 1438010. S2CID 12884493.
- ^ Вивода, М; Роскар, Р; Kmetec, V (2011). «Разработка быстрого метода определения аморфности методом изотермической микрокалориметрии». J Therm анальный калорим. 105 (3): 1023–1030. Дои:10.1007 / s10973-011-1443-7. S2CID 95028157.
- ^ Чен, Джей-Р; Wu, S-H; Lin, S-Y; Hou, HY; Шу, C-M (2008). «Использование микрокалориметрии для оценки возможности быстрого разложения гидропероксида кумола при низких температурах». J Therm анальный калорим. 93 (1): 127–133. Дои:10.1007 / s10973-007-8834-9. S2CID 96305303.
- ^ Монти, М. (1990). «Применение микрокалориметрии для изучения живых клеток в области медицины». Термохимика Акта. 172: 53–60. Дои:10.1016 / 0040-6031 (90) 80558-г.
- ^ Муриганде, C; Regenass S; Wirz D; Daniels AU; Тиндаль А. (2009). «Сравнение между включением (3H) -тимидина и изотермической микрокалориметрией для оценки антиген-индуцированной пролиферации лимфоцитов». Иммунологические исследования. 38 (1): 67–75. Дои:10.1080/08820130802572160. PMID 19172486. S2CID 38795681.
- ^ Санторо, Р. Braissant O; Мюллер Б; Wirz D; Дэниелс А.У .; Мартин I; Вендт Д. (2011). «Измерения в реальном времени производства тепла хондроцитами человека во время пролиферации in vitro». Биотехнологии и биоинженерия. 108 (12): 3019–3024. Дои:10.1002 / бит. 23268. PMID 21769860. S2CID 19299843.
- ^ Шарлебуа, SJ; Daniels AU; Смит Р.А. (2002). «Метаболическое производство тепла как мера реакции макрофагов на частицы из материалов ортопедических имплантатов». Журнал исследований биомедицинских материалов. 59 (1): 166–175. Дои:10.1002 / jbm.1230. PMID 11745550.
- ^ Бекман, П. (1990). «Влияние экспериментальных факторов на скорость метаболизма клеток t-лимфомы, измеренную с помощью микрокалориметрии». Термохимика Акта. 172 (1): 123–130. Дои:10.1016 / 0040-6031 (90) 80566-ч.
- ^ Каллерхофф, М; Карнебоген М; Певица D; Dettenbaeh A; Gralher U; Рингерт Р. Х. (1996). «Микрокалориметрические измерения, проведенные на изолированных образцах опухолевой и неопухолевой ткани из органов урогенитального тракта по сравнению с гистологическими и импульсно-цитофотометрическими исследованиями». Урологическое исследование. 24 (2): 83–91. Дои:10.1007 / bf00431084. PMID 8740977. S2CID 35744559.
- ^ Анкерст, Дж; Sjögren, HO; Fäldt, R (1986). «Использование микрокалориметрии в анализе кинетики ADCC». Журнал иммунологических методов исследования. 88 (2): 259–264. Дои:10.1016/0022-1759(86)90014-1. PMID 3958501.
- ^ Торен, С.А. (1992). «Калориметрия: новый количественный метод in vitro в клеточной токсикологии. Изучение дозы / эффекта альвеолярных макрофагов, подвергшихся воздействию частиц». J Toxicol Environ Health. 36 (4): 307–18. Дои:10.1080/15287399209531641. PMID 1507265.
- ^ Liu, W .; Chaspoul, F .; Berge Lefranc, D .; Decome, L .; Галлис, П. (12 июля 2007 г.). «Микрокалориметрия как инструмент для оценки токсичности Cr (VI) фибробластов кожи человека». Журнал термического анализа и калориметрии. 89 (1): 21–24. Дои:10.1007 / s10973-006-7918-2. S2CID 96774590.
- ^ Се, Y; Depierre JW; Нессбергер Л.Н. (2000). «Биосовместимость микропланшетов для культивирования эпителиальных почечных клеток оценивается микрокалориметрическим методом». Журнал материаловедения: материалы в медицине. 11 (9): 587–591. Дои:10.1023 / А: 1008984304821. PMID 15348389. S2CID 25818381.
- ^ Дустмохаммади, А; Монши А; Fathi MH; Karbasi S; Braissant O; Дэниелс AU (2011). «Прямая оценка цитотоксичности биоактивного стекла 63S и частиц гидроксиапатита костного происхождения с использованием модели дрожжей и клеток хондроцитов человека с помощью микрокалориметрии». Журнал материаловедения: материалы в медицине. 22 (10): 2293–2300. Дои:10.1007 / с10856-011-4400-х. PMID 21786131. S2CID 25271308.
- ^ Джесперсен Н.Д. (1982) Биохимические и клинические применения термометрического и термического анализа. Научное издательство Эльзевир, Амстердам.
- ^ Heng, Z .; Congyi, Z .; Cunxin, W .; Jibin, W .; Chaojiang, G .; Jie, L .; Ювен, Л. (январь 2005 г.). «Микрокалориметрическое исследование вирусной инфекции; влияние гипертермии и рекомбинантного гомо-интерферона 1b на процесс инфицирования клеток BHK-21 вирусом ящура». Журнал термического анализа и калориметрии. 79 (1): 45–50. Дои:10.1007 / s10973-004-0560-у. S2CID 98578017.
- ^ Antoce, O-A; Antocie, V; Такахаши, К. Pomohaci, N; Намолосану, I (1997). «Калориметрическое определение ингибирующего действия н-спиртов C1-C4 на рост некоторых видов дрожжей». Термохимика Акта. 297 (1–2): 33–42. Дои:10.1016 / s0040-6031 (97) 00162-7.
- ^ а б Braissant, O .; Wirz, D .; Gopfert, B .; Дэниелс, А. У. (2010). «Использование изотермической микрокалориметрии для мониторинга микробной активности». FEMS Microbiol. Латыш. 303 (1): 1–8. Дои:10.1111 / j.1574-6968.2009.01819.x. PMID 19895644.
- ^ Трампуз, А; Salzmann S; Antheaume J; Дэниелс AU (2007). «Микрокалориметрия: новый метод обнаружения микробного загрязнения в продуктах тромбоцитов». Переливание. 47 (9): 1643–1650. Дои:10.1111 / j.1537-2995.2007.01336.x. PMID 17725729. S2CID 21221691.
- ^ Бонкат, G; Braissant O; Видмер А.Ф .; Frei R; Rieken M; Wyler S; Гассер ТЦ; Wirz D; Daniels AU; Бахманн А (2011). «Быстрое обнаружение возбудителей заболеваний мочевыводящих путей с помощью микрокалориметрии: принцип, методика и первые результаты». Британский журнал урологии International. 110 (6): 892–897. Дои:10.1111 / j.1464-410X.2011.10902.x. PMID 22313675. S2CID 34620719.
- ^ Braissant, O; Wirz D; Gopfert B; Дэниэлс AU (2010). «Жара идет: быстрое микрокалориметрическое обнаружение микобактерий в культуре». Туберкулез (Edinb). 90 (1): 57–59. Дои:10.1016 / j.tube.2009.11.001. PMID 19969505.
- ^ Родригес, Д; Daniels AU; Urrusti JL; Wirz D; Braissant O (октябрь 2011 г.). «Оценка недорогого калориметрического подхода для быстрого обнаружения туберкулеза и других микобактерий в культуре». Журнал прикладной микробиологии. 111 (4): 1016–1024. Дои:10.1111 / j.1365-2672.2011.05117.x. PMID 21797951. S2CID 205324227.
- ^ а б Braissant, O; Бонкат, G; Вирц, Д. (2013). «Рост микробов и изотермическая микрокалориметрия: модели роста и их применение к микрокалориметрическим данным». Термохимика Акта. 555: 64–71. Дои:10.1016 / j.tca.2012.12.005.
- ^ фон А, У; Wirz D; Дэниэлс AU (2009). «Изотермическая микрокалориметрия - новый метод определения МИК: результаты для 12 антибиотиков и эталонных штаммов E. coli и S. aureus». BMC Microbiol. 9 (1): 106. Дои:10.1186/1471-2180-9-106. ЧВК 2692853. PMID 19470161.
- ^ фон А, У; Wirz D; Дэниелс AU (2008). «Быстрая дифференциация метициллин-чувствительного Staphylococcus aureus от метициллин-резистентного S. aureus и определение МИК с помощью изотермической микрокалориметрии». J Clin Microbiol. 46 (6): 2083–7. Дои:10.1128 / JCM.00611-08. ЧВК 2446841. PMID 18417657.
- ^ Baldoni, D; Hermann H; Frei R; Trampuz A; Штейнхубер А (2009). «Проведение микрокалориметрии для раннего выявления устойчивости к метициллину у клинических изолятов Staphylococcus aureus». J Clin Microbiol. 47 (3): 774–776. Дои:10.1128 / JCM.02374-08. ЧВК 2650961. PMID 19158262.
- ^ Астасов-Фрауэнхоффер, М; Braissant O; Хаузер-Гершпах I; Daniels AU; Wirz D; Weiger R; Валтимо Т (2011). «Количественное определение жизнеспособных прилипших клеток Streptococcus sanguinis на покрытом белком титане после обработки дезинфицирующим средством» (PDF). Журнал материаловедения: материалы в медицине. 22 (9): 2045–2051. Дои:10.1007 / s10856-011-4377-5. PMID 21670995. S2CID 11255313.
- ^ Hauser-Gerspach, I; Scandiucci de Freitas P; Daniels AU; Мейер Дж (2008). «Адгезия Streptococcus sanguinis к стеклянным поверхностям, измеренная с помощью изотермической микрокалориметрии (IMC)». J Biomed Mater Res B. 85 (1): 42–9. Дои:10.1002 / jbm.b.30914. PMID 17696148.
- ^ Schön, Wadsö I (1988). «Возможности использования микрокалориметрии в прогностических тестах действия противоопухолевых препаратов на клетки млекопитающих». Cytobios. 55 (220): 33–39. PMID 3265371.
- ^ Лампрехт, I; Беккер, В. (1988). «Комбинация калориметрии и эндоскопии для контроля двигательной активности мелких животных». Термохимика Акта. 130: 87–93. Дои:10.1016/0040-6031(88)87053-9.
- ^ Харак, М; Лампрехт, I; Куусик, А (1996). «Метаболическая стоимость дыхательных движений у куколок Tenebrio molitor и Galleria mellonella изучена методом прямой калориметрии». Термохимика Акта. 276: 41–47. Дои:10.1016/0040-6031(95)02750-5.
- ^ Куусик, А; Харак, М; Hiiesaar, K; Мецпалу, L; Tartes, U (1995). «Исследования регуляции роста насекомых (IGR) и токсического воздействия экстрактов Ledum palustre на куколки Tenebrio molitor (Coleoptera, Tenebrionidae) с использованием калориметрических записей». Термохимика Акта. 251: 247–253. Дои:10.1016 / 0040-6031 (94) 02048-с.
- ^ Braeckman, BP; Houthoofd K; De Vreese A; Ванфлетерен JR (2002). «Анализ метаболической активности при старении Caenorhabditis elegans». Механизмы старения и развития. 123 (2002): 105–119. Дои:10.1016 / S0047-6374 (01) 00331-1. PMID 11718805. S2CID 26024344.
- ^ Маннек, Т; Braissant O; Эллис В; Кейзер Дж. (2011). «Schistosoma mansoni: антишистосомная активность четырех оптических изомеров и двух рацематов мефлохина на шистосомулах и взрослых червях in vitro и in vivo». Экспериментальная паразитология. 127 (1): 260–269. Дои:10.1016 / j.exppara.2010.08.011. PMID 20732321.
- ^ Кирххофер, К; Варгас М; Braissant O; Dong Y; Ван Х; Vennerstrom JL; Кейзер Дж. (2011). «Активность аналогов OZ78 против Fasciola hepatica и Echinostoma caproni». Acta Tropica. 118 (1): 56–62. Дои:10.1016 / j.actatropica.2011.02.003. ЧВК 3066657. PMID 21316331.
- ^ Hansen, LD; Льюис, EA; Ешьте, ди-джей; Фаулер, Д.П .; Criddle, RS (1989). «Прогнозирование долгосрочных темпов роста клонов лиственницы путем калориметрического измерения скорости метаболического тепла». Канадский журнал исследований леса. 19 (5): 606–611. Дои:10.1139 / x89-095.
- ^ Браво, Д; Braissant O; Солохина А; Clerc M; Daniels AU; Verrecchia E; Джунье П. (2011). «Использование изотермического микрокалориметрического анализа для характеристики микробной оксалотрофной активности». FEMS Microbiology Ecology. 78 (2): 266–74. Дои:10.1111 / j.1574-6941.2011.01158.x. PMID 21696406.
- ^ Braissant O, Bindschedler S, Daniels AU, Verrecchia EP & Cailleau C (2011) «Микробиологическая активность в лунном молоке, контролируемая с помощью изотермической микрокалориметрии (пещера« Vers chez le Brandt », Невшатель, Швейцария)». Журнал пещерных и карстовых исследований (принят 05/2011).
- ^ Harris, JA; Ритц, К; Coucheney, E; Грайс, С.М. Лерх, Т.З .; Полетт, М; Херрманн, AM (2012). «Термодинамическая эффективность почвенных микробных сообществ, подверженных длительному стрессу, ниже, чем при обычных режимах ввода». Биология и биохимия почвы. 47: 149–157. Дои:10.1016 / j.soilbio.2011.12.017.
- ^ Wadsö, L; Гомес Галиндо, Ф (2009). «Изотермическая калориметрия для биологических применений в пищевой науке и технологиях». Контроль пищевых продуктов. 20 (10): 956–961. Дои:10.1016 / j.foodcont.2008.11.008.
- ^ Гомес Галиндо, ф .; Rocculi, P; Wadsö, L; Sjöholm, I (2005). «Возможности изотермической калориметрии в мониторинге и прогнозировании изменений качества во время обработки и хранения минимально обработанных фруктов и овощей». Тенденции Food Sci Technol. 16 (8): 325–331. Дои:10.1016 / j.tifs.2005.01.008.
- ^ Анастаси, G; Антонелли ML; Бионди Б; Винчи Г. (2000). «Оротовая кислота: компонент молока. Ферментативное определение с помощью нового микрокалориметрического метода». Таланта. 52 (5): 947–952. Дои:10.1016 / S0039-9140 (00) 00433-1. PMID 18968055.
- ^ Антонелли, ML; Spadaro C; Торнелли РФ (2008). «Микрокалориметрический сенсор для пищевых и косметических анализов: определение L-яблочной кислоты». Таланта. 74 (5): 1450–1454. Дои:10.1016 / j.talanta.2007.09.035. PMID 18371803.
- ^ Rocculi, P; Гомес Галиндо, ф .; Mendozac, F; Wadsö, L; Romani, S; Далла Роза, М; Sjöholm, I (2007). «Влияние применения веществ против потемнения на метаболическую активность и сахарный состав свежесрезанного картофеля». Послеуборочная биология и технология. 43: 151–157. Дои:10.1016 / j.postharvbio.2006.08.002.
- ^ Димек К., Деймек П., Панарезе В., Висенте А.А., Вадсё Л., Финни С., Гомес Галиндо Ф. (2012) Влияние импульсного электрического поля на прорастание семян ячменя. LWT - Пищевая наука и технология (принято 12/2011).
внешняя ссылка
- Некоторые источники инструментов, принадлежностей, расходных материалов и программного обеспечения IMC
- Calmetrix
- Инструменты ТА
- Сетарам
- Симсель
- Конфигурации проточного адсорбционного микрокалориметра Microscal Ltd (заархивировано 2005 г.)
