Мевастатин - Mevastatin
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.131.541 |
| Химические и физические данные | |
| Формула | C23ЧАС34О5 |
| Молярная масса | 390.520 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Мевастатин (компактин, МЛ-236Б) это гиполипидемический агент что принадлежит статины учебный класс.
Он был изолирован от плесени Penicillium citrinum к Акира Эндо в 1970-х годах, и он определил это как Ингибитор HMG-CoA редуктазы,[1] то есть статин. Мевастатин можно считать первым статиновым препаратом;[2] Клинические испытания мевастатина проводились в конце 1970-х годов в Японии, но он так и не поступил в продажу.[3] Первым статином, доступным широкой публике, был ловастатин.
С тех пор мевастатин был преобразован в соединение правастатин, который является фармацевтическим средством, используемым для снижения холестерин и предотвращение сердечно-сосудистые заболевания.
В пробирке, обладает антипролиферативными свойствами.[4]
Британская группа выделила такое же соединение из Penicillium brevicompactum, назвал это компактини опубликовали свои результаты в 1976 г.[5] Британская группа упоминает противогрибковые свойства без упоминания ингибирования HMG-CoA редуктазы.
Высокие дозы подавляют рост и распространение меланома клетки.[6]
Биосинтез

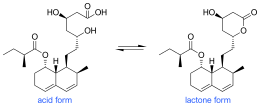
Биосинтез мевастатина в основном осуществляется через Путь ПКС он проходит по пути PKS, как показано на рисунке 1, пока не достигнет гексакетидного состояния, в котором он подвергается Дильс-Альдер циклизация. После циклизации он продолжает путь PKS к нонакетиду, после чего высвобождается и подвергается окислению и дегидратации. Предполагается, что окисление происходит с помощью полипептида, аналогичного монооксигеназе цитохрома p450, который кодируется mlcC в гене мевастатина. Наконец, биосинтез завершается PKS, способствующим добавлению боковой цепи дикетида и метилированию посредством СЭМ.[7] На рисунке 1 показан мевастатин в его кислотной форме, но он также может быть в более часто встречающейся форме лактона. Этот путь был впервые обнаружен в Penicillium cilrinum и позже было обнаружено, что другой тип грибка, Penicillium brevicompaetum также продуцировал мевастатин по пути PKS.
Фармакология
Устойчивое повышение уровня холестерина в крови увеличивает риск сердечно-сосудистых заболеваний. Мевастатин снижает выработку холестерина печенью путем конкурентного ингибирования HMG-CoA редуктазы, фермента, который катализирует лимитирующую стадию пути биосинтеза холестерина через путь мевалоновой кислоты. Когда уровень холестерина в печени снижается, это вызывает повышенное поглощение холестерина липопротеинов низкой плотности (ЛПНП) и снижает уровень холестерина в кровотоке.[8] Также было показано, что мевастатин активирует эндотелиальная синтаза оксида азота (eNOS), который необходим для поддержания здоровья сердечно-сосудистой системы.[9]
Смотрите также
Рекомендации
- ^ Эндо А., Курода М., Цудзита Ю. (декабрь 1976 г.). «ML-236A, ML-236B и ML-236C, новые ингибиторы холестерогенеза, продуцируемые Penicillium citrinium». Журнал антибиотиков. 29 (12): 1346–8. Дои:10.7164 / антибиотики.29.1346. PMID 1010803.
- ^ «История статинов». Архивировано из оригинал 21 декабря 2008 г.
- ^ Эндо А (октябрь 2004 г.). «Происхождение статинов. 2004». Атеросклероз. Добавки. 5 (3): 125–30. Дои:10.1016 / j.atherosclerosissup.2004.08.033. PMID 15531285.
- ^ Wächtershäuser A, Akoglu B, Stein J (июль 2001 г.). «Ингибитор HMG-CoA редуктазы мевастатин усиливает ингибирующее действие бутирата на рост клеточной линии колоректальной карциномы Caco-2». Канцерогенез. 22 (7): 1061–7. Дои:10.1093 / carcin / 22.7.1061. PMID 11408350.
- ^ Браун А.Г., Смейл Т.С., Кинг Т.Дж., Хасенкамп Р., Томпсон Р.Х. (1976). «Кристаллическая и молекулярная структура компактина, нового противогрибкового метаболита Penicillium brevicompactum». Журнал химического общества. Перкин транзакции 1 (11): 1165–70. Дои:10.1039 / P19760001165. PMID 945291.
- ^ Глинн С.А., О'Салливан Д., Юстас А.Дж., Клайнс М., О'Донован Н. (январь 2008 г.). «Ингибиторы 3-гидрокси-3-метилглутарил-коэнзима А редуктазы, симвастатин, ловастатин и мевастатин ингибируют пролиферацию и инвазию клеток меланомы». BMC Рак. 8: 9. Дои:10.1186/1471-2407-8-9. ЧВК 2253545. PMID 18199328.
- ^ а б Абэ Й, Сузуки Т., Оно С., Ивамото К., Хособути М., Йошикава Х. (июль 2002 г.). «Молекулярное клонирование и характеристика кластера биосинтетических генов ML-236B (компактин) в Penicillium citrinum». Молекулярная генетика и геномика. 267 (5): 636–46. Дои:10.1007 / s00438-002-0697-y. PMID 12172803.
- ^ «Мевастатин». PubChem. Национальная медицинская библиотека США. Получено 2016-06-04.
- ^ Amin-Hanjani S, Stagliano NE, Yamada M, Huang PL, Liao JK, Moskowitz MA (апрель 2001 г.). «Мевастатин, ингибитор HMG-CoA-редуктазы, снижает повреждение от инсульта и активирует эндотелиальную синтазу оксида азота у мышей». Гладить. 32 (4): 980–6. Дои:10.1161 / 01.STR.32.4.980. PMID 11283400.
