Нокаут-мышь - Википедия - Knockout mouse
А нокаутирующая мышь, или же выбивающая мышь, это генетически модифицированная мышь (Mus musculus), в которых исследователи инактивировали, или "выбит ", существующий ген заменив его или разрушив искусственным ДНК. Они важны животные модели для изучения роли генов, которые были последовательный но чьи функции не определены. Вызывая у мыши неактивность определенного гена и наблюдая любые отличия от нормального поведения или физиологии, исследователи могут сделать вывод о его вероятной функции.
Мыши в настоящее время виды лабораторных животных наиболее тесно связан с люди для которых легко применима техника нокаута. Они широко используются в экспериментах с нокаутом, особенно при исследовании генетических вопросов, связанных с физиология человека. Джин нокаут в крысы намного сложнее и стало возможным только с 2003 года.[1][2]
Первая зарегистрированная мышь с нокаутом была создана Марио Р. Капеччи, Мартин Эванс, и Оливер Смитис в 1989 г., за что были награждены премией 2007 г. Нобелевская премия в физиологии или медицине. Аспекты технологии создания мышей-нокаутов и самих мышей были запатентованный во многих странах частными компаниями.
Использовать

Выключение активности гена дает информацию о том, что этот ген обычно делает. У людей много общих генов с мышами. Следовательно, наблюдение за характеристиками мышей с нокаутом дает исследователям информацию, которая может быть использована для лучшего понимания того, как подобный ген может вызывать или способствовать заболеванию у людей.
Примеры исследований, в которых мыши-нокауты были полезны, включают изучение и моделирование различных видов рак, ожирение, сердечное заболевание, сахарный диабет, артрит, злоупотребление алкоголем или наркотиками, беспокойство, старение и болезнь Паркинсона. Нокаут-мыши также представляют собой биологический и научный контекст, в котором могут быть разработаны и испытаны лекарства и другие методы лечения.
Ежегодно в экспериментах используются миллионы мышей с нокаутом.[3]
Штаммы

Существует несколько тысяч различных линий нокаутных мышей.[3]Многие модели мышей названы в честь гена, который был инактивирован. Например, p53 нокаут-мышь названа в честь ген p53 который кодирует белок, который обычно подавляет рост опухолей, останавливая деление клеток и / или индуцирование апоптоза. Люди, рожденные с мутациями, деактивирующими ген p53, страдают от Синдром Ли-Фраумени, состояние, которое резко увеличивает риск развития рака костей, рак молочной железы и рак крови в раннем возрасте. Другие модели мышей названы в соответствии с их физическими характеристиками или поведением.
Процедура
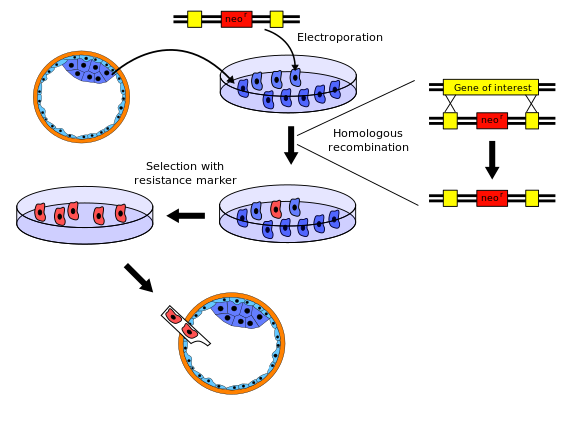

Существует несколько вариантов процедуры получения мышей с нокаутом; Ниже приводится типичный пример.
- Ген, который нужно выбить, изолирован от мыши. библиотека генов. Затем новый Последовательность ДНК разработан, который очень похож на исходный ген и его ближайшую соседнюю последовательность, за исключением того, что он достаточно изменен, чтобы сделать ген неработоспособным. Обычно новой последовательности также присваивается маркерный ген, ген, которого нет у нормальных мышей и который придает устойчивость к определенному токсическому агенту (например, неомицину) или вызывает наблюдаемые изменения (например, цвет или флуоресценцию). Кроме того, второй ген, такой как tk + герпеса, также включен в конструкцию для выполнения полного отбора.
- Эмбриональные стволовые клетки изолированы от мыши бластоциста (очень молодой эмбрион ) и выросли in vitro. Для этого примера мы возьмем стволовые клетки от белой мыши.
- Новая последовательность из шага 1 вводится в стволовые клетки из шага 2 путем электропорация. Естественным процессом гомологичная рекомбинация некоторые из электропорированных стволовых клеток будут включать новую последовательность с выключенным геном в свои хромосомы вместо исходного гена. Шансы на успешное событие рекомбинации относительно низки, поэтому большинство измененных клеток будет иметь новую последовательность только в одной из двух соответствующих хромосом - они, как говорят, гетерозиготный. Клетки, трансформированные вектором, содержащим ген устойчивости к неомицину и ген герпеса tk +, выращивают в растворе, содержащем неомицин и ганцикловир, для отбора трансформаций, произошедших посредством гомологичной рекомбинации. Любая вставка ДНК, которая произошла путем случайной вставки, погибнет, потому что они дают положительный результат как на ген устойчивости к неомицину, так и на ген герпеса tk +, продукт гена которого реагирует с ганцикловиром с образованием смертельного токсина. Более того, клетки, которые не интегрируют какой-либо генетический материал, дают отрицательный результат на оба гена и поэтому погибают в результате отравления неомицином.
- Эмбриональные стволовые клетки, в которые включен нокаутированный ген, выделяют из неизмененных клеток с использованием маркерного гена со стадии 1. Например, неизмененные клетки могут быть уничтожены с использованием токсичного агента, к которому измененные клетки устойчивы.
- Нокаутированные эмбриональные стволовые клетки с шага 4 вставляются в мышь. бластоциста. В этом примере мы используем бластоцисты серой мыши. Бластоцисты теперь содержат два типа стволовых клеток: исходные (от серой мыши) и нокаутированные клетки (от белой мыши). Эти бластоцисты затем имплантируются в матка самок мышей, где они развиваются. Таким образом, новорожденные мыши будут химеры: некоторые части их тел являются результатом исходных стволовых клеток, другие части - нокаутированными стволовыми клетками. На их мехе будут пятна белого и серого цвета, с белыми пятнами, полученными от нокаутированных стволовых клеток, и серыми пятнами от бластоцисты реципиента.
- Некоторые из новорожденных мышей-химер будут иметь гонады происходит из нокаутированных стволовых клеток и, следовательно, будет производить яйцеклетки или сперматозоиды, содержащие нокаутный ген. Когда этих химерных мышей скрещивают с другими мышами дикого типа, некоторые из их потомков будут иметь одну копию нокаутированного гена во всех их клетках. Эти мыши будут полностью белыми и не химерными, но все же гетерозиготными.
- Когда эти гетерозиготные потомки скрещиваются, некоторые из их потомков унаследуют нокаутированный ген от обоих родителей; они не несут функциональную копию исходного неизмененного гена (т.е. они гомозиготный для этого аллеля).
Подробное объяснение того, как создаются нокаутные (KO) мыши, находится на сайте Нобелевская премия по физиологии и медицине 2007.[4]
Ограничения
Национальный институт здоровья обсуждает некоторые важные ограничения этого метода.[5]
Хотя технология нокаутирующих мышей представляет собой ценный исследовательский инструмент, существуют некоторые важные ограничения. Около 15 процентов нокаутов генов приводят к летальному исходу, а это означает, что генетически измененные эмбрионы не могут вырасти во взрослых мышей. Эта проблема часто решается с помощью условные мутации. Отсутствие взрослых мышей ограничивает исследования эмбриональное развитие и часто затрудняет определение функции гена по отношению к человеческое здоровье. В некоторых случаях ген может выполнять иную функцию у взрослых, чем у развивающихся эмбрионов.
Нокаут гена также может не вызвать заметных изменений у мыши или может даже дать характеристики, отличные от тех, которые наблюдаются у людей, у которых тот же ген инактивирован. Например, мутации в гене p53 связаны с более чем половиной случаев рака человека и часто приводят к опухолям в определенном наборе тканей. Однако, когда ген p53 отключен у мышей, у животных развиваются опухоли в другом массиве тканей.
Процедура варьируется в зависимости от штамма, из которого получены стволовые клетки. Обычно используются клетки, полученные из штамма 129. Этот специфический штамм не подходит для многих экспериментов (например, поведенческих), поэтому очень часто обратное скрещивание потомство других штаммов. Было доказано, что некоторые геномные локусы очень трудно выбить. Причиной может быть наличие повторяющихся последовательностей, обширных Метилирование ДНК, или же гетерохроматин. Смешивающее присутствие соседних 129 генов в нокаутном сегменте генетического материала было названо «эффектом фланкирующего гена».[6] Предложены методы и рекомендации по решению этой проблемы.[7][8]
Другое ограничение заключается в том, что обычные (т.е. не условные) мыши с нокаутом развиваются в отсутствие исследуемого гена. Иногда потеря активности во время развития может маскировать роль гена во взрослом состоянии, особенно если ген участвует во многих процессах, охватывающих развитие. Затем требуются подходы к условной / индуцибельной мутации, которые сначала позволяют мыши нормально развиваться и созревать до удаления интересующего гена.
Еще одно серьезное ограничение - это отсутствие эволюционных адаптаций в модели нокаута, которые могут возникнуть у животных дикого типа после того, как они естественным образом мутируют. Например, эритроцит-специфическая коэкспрессия GLUT1 с стоматин представляет собой компенсаторный механизм у млекопитающих, которые не могут синтезировать Витамин С.[9]
Смотрите также
- Химера (генетика)
- Генетически модифицированный организм
- Генетика
- Humouse
- Международный консорциум Knockout Mouse
- Международный консорциум по фенотипированию мышей
- Нокаутный мох
- Oncomouse
Рекомендации
- ^ Pilcher HR (19 мая 2003 г.). "Это нокаут". Природа. Дои:10.1038 / news030512-17. Получено 2014-04-03.
- ^ Зан Й, Хааг Дж. Д., Чен К. С., Шепель Л. А., Вигингтон Д., Ван Ю. Р., Ху Р., Лопес-Гуахардо С. К., Брозе Х. Л., Портер К. И., Леонард Р. А., Хитт А. А., Шоммер С. Л., Элегбеде А.Ф., Гулд Миннесота (июнь 2003 г.) . «Производство нокаутных крыс с использованием мутагенеза ENU и дрожжевого скринингового анализа». Природа Биотехнологии. 21 (6): 645–51. Дои:10.1038 / nbt830. PMID 12754522.
- ^ а б Спенсер Дж. (Декабрь 2002 г.). «Предыстория мыши как модельного организма». Национальный институт исследования генома человека. Получено 2014-04-03.
- ^ «Нобелевская премия по физиологии и медицине 2007 г.». Nobelprize.org. 1985-09-19. Получено 2014-04-03.
- ^ "Информационный бюллетень о мышах-нокаутах". Национальный институт исследования генома человека. Август 2015 г.. Получено 2014-04-03.
- ^ Герлай Р. (май 1996 г.). «Генетические исследования поведения млекопитающих: мутация или фоновый генотип?». Тенденции в неврологии. 19 (5): 177–81. Дои:10.1016 / S0166-2236 (96) 20020-7. PMID 8723200.
- ^ Вольфер Д.П., Crusio WE, Lipp HP (июль 2002 г.). «Нокаут-мыши: простые решения проблем генетического фона и фланкирующих генов». Тенденции в неврологии. 25 (7): 336–40. Дои:10.1016 / S0166-2236 (02) 02192-6. PMID 12079755.
- ^ Крузио В.Е., Голдовиц Д., Холмс А., Вулфер Д. (февраль 2009 г.). «Стандарты публикации исследований мутантных мышей». Гены, мозг и поведение. 8 (1): 1–4. Дои:10.1111 / j.1601-183X.2008.00438.x. PMID 18778401.
- ^ Montel-Hagen A, Kinet S, Manel N, Mongellaz C, Prohaska R, Battini JL, Delaunay J, Sitbon M, Taylor N (март 2008 г.). «Эритроцит Glut1 запускает поглощение дегидроаскорбиновой кислоты у млекопитающих, неспособных синтезировать витамин С». Клетка. 132 (6): 1039–48. Дои:10.1016 / j.cell.2008.01.042. PMID 18358815.
внешняя ссылка
| Библиотечные ресурсы о Нокаутирующая мышь |
- Техасский институт геномной медицины A&M (TIGM) - Сайт для заказа ES-клеток и мышей, созданных TIGM
- Создание нокаут-мышей для нацеливания на вектор из исследования нокаут-мышей (KMR) - Веб-сайт для заказа эмбриональных стволовых клеток, нацеленных векторов и трансгенных мышей, созданных с помощью KMR.
- Изучение функции гена: создание мышей-нокаутов - обзор журнала Science Creative Quarterly
- Сайт координации данных проекта Knock Out Mouse (KOMP) - Открытый интерфейс для информации о статусе генов, включенных в инициативу KOMP.
- Веб-сайт репозитория проекта Knock Out Mouse (КОМП) - Сайт для заказа ЭС клеток, векторов и мышей, созданных в рамках проекта КОМП
- Веб-сайт информатики генома мышей (MGI) - база данных сообщества модельных организмов лабораторной мыши
- Метод гомологичной рекомбинации (и нокаут-мышь)
- Информационный бюллетень о мышах-нокаутах (Genome.gov)
