Реакция Макфадьена – Стивенса - McFadyen–Stevens reaction
В Реакция Макфадьена – Стивенса это химическая реакция лучше всего описывается как катализируемое основанием термическое разложение ацилсульфонилгидразидов до альдегиды.[1][2]

Дудман и другие. разработали альтернативный гидразидный реагент.[3]
Механизм реакции
Механизм реакции Макфадьена – Стивенса все еще исследуется. Две группы независимо предложили механизм гетеролитической фрагментации.[4][5] Механизм включает депротонирование ацилсульфонамида с последующей миграцией 1,2-гидрида с образованием алкоксида (3). Распад алкоксида приводит к фрагментации с образованием желаемого альдегида (4), газообразный азот, и арилсульфинат-ион (5).
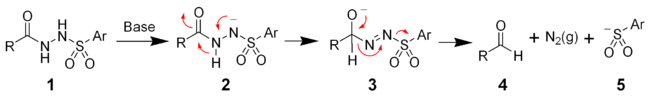
Мартин и другие. предложили другой механизм, включающий ацил нитрен.[6]
Смотрите также
использованная литература
- ^ McFadyen, J. S .; Стивенс, Т. С. (1936). «128. Новый метод превращения кислот в альдегиды». J. Chem. Soc.: 584. Дои:10.1039 / jr9360000584.
- ^ Мозеттиг, Э. (1954). «Синтез альдегидов из карбоновых кислот». Орг. Реагировать. 8. С. 232–240. Дои:10.1002 / 0471264180.or008.05. ISBN 0471264180.
- ^ Dudman, C.C .; Грайс, Питер; Риз, Колин Б.; и другие. (1980). «Использование 2,4,6-три-изопропилбензолсульфонилгидразида в синтезе альдегида Макфадиена-Стивенса». Tetrahedron Lett. 21 (48): 4645. Дои:10.1016/0040-4039(80)80096-7.
- ^ Браун, В. М .; Картер, П. Х .; Томлинсон, М. (1958). «374. Формильные соединения. Часть II». J. Chem. Soc.: 1843. Дои:10.1039 / младший 9580001843.
- ^ Campaigne, E .; Thompson, R.L .; Ван Верт, Дж. Э. (1959). «Некоторые гетероциклические альдегидные тиосемикарбазоны, обладающие противовирусной активностью». J. Med. Chem. 1 (6): 577. Дои:10.1021 / jm50007a003. PMID 13807198.
- ^ Martin, S. B .; Craig, J.C .; Чан, Р. П. К. (1974). "Расследование реакции Макфадьена-Стивенса". Журнал органической химии. 39 (15): 2285. Дои:10.1021 / jo00929a600.
