Незначительная сплайсосома - Minor spliceosome
В второстепенная сплайсосома это рибонуклеопротеин комплекс, катализирующий удаление (сращивание ) атипичного класса сплайсосомных интроны (Тип U12) из эукариот информационные РНК у растений, насекомых, позвоночных и некоторых грибов (Rhizopus oryzae ). Этот процесс называется неканоническим сплайсингом, в отличие от U2-зависимого канонического сплайсинга. Интроны типа U12 составляют менее 1% всех интронов в клетках человека. Однако они обнаруживаются в генах, выполняющих важные клеточные функции.
Ранние доказательства

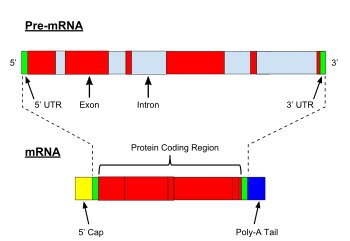
Примечательной особенностью интронов ядерной пре-мРНК эукариот является относительно высокий уровень консервативности первичных последовательностей сайтов сплайсинга 5 'и 3' у большого числа организмов.
Между 1989 и 1991 годами несколько групп сообщили о четырех независимых примерах интронов с сайтом сплайсинга, который отличался от общего интрона:
- Ген протеина хрящевого матрикса (CMP / MATN1) у людей и кур
- Ген нуклеолярного белка P120 (NOL1) пролиферирующих клеток у человека
- Ген Rep3 мыши, предположительно участвующий в репарации ДНК
- Ген просперо дрозофилы, кодирующий белок гомеобокса
В 1991 г., сравнивая интронные последовательности генов P120 и CMP, IJ Jackson сообщил о существовании сайтов сплайсинга ATATCC (5 ') и YYCAC (3') в этих интронах. Находка указала на возможный новый механизм сращивания.
В 1994 году С.Л. Холл и Р.А. Пэджетт сравнил первичную последовательность всех отчетов о четырех упомянутых выше генах. Результаты предложили новый тип интронов с сайтами сплайсинга ATATCCTT 5 'и сайтами сплайсинга YCCAC 3', а также почти инвариантную последовательность TCCTTAAC около 3 'конца интронов (так называемый 3' восходящий элемент). Поиск последовательностей малых ядерных РНК, которые комплементарны этим сайтам сплайсинга, позволил предположить, что мяРНК U12 (соответствует 3 'последовательности) и U11 snRNA (соответствует 5' последовательности) в качестве предполагаемых факторов, участвующих в сплайсинге этого нового типа интронов.
Во всех этих четырех генах пре-мРНК содержит другие интроны, последовательности которых соответствуют таковым интронов основного класса. Ни размер, ни положение интрона AT – AC в гене хозяина не сохраняются.
В 1996 году Воан-Ю Тарн и Джоан А. Стейтц описал in vitro система, которая сплайсирует субстрат пре-мРНК, содержащий интрон AT-AC, полученный из гена P120 человека. Псорален перекрестное связывание подтверждает взаимодействие спаривания оснований, предсказанное Холлом и Пэджеттом, между сайтом разветвления субстрата пре-мРНК и РНК U12. Нативный гель-электрофорез показывает, что мяРНП U11, U12 и U5 собираются на пре-мРНК P120 с образованием комплексов сплайсинга.
Структура интронов типа U12
Хотя первоначально они назывались интронами AT-AC, не все эти интроны ограничены динуклеотидами AT-AC. По крайней мере, некоторые из них имеют концы GT-AG или AT-AG. Таким образом, правильнее говорить о сварочном аппарате, который используется для их обработки, различая тип U2 (канонический или основной) и тип U12 (неканонический или второстепенный). Основными детерминантами для различения интронов типа U2 и U12 являются 5'-сайт сплайсинга и последовательности сайтов разветвления.[1]

Минорная сплайсосома состоит из U11, U12, U4atac, и U6atac, вместе с U5 и неизвестное количество белков, не относящихся к snRNP. МнРНП U11, U12 и U4atac / U6atac являются функциональными аналогами U1, U2 и U4 /U6 snRNPs в основной сплайсосоме.[2][3][4][5][6] Хотя минорные мяРНК U4atac и U6atac являются функциональными аналогами U4 и U6, соответственно, они обладают лишь ограниченной гомологией последовательностей (около 40%). Более того, последовательность U11 по сравнению с U1, а также U12 по сравнению с U2 совершенно не связаны. Несмотря на это, минорные мяРНК U11, U12, U4atac и U6atac могут быть свернуты в структуры, подобные U1, U2, U4 и U6 соответственно.[7]
Расположение незначительной сплайсосомальной активности
Большинство экспертов считает, что локализация сплайсосомной активности для сплайсосом минорного класса находится в ядре.[нужна цитата ] Однако в единственной статье утверждается, что минорная сплайсосома активна в цитозоле.[8] Данные, представленные в этой статье, не полностью приняты в данной области и прямо противоречат множеству других статей.
Эволюция
Как и основная сплайсосома, второстепенная сплайсосома имеет раннее происхождение: некоторые из ее характерных составляющих присутствуют в репрезентативных организмах из всех эукариотических супергрупп, для которых имеется какая-либо существенная информация о последовательности генома. Кроме того, функционально важные элементы последовательности, содержащиеся в интронах U12-типа и мяРНК, высоко консервативны в процессе эволюции.
Смотрите также
Рекомендации
Обзорные статьи:
- Турунен, Дж. Дж., Ниемеля, Э. Х., Верма, Б., и Фриландер, М. Дж (январь – февраль 2013 г.). «Другой значимый: сплайсинг второстепенной сплайсосомой». Междисциплинарные обзоры Wiley: РНК. 4 (1): 61–76. Дои:10.1002 / wrna.1141. ЧВК 3584512. PMID 23074130.CS1 maint: несколько имен: список авторов (ссылка на сайт) Рассмотрение.
- Будет CL, Lührmann R (август 2005 г.). «Сплайсинг редкого класса интронов U12-зависимой сплайсосомой». Биол. Chem. 386 (8): 713–24. Дои:10.1515 / BC.2005.084. PMID 16201866. Рассмотрение.
Классические бумаги:
- Джексон Эй Джей (25 июля 1991 г.). «Переоценка неконсенсусных сайтов сплайсинга мРНК». Нуклеиновые кислоты Res. 19 (14): 3795–8. Дои:10.1093 / nar / 19.14.3795. ЧВК 328465. PMID 1713664.
- Холл С.Л., Пэджетт Р.А. (1994). «Консервативные последовательности в классе редких эукариотических ядерных интронов с неконсенсусными сайтами сплайсинга». J. Mol. Биол. 239 (3): 357–65. Дои:10.1006 / jmbi.1994.1377. PMID 8201617.
- Tarn WY, Steitz JA (8 марта 1996 г.). "Новая сплайсосома, содержащая мяРНП U11, U12 и U5, вырезает интрон минорного класса (AT-AC) in vitro". Клетка. 84 (5): 801–11. Дои:10.1016 / S0092-8674 (00) 81057-0. PMID 8625417.
- Рассел А.Г., Шаретт Дж. М., Спенсер Д. Ф., Грей М. В. (19 октября 2006 г.). «Раннее эволюционное происхождение минорной сплайсосомы». Природа. 443 (7113): 863–6. Дои:10.1038 / природа05228. PMID 17051219.
Другие ссылки:
- ^ Дитрих Р.С., Incorvaia R, Padgett RA (1997). «Динуклеотидные последовательности терминального интрона не различают U2- и U12-зависимые интроны». Молекулярная клетка. 1 (1): 151–160. Дои:10.1016 / S1097-2765 (00) 80016-7. PMID 9659912.
- ^ Холл С.Л., Пэджетт Р.А. (1996). "Потребность в мяРНК U12 для in vivo сплайсинг второстепенного класса интронов пре-мРНК эукариотических ядер ». Наука. 271 (5256): 1716–8. Дои:10.1126 / science.271.5256.1716. PMID 8596930.
- ^ Tarn WY, Steitz JA (1996). "Новая сплайсосома, содержащая мяРНП U11, U12 и U5, вырезает интрон минорного класса (AT-AC) in vitro". Клетка. 84 (5): 801–11. Дои:10.1016 / S0092-8674 (00) 81057-0. PMID 8625417.
- ^ Колосова I, Пэджетт Р.А. (1997). «U11 snRNA взаимодействует in vivo с 5'-сайтом сплайсинга U12-зависимых (AU-AC) интронов пре-мРНК». РНК. 3 (3): 227–33. ЧВК 1369475. PMID 9056760.
- ^ Ю. Ю. Т., Стейтц Дж. А. (1997). «Сайт-специфическое перекрестное связывание U11 и U6atac млекопитающих с 5'-сайтом сплайсинга интрона AT – AC». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (12): 6030–5. Дои:10.1073 / пнас.94.12.6030. ЧВК 20995. PMID 9177163.
- ^ Incorvaia R, Padgett RA (1998). «Спаривание оснований с мяРНК U6atac необходимо для активации 5'-сайта сплайсинга U12-зависимых интронов in vivo». РНК. 4 (6): 709–18. Дои:10.1017 / S1355838298980207. ЧВК 1369652. PMID 9622129.
- ^ Tarn WY, Steitz JA (1996). «Сильно расходящиеся малые ядерные РНК U4 и U6, необходимые для сплайсинга редких интронов AT-AC». Наука. 273 (5283): 1824–32. Дои:10.1126 / science.273.5283.1824. PMID 8791582.
- ^ König H, Matter N, Bader R, Thiele W., Müller F (16 ноября 2007 г.). «Сплайсинговая сегрегация: второстепенная сплайсосома действует вне ядра и контролирует пролиферацию клеток». Клетка. 131 (4): 1718–29. Дои:10.1016 / j.cell.2007.09.043. PMID 18022366.
