Органическая фотохимия - Organic photochemistry
Органическая фотохимия охватывает органические реакции которые вызваны действием света.[1][2] Поглощение ультрафиолетового света органическими молекулами часто приводит к реакциям. Раньше использовался солнечный свет, а в наше время используются ультрафиолетовые лампы. Органическая фотохимия оказалась очень полезным синтетическим инструментом. Сложные органические продукты можно получить просто.
История
Ранние образцы часто обнаруживались путем наблюдения за осадками или изменениями цвета образцов, подвергшихся воздействию солнечных лучей. Первый зарегистрированный случай произошел от Ciamician, когда солнечный свет преобразовывал сантонин к желтому фотопродукту:[3]

Ранним примером осадка был фотодимеризация из антрацен, охарактеризованный Юлием Федоровичем Фриче и подтвержденный Эльбсом.[4] Подобные наблюдения были сосредоточены на димеризации коричной кислоты до труксилловая кислота. Многие фотодимеры теперь признаны, например димер пиримидина, тиофосген, диамантан.
Другой пример был обнаружен Эгбертом Хавингом в 1956 году.[5] Любопытным результатом была активация при фотолизе мета-нитрогруппой в отличие от обычной активации орто- и пара-группами.

Органическая фотохимия продвинулась вперед с развитием Правила Вудворда-Хоффмана.[6][7] Иллюстративно, эти правила помогают рационализировать электроциклическое замыкание кольца пент-2,4-диена, вызванное фотохимическим действием, которое происходит дисротаторным образом.

Считается, что органические реакции, подчиняющиеся этим правилам, допускают симметрию. Реакции, протекающие в обратном направлении, запрещены по симметрии и требуют значительно большего количества энергии, если они вообще имеют место.
Ключевые реакции
Органические фотохимические реакции объясняются в контексте соответствующих возбужденные состояния.[8][9]
Параллельно со структурными исследованиями, описанными выше, была оценена роль спиновой множественности - синглетной или триплетной - на реактивность. Подчеркивалась важность триплетно-возбужденных видов. Триплеты, как правило, более долговечны, чем синглеты, и обладают меньшей энергией, чем синглет той же конфигурации. Триплеты могут возникать в результате (A) превращения первоначально образованных синглетов или (B) взаимодействия с триплетом более высокой энергии (сенсибилизация).
Можно гасить триплетные реакции.[10]
Общие органические фотохимические реакции включают: Норриш Тип I, то Норриш Тип II, то рацемизация оптически активных бифенилов, перегруппировка циклогексадиенона типа A, перегруппировка циклогексенона типа B, ди-пи-метановая перегруппировка, перегруппировка бицикло [3.1.0] гексанона типа B до фенолов, фотохимическая электроциклический процессы, перегруппировка эпоксикетонов в бета-дикетоны, раскрытие цикла циклопропилкетонов, гетеролиз 3,5-диметоксилбензильных производных и фотохимическая циклизация диенов.
Практические соображения

Реагенты фотореакций могут быть как газообразными, так и жидкими.[11] В общем, необходимо поднести реагенты близко к источнику света, чтобы получить максимально возможное световая отдача. Для этого реакционную смесь можно облучать либо непосредственно, либо в проточном боковом плече реактор с подходящим источником света.[12]
Недостатком фотохимических процессов является низкая эффективность преобразования электроэнергия в радиация энергия необходимого длина волны. Помимо излучения, источники света выделяют много тепла, которое, в свою очередь, требует энергии охлаждения. Кроме того, большинство источников света излучают полихроматический свет, хотя только монохроматический свет необходим.[13] Высота квантовый выход Однако эти недостатки компенсируются.
Преимущество работы при низких температурах заключается в том, что избегаются побочные реакции (по мере увеличения селективности) и урожай увеличивается (поскольку газообразные реагенты меньше выводятся из растворителя).
Исходные материалы иногда можно охладить перед реакцией до такой степени, чтобы тепло реакции поглощалось без дальнейшего охлаждения смеси. В случае газообразных или низкокипящих исходных материалов необходима работа под избыточным давлением. Из-за большого количества возможных исходных материалов было описано большое количество процессов.[14][15] Крупномасштабные реакции обычно проводят в реактор с мешалкой, а барботажная колонна реактора или трубчатый реактор с последующей переработкой в зависимости от целевого продукта.[16] В случае реактора с мешалкой, лампа (обычно имеющая форму удлиненного цилиндра) снабжена охлаждающей рубашкой и помещена в реакционный раствор. Трубчатые реакторы изготавливаются из кварцевых или стеклянных трубок, которые облучаются снаружи. Использование реактора с мешалкой имеет то преимущество, что свет не теряется в окружающей среде. Однако интенсивность света быстро падает с увеличением расстояния до источника света из-за адсорбции реагентами.[12]
Влияние излучения на скорость реакции часто может быть представлен сила закона на основе плотности квантового потока, т.е. мольного кванта света (предварительно измеренного в единицах Эйнштейн ) по площади и времени. Таким образом, одной из целей при проектировании реакторов является определение экономически наиболее выгодных размеров с точки зрения оптимизации квантовой плотности тока.[17]
Тематические исследования
[2 + 2] Циклоприсоединения
Под действием УФ-излучения олефины димеризуются.[18]
Перегруппировка 4,4-дифенилциклогексадиенона
Совершенно параллельно с примером сантонина в люмисантонин является перегруппировка 4,4-дифенилциклогексадиенона.[9] Здесь n-pi * триплет возбужденное состояние претерпевает такую же бета-бета-связь. Далее следует межсистемный переход (т. е. ISC), чтобы сформировать синглетное основное состояние, которое рассматривается как цвиттерион. Завершающий этап - перегруппировка в бициклический фотопродукт. Реакция называется перегруппировкой циклогексадиенона типа А.
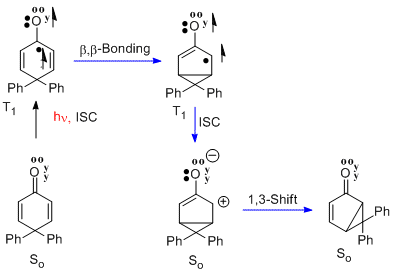
4,4-дифенилциклогексенон
Чтобы предоставить дополнительные доказательства механизма диенона, в котором существует связь между двумя двойными связями, здесь представлен случай 4,4-дифенилциклогексенона. Видно, что перестановка совершенно другая; таким образом, для перегруппировки типа А требуются две двойные связи. С одной двойной связью одна из фенильных групп, первоначально в C-4, переместилась в C-3 (то есть бета-углерод).[19]
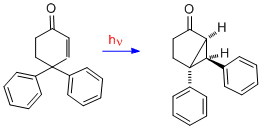
Когда одна из арильных групп имеет пара-циано или пара-метоксигруппу, предпочтительнее мигрирует эта замещенная арильная группа.[20] Изучение альтернативных разновидностей фенониевого типа, у которых арильная группа начала мигрировать к бета-углероду, выявляет большую делокализацию электронов с пара-заместителем на мигрирующей арильной группе и, таким образом, более стабильный путь.

π-π * реактивность
Еще один тип фотохимической реакции - это ди-пи-метановая перегруппировка.[21] Двумя другими ранними примерами были перегруппировка 1,1,5,5-тетрафенил-3,3-диметил-1,4-пентадиена (молекула «Мариано»).[22] и перестановка Barrelene к полубулвален.[23] Следует отметить, что, в отличие от реакций циклогексадиенона, в которых используются возбужденные состояния n-π *, перегруппировки ди-π-метана используют возбужденные состояния π-π *.
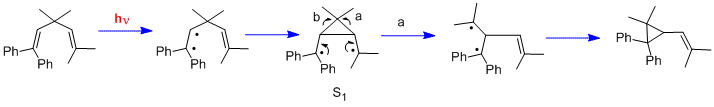
похожие темы
Фоторедокс-катализ
В фоторедокс-катализ фотон поглощается сенсибилизатором (антенной молекулой или ионом), который затем вызывает окислительно-восстановительные реакции на органическом субстрате. Обычным сенсибилизатором является трис (бипиридин) рутения (II). Иллюстрацией фоторедокс-катализа являются некоторые реакции аминотрифторметилирования.[24]

Фотохлорирование
Фотохлорирование является одним из крупнейших применений фотохимии в органическом синтезе. Однако фотон поглощается не органическим соединением, а хлор. Фотолиз Cl2 дает атомы хлора, которые отделяют атомы H от углеводородов, что приводит к хлорированию.
Рекомендации
- ^ П. Клан, Й. Вирц Фотохимия органических соединений: от идей к практике. Уайли, Чичестер, 2009 г., ISBN 978-1405190886.
- ^ Н. Дж. Турро, В. Рамамурти, Дж. К. Скайано Современная молекулярная фотохимия органических молекул. Научные книги университета, Саусалито, 2010 г., ISBN 978-1891389252.
- ^ Рот, Хайнц Д. (1989). «Начала органической фотохимии». Angewandte Chemie International Edition на английском языке. 28 (9): 1193–1207. Дои:10.1002 / anie.198911931.
- ^ . Дои:10.1002 / prac.18910440140. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ Havea, E .; De Jongh, R.O .; Дорст, В. (1956). «Фотохимическое ускорение гидролиза нитрофенилфосфатов и нитрофенилсульфатов». Recueil des Travaux Chimiques des Pays-Bas. 75 (4): 378–383. Дои:10.1002 / recl.19560750403.
- ^ Woodward, R. B .; Хоффманн, Роальд (1969). «Сохранение орбитальной симметрии». Энгью. Chem. Int. Эд. 8 (11): 781–853. Дои:10.1002 / anie.196907811.
- ^ Woodward, R. B .; Хоффманн, Роальд (1971). Сохранение орбитальной симметрии (3-е издание, 1-е изд.). Weinheim, BRD: Verlag Chemie GmbH (BRD) и Academic Press (США). С. 1–178. ISBN 978-1483256153.
- ^ «Фотохимическая перегруппировка 4,4-дифенилциклогексадиенона. Статья I по общей теории фотохимических реакций», Zimmerman, H.E .; Schuster, D. I. J. Am. Chem. Soc., 1961, 83, 4486-4487.
- ^ а б Zimmerman, Howard E .; Дэвид И. Шустер (1962). «Новый подход к механической органической фотохимии. IV. Фотохимические перегруппировки 4,4-дифенилциклогексадиенона». Журнал Американского химического общества. A.C.S. 84 (23): 4527–4540. Дои:10.1021 / ja00882a032.
- ^ "Теренин, А .; Ермолаев, В. Сенсибилизированная фосфоресценция в органических растворах при низкой температуре; передача энергии между триплетными состояниями", Пер. Faraday Soc., 1956, 52, 1042–1052.
- ^ Марио Скьявелло (Hrsg.): Основы и разработки фотоэлектрохимии, фотокатализа и фотореакторов. Springer, Нидерланды, 2009 г., ISBN 978-90-481-8414-9, п. 564.
- ^ а б Мартин Фишер: Промышленное применение фотохимических синтезов. В: Angewandte Chemie International Edition на английском языке. 17, 1978, с. 16–26, DOI: 10.1002 / anie.197800161.
- ^ Дитер Вёрле, Михаэль В. Тауш, Вольф-Дитер Сторер: Фотохимия: Konzepte, Methoden, Experimente. Wiley & Sons, 1998 г., ISBN 978-3-527-29545-6, п. 271–275.
- ^ Грант США 1379367, F. Sparre & W. E. Masland, "Процесс хлорирования", выпущенный 1921-05-24, переданный Du Pont
- ^ Грант США 1459777, R. Leiser & F. Ziffer, "Процесс и аппаратура для хлорирования метана", опубликованный 14 февраля 1920 г., переданный Зифферу Фрицу и Лейзеру Ричарду
- ^ Дэвид А. Миксон, Майкл П. Борер, Патриция А. О’Хара: Сверхочистка SiCl4 фотохлорированием в барботажной колонке реактора. В: Журнал Айше. 36, 1990, стр. 216–226, г. DOI: 10.1002 / aic.690360207.
- ^ Х. Хартиг: Einfache Dimensionierung, photochemischer Reaktoren. В: Chemie Ingenieur Technik - CIT. 42, 1970, стр. 1241–1245, г. Дои:10.1002 / cite.330422002.
- ^ Cargill1, R.L .; Dalton, J. R .; Morton, G.H .; Колдуэлл1, У. Э. (1984). «Фотоциклизация энона в алкен: 6-метилбицикло [4.2.0] октан-2-он». Органический синтез. 62: 118. Дои:10.15227 / orgsyn.062.0118.
- ^ «Механистическая и исследовательская органическая фотохимия, IX. Миграция фенила при облучении 4,4-дифенилциклогексенона», Zimmerman, H.E .; Wilson, J. W. J. Am. Chem. Soc., 1964, 86, 4036-4042.
- ^ "Фотохимические миграционные способности циклогексенонов. Механистическая и исследовательская органическая фотохимия. XXIII", Zimmerman, H.E .; Rieke, R.D .; Scheffer, J. R. J. Am. Chem. Soc., 1967, 89, 2033-2047.
- ^ "Несимметричное замещение и направление перегруппировки ди-пи-метана; Механистическая и исследовательская органическая фотохимия. LVI", Zimmerman, H.E .; Pratt, A.C.J. Am. Chem. Soc., 1970, 92, 6259-6267
- ^ "Ди-пи-метановая перегруппировка. Взаимодействие электронно возбужденных виниловых хромофоров. Циммерман, Х. Э .; Мариано, П. С. J. Am. Chem. Soc., 1969, 91, 1718-1727.
- ^ Zimmerman, H.E .; Грюневальд, Г. Л. (1966). "Химия баррелена. III. Уникальная фотоизомеризация в семибулвален". Варенье. Chem. Soc. 88 (1): 183–184. Дои:10.1021 / ja009
- ^ Ясу, Юске; Коике, Такаши; Акита, Мунетака (17 сентября 2012 г.). «Трехкомпонентное окситрифторметилирование алкенов: высокоэффективная и региоселективная дифункциональность C = C-связей, опосредованная Photoredox Catalysts». Angewandte Chemie International Edition. 51 (38): 9567–9571. Дои:10.1002 / anie.201205071. PMID 22936394.



