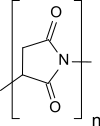
Полисукцинимид - Polysuccinimide
Этот полисукцинимид дубликаты объем других статей. |
 | |
| Идентификаторы | |
|---|---|
| Характеристики | |
| (C4ЧАС3НЕТ2)п | |
| Молярная масса | 97,07 г ·крот−1 |
| Внешность | твердый |
* не растворим в воде[1]
| |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Полисукцинимид (PSI), также известный как полиангидроаспарагиновая кислота или же полиаспартимид, образуется при термической поликонденсации аспарагиновая кислота и это самый простой полиимид. Полисукцинимид нерастворим в воде, но растворим в некоторых апротонные диполярные растворители. Его реакционная природа делает полисукцинимид универсальным исходным материалом для функциональных полимеров, изготовленных из возобновляемые ресурсы.
Название происходит от соли Янтарная кислота, структурно связанный сукцинат.
Производство
О производстве полисукцинимида сообщили Хьюго Шифф еще в 1897 г.[5] Когда сухую аспарагиновую кислоту нагревали в течение примерно 20 часов при 190-200 ° C, получали бесцветный продукт. Выше 200 ° С наступает слабое пожелтение, выход почти количественный.[6]

В экспериментах Хьюго Шиффа олигомеры и низкомолекулярные полимеры образовывались в твердофазной реакции путем поликонденсация после удаления воды. Обычно это имеет место в отсутствие сильных кислот, которые подавляют термическое разложение свободных концевых аминогрупп и, следовательно, реакции обрыва цепи. Образование полиимида полисукцинимида может сопровождаться интенсивной полосой поглощения в инфракрасный спектр в 1714 см−1. Многие варианты процесса, описанные в патентной литературе, дают помимо относительно низкой степени полимеризации часто разветвленные и обесцвеченные продукты от желтого до коричневого.[7]
Недавняя работа была сосредоточена на увеличении молярная масса и достижение линейной цепной структуры, избегая реакций разложения. С помощью простого "процесса в духовке", в котором смесь или паста кристаллических аспарагиновая кислота и концентрированный фосфорная кислота или же полифосфорная кислота в тонком слое нагревают до 200 ° C в течение 2-4 часов, полисукцинимид получают с молярными массами в пределах 30 000 г / моль и кремово-белым оттенком.[8] Осуществление поликонденсации в несколько этапов[9] (предварительная конденсация, измельчение, постконденсация), с другими обезвоживающие вещества (Например цеолиты, трифенилфосфит[10]) или в присутствии растворителей[11] (Например пропиленкарбонат ) обеспечивает продукты с более высоким молекулярным весом с молярными массами в диапазоне от 10 000 до 200 000 г / моль. Однако в патентной литературе не рассматривается морфология полимера, в частности степень разветвления.
Недавний патент[12] описывает простой препарат высокомолекулярного, практически бесцветного и линейного неразветвленного полисукцинимида. Для этого аспарагиновая кислота, которая присутствует в виде кристаллического цвиттериона и практически нерастворима в воде, сначала растворяется в водной летучей кислоте (предпочтительно соляной кислоте) и смешивается с фосфорной кислотой в качестве конденсирующего агента. Полученный гомогенный раствор упаривают при 120 ° C, а затем полученную стекловидную массу подвергают поликонденсации при 180-200 ° C в течение по меньшей мере одного часа. Фосфорная кислота вымывается, а высушенный полисукцинимид путем мягкого щелочного гидролиза превращается в водорастворимую полиаспарагиновую кислоту; молярная масса которого может быть определена гель-проникающая хроматография. В результате получают воспроизводимый полисукцинимид с молярной массой более 100000 г / моль.
Пути синтеза полисукцинимидов на основе моноаммониевой соли малеиновой кислоты,[13] малеиновый ангидрид и аммиак[14] или на основе промежуточно образованного моноамида малеиновой кислоты[15] достигли лишь низких молярных масс, составляющих несколько 1000 г / моль, и дали окрашенные продукты. То же самое было и с "зеленый "варианты процесса в сверхкритический диоксид углерода и при этом избегая использования минеральных кислот в качестве катализаторов.[6]

Из-за более низкой стоимости малеинового ангидрида и аммиака исходные материалы, полученные из ископаемого сырья, не содержат L-аспарагиновой кислоты ( биогенный origin) также используется в производстве коммерческого продукта полисукцинимид Baypure®.
Характеристики
Полисукцинимид выпускается в виде негигроскопичного порошка без запаха от кремово-белого до коричневого цвета, растворимого в апротонных диполярных растворителях, таких как диметилформамид, диметилацетамид, диметилсульфоксид, N-метилпирролидон, триэтиленгликоль или же мезитилен /сульфолан смеси. Полисукцинимид гидролизует в воде только очень медленно. В разбавленных щелочных средах (например, 1M раствор гидроксида натрия ), гидролиз происходит в α- и β-положениях кольцевых структур сукцинимида (2,5-пирролидиндиона), а рацемизация следует в хиральном центре аспарагиновой кислоты с образованием водорастворимой натриевой соли поли (α, β ) -DL-аспарагиновая кислота. Форма α образуется до прим. 30%, β-форма прибл. 70% в случайном порядке вдоль полимерной цепи.[16]
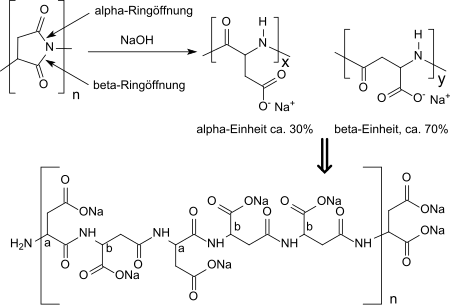
В более простых решениях или с более длительным временем реакции амидные связи в полимерной цепи разрушаются при разложении молярной массы. Присутствие амидных связей делает полиаспарагиновую кислоту, полученную при гидролизе, относительно биоразлагаемой (около 70% в сточных водах) даже для изначально сильно сшитых полисукцинимидов.[17]
Использовать
Полисукцинимид[4] развитый[18] к Bayer AG и продается Lanxess AG под торговой маркой Baypure® DSP со средней молекулярной массой 4400 г / моль частично гидролизуется даже при слегка повышенных значениях pH и, таким образом, набухает в сильно сшитой форме или водорастворим в линейной форме. Сополия (сукцинимид-аспарагиновая кислота), образованная частичным гидролизом, и особенно полиаспарагиновая кислота (торговое название Baypure® DS 100), полученная частичным гидролизом, подходит в качестве длительного ингибитора против отложение известкового налета в очистке воды и применениях в масле и горнодобывающая промышленность, а также как замедлитель схватывания цемента в строительной отрасли.[18] Патентная литература[10] упоминает применение полисукцинимидов в качестве хелатирующих агентов, ингибиторов образования накипи, диспергаторов, увлажнителей и удобрения.
Раскрытие пирролидиндионовых кольцевых структур в полисукцинимиде через аминолиз с аммиачной водой (с содержанием NH4OH) производит поли- (α, β) -DL-аспарагин, с гидразин поли- (α, β) -DL-аспартилгидразид (PAHy) и с функциональными аминами, например этаноламин поли- (α), β) -DL-2-гидроксиэтиласпартат (PHEA).[8] PHEA можно использовать плазменный расширитель с хорошей биосовместимостью и биоразлагаемостью, высокой растворимостью в воде при низких производственных затратах и более интенсивно исследовался в качестве потенциального носителя лекарственного средства) в медицинских приложениях.[19][20]

Сшитая натриевая соль поли (α, β) -DL аспарагиновой кислоты, которая является коммерчески наиболее интересным полисукцинимидом. производная, был тщательно протестирован на его пригодность в качестве биоразлагаемого суперабсорбента по сравнению с небиоразлагаемым стандартным сшитым полиакрилат натрия.[21][22] Полученные результаты еще не привели к использованию сшитой полиаспарагиновой кислоты в больших объемах применения суперабсорбентов (например, детские подгузники ).
Рекомендации
- ^ Э. Джалалванди, А. Шаванди (2018), «Полисукцинимид и его производные: разлагаемые и водорастворимые полимеры (обзор)», Евро. Polym. Дж., 109, стр. 43–54, Дои:10.1016 / j.eurpolymj.2018.08.056
- ^ T. Klein, R.-J. Мориц, Р. Граупнер (2016), Полимеры и пластмассы Ульманна, Продукты и процессы, Том 1, Часть 2: Органические полимеры, полиаспартаты и полисукцинимид, Weinheim: Wiley-VCH, стр. 742–743, ISBN 978-3-527-33823-8CS1 maint: несколько имен: список авторов (связь)
- ^ М. Томида, Т. Накато, М. Курамочи, М. Шибата, С. Мацунами, Т. Какучи (1996), «Новый метод синтеза поли (сукцинимида) и его сополимерных производных путем кислотно-катализируемой поликонденсации L-аспарагиновой кислоты. ", Полимер, 37 (16), стр. 4435–4437, Дои:10.1016/0032-3861(96)00267-4CS1 maint: несколько имен: список авторов (связь)
- ^ а б Общая информация о продукте Baypure® (PDF) Lanxess AG
- ^ Хьюго Шифф (1897-09-01), "Ueber Polyaspartsäuren", Berichte der deutschen chemischen Gesellschaft (на немецком), 30 (3), стр. 2449–2459, Дои:10.1002 / cber.18970300316
- ^ а б Кеннет Долл, Рэндал Шогрен, Рональд Холсер, Дж. Виллетт, Грэм Свифт (2005-12-01), «Полимеризация L-аспарагиновой кислоты в полисукцинимид и сополимер (сукцинимид-аспартат) в сверхкритическом диоксиде углерода», Письма по органической химии, 2 (8), стр. 687–689, Дои:10.2174/157017805774717553CS1 maint: несколько имен: список авторов (связь)
- ^ Томас Кляйн, Ральф-Иоганн Мориц, Рене Граупнер (2008), «Полиаспартаты и полисукцинимид», Энциклопедия промышленной химии Ульмана, Wiley-VCH Verlag GmbH & Co. KGaA, Дои:10.1002 / 14356007.l21_l01, ISBN 978-3-527-30673-2CS1 maint: несколько имен: список авторов (связь)
- ^ а б Паоло Нери, Гвидо Антони, Франко Бенвенути, Франческо Кокола, Гвидо Газзеи (1973-08-01), «Синтез α, β-поли [(2-гидроксиэтил) -DL-аспартамида], нового расширителя плазмы», Журнал медицинской химии, 16 (8), стр. 893–897, Дои:10.1021 / jm00266a006CS1 maint: несколько имен: список авторов (связь)
- ^ США 5142062, J. Knebel, K. Lehmann, "Способ увеличения молекулярной массы при производстве полисукцинимида", выпущенный 25 августа 1992 г., передан Röhm GmbH
- ^ а б ЕС 0791616, M. Uenaka et al., «Процесс производства полисукцинимида и использование указанного соединения», выпущенный 1997-8-27, переуступлен Mitsubishi Chemical Corp.
- ^ США 5756595, Г.Ю. Мазо и др., «Каталитическая полимеризация аспарагиновой кислоты», опубликованный 26 мая 1998 г., переуступленный Donlar Corp.
- ^ США 7053170, C.S. Sikes, «Получение высокомолекулярных полисукцинимидов», опубликованный 30 мая 2006 г., переданный Aquero Co.
- ^ ЕС 0612784, T. Groth et al., «Процесс получения полисукцинимида и полиаспарагиновой кислоты», выданный 31 августа 1994 г., переуступлен Bayer AG.
- ^ США 5296578, Л.П. Коскан, А.Р.Й. Meah, "Производство полисукцинимида и полиаспарагиновой кислоты из малеинового ангидрида и аммиака", выпущенный 22 марта 1994 г., переданный Donlar Corp.
- ^ США 5393868, M. B. Freeman et al., "Производство полисукцинимида термической полимеризацией малеаминовой кислоты", выпущенный 28 февраля 1995 г., переуступленный Rohm and Haas Co.
- ^ К.С. Лоу и др .: 6. Коммерческая поли (аспарагиновая кислота) и ее использование. В: J.E. Glass: Гидрофильные полимеры. Успехи химии. 248, 1996, ISBN 978-0-8412-3133-7, С. 99–111, DOI: 10.1021 / ba-1996-0248.ch006.
- ^ Г. Свифт: Разлагаемые полимеры. 2-е изд. Springer, Нидерланды, 2002, S. 379–412, Дои:10.1007/978-94-017-1217-0_11.
- ^ а б Т. Кляйн: Baypure®, инновационное семейство продуктов для домашнего и технического применения. 5-я конференция по зеленой химии, 2003 г., Барселона.
- ^ К. Со, Д. Ким: Дизайн и синтез эндосомолитического конъюгированного полиаспартамида для цитозольной доставки лекарств. В: Э. Джаббари, А. Хадемхоссейни (Hrsg.): Биологически чувствительные гибридные биоматериалы: справочник для материаловедов и биоинженеров. World Scientific Publishing Co., Сингапур, 2010 г., ISBN 978-981-4295-67-3, С. 191–212, Дои:10.1142/9789814295680_0009.
- ^ Эберхард В. Нойз, Аксель Г. Перлвиц, Зигфрид Шмитт (1991-11-01), "Водорастворимые полиамиды как потенциальные носители лекарств. III. Относительная стабильность основных цепей функционализированных боковыми цепями аспартамидных полимеров при водно-фазовом диализе" , Die Angewandte Makromolekulare Chemie, 192 (1), стр. 35–50, Дои:10.1002 / apmc.1991.051920103CS1 maint: несколько имен: список авторов (связь)
- ^ США 5859179, Y. Chou, «Формирование суперабсорбирующего полимера», опубликованный 19 января 1999 г., переуступленный Solutia Inc.
- ^ США 6072024, Y. Irizato et al., "Процесс производства сшитой полиаспарагиновой кислоты", выпущенный 2006-06-2009, передан Mitsui Chemicals
