Реакция Рамберга – Бэклунда - Ramberg–Bäcklund reaction
В Реакция Рамберга – Бэклунда является органическая реакция преобразование α-гало сульфон в алкен в присутствии основание с экструзией диоксид серы.[1] Реакция названа в честь двух шведских химиков. Людвиг Рамберг и Биргер Бэклунд. Карбанион, образующийся при депротонировании, дает нестабильный эписульфон, который разлагается с удалением диоксид серы. Эта стадия ликвидации считается согласованной циклоэлиминацией.[нужна цитата ]

Общее преобразование - это превращение связей углерод-сера в двойную связь углерод-углерод. Первоначальная процедура включала галогенирование сульфид, с последующим окисление к сульфон. Недавно предпочтительный метод изменил порядок шагов на обратный. После окисление, что обычно делается с помощью пероксикислота, галогенирование осуществляется в основных условиях с использованием дибромдифторметан для стадии переноса галогена. [2] Этот метод был использован для синтеза 1,8-дифенил-1,3,5,7-октатетраена.
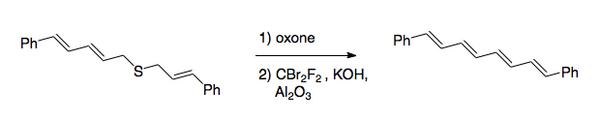
Реакция Рамберга – Бэклунда имеет несколько приложений. Из-за характера исключения может применяться как к маленьким кольцам [3],
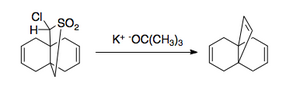
и большие кольца, содержащие двойную связь [4].
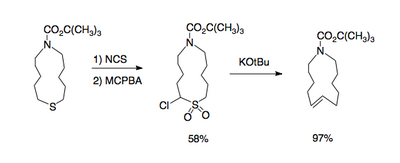
Необходимые α-галогенсульфоны становятся доступными путем окисления соответствующих α-галогенсульфидов надкислотами, такими как мета-хлорпербензойная кислота; окисление сульфидов происходит селективно в присутствии алкенов и спиртов. α-Галогенсульфиды, в свою очередь, могут быть синтезированы путем обработки сульфидов галогенными электрофилами, такими как N-хлорсукцинимид или N-бромосукцинимид.[5]
В сульфон группа содержит кислотный протон в одной из α-позиций, которая абстрагируется сильным основание (схема 1). Отрицательный заряд, помещенный на эту позицию (формально карбанион ) передается в галоген находящийся в другой α-позиции в нуклеофильное смещение временно образуя трехчленный циклический сульфон. Этот промежуточный продукт нестабилен и выделяет диоксид серы с образованием алкена. Смеси цис-изомер и транс-изомер обычно получают.[6]
Этот тип реакции дает доступ к 1,2-диметиленциклогексану.[7]

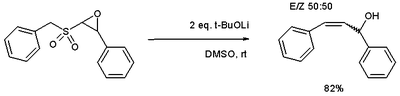
и эпоксид вариация [8] доступ к аллиловые спирты.
В Перестановка Фаворского и Сульфидное сжатие Эшенмозера концептуально связанные реакции.
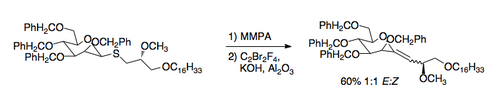
Недавно разработанное применение реакции Рамберга – Беклунда - это синтез C-гликозиды. Требуемые тиоэфиры могут быть легко получены путем обмена с тиол. Затем применение условий Рамберга-Беклунда приводит к экзоциклическому виниловому эфиру, который может быть восстановлен до C-нуклеозида. [9].
Рекомендации
- ^ Рамберг, Людвиг; Бэклунд, Биргер (1940). «Реакции некоторых моногалогенпроизводных диэтилсульфона». Архив химии, минералогии и геологии. 27 (13A): 1–50. ISSN 0365-3781.
- ^ Чан, Цзы-Лок; Фонг, Солнце; Ли, Ю; Человек, Тим-Он; Пун, Чи-Дуэн (1994). «Новая реакция Рамберга – Беклунда с одной колбой». Журнал химического общества, химические коммуникации (15): 1771–1772. Дои:10.1039 / C39940001771.
Цао, Сяо-Пин (2002). «Стереоселективный синтез замещенных полностью -транс 1,3,5,7-октатетраены по модифицированной реакции Рамберга – Беклунда ». Тетраэдр. 58 (7): 1301–1307. Дои:10.1016 / S0040-4020 (01) 01224-8. - ^ Пакетт, Лео А.; Филипс, Дж. Кристофер; Вингард, Роберт Э. (1971). «α-Галогенсульфоны. XVIII. Перегруппировка Рамберга – Беклунда как синтетический вход в ненасыщенные пропелланы». Журнал Американского химического общества. 93 (18): 4516–4522. Дои:10.1021 / ja00747a029.
- ^ Magee, D. I .; Бек, Э. Дж. (Август 2000 г.). «Использование перегруппировки Рамберга-Бэклунда для образования аза-макроциклов: полный синтез манзамина C». Канадский химический журнал. 78 (8): 1060–1066. Дои:10.1139 / v00-103.
- ^ Бёме, Хорст; Гран, Хайнц-Иоахим (12 июля 1952 г.). "Uber die Einwirkung von Chlor auf Thioäther und Mercaptale" [О действии хлора на тиоэфиры и меркаптали]. Юстус Либигс Аннален дер Хеми (на немецком). 577: 68–77. Дои:10.1002 / jlac.19525770109.
- ^ Пакетт, Лео А. (2005). «Перестановка Рамберга – Бэклунда». Органические реакции. 25. С. 1–71. Дои:10.1002 / 0471264180.or025.01. ISBN 9780471264187.
- ^ Блок, Эрик; Аслам, Мохаммад (1987). «Общий синтетический метод получения конъюгированных диенов из олефинов с использованием бромметансульфонилбромида: 1,2-диметиленциклогексана». Органический синтез. 65: 90. Дои:10.15227 / orgsyn.065.0090.; Коллективный объем, 8, п. 212
- ^ Evans, P .; Johnson, P .; Тейлор, Р. Дж. К. (апрель 2006 г.). «Реакция эпокси-Рамберга-Бэклунда (ERBR): метод на основе сульфона для синтеза аллиловых спиртов». Европейский журнал органической химии. 2006 (7): 1740–1754. Дои:10.1002 / ejoc.200500956.
- ^ Griffin, F.K .; Патерсон, Д. Э .; Мерфи, П. В .; Тейлор, Р. Дж. К. (август 2002 г.). "ХимИнформ Аннотация: Новый путь к экзо-Гликалы с использованием перегруппировки Рамберга – Беклунда ». ХимИнформ. 33 (33): 1305. Дои:10.1002 / подбородок.200233219.
