Перестановка Фаворского - Favorskii rearrangement
| Перестановка Фаворского | |
|---|---|
| Названный в честь | Алексей Евграфович Фаворский |
| Тип реакции | Реакция перестановки |
| Идентификаторы | |
| Портал органической химии | реакция Фаворского |
| RSC ID онтологии | RXNO: 0000385 |
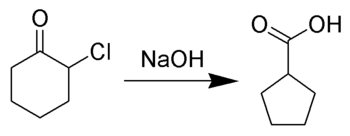
В Перестановка Фаворскогоимени русского химика Алексей Евграфович Фаворский, является главным образом перестановкой циклопропаноны и α-галогенкетоны что приводит к карбоновая кислота производные. В случае циклических α-галогенкетонов перегруппировка Фаворского представляет собой сжатие кольца. Эта перестановка происходит при наличии основания, иногда гидроксид, чтобы получить карбоновую кислоту, но в большинстве случаев либо алкоксид база или амин дать сложный эфир или амид, соответственно. α, α’-Дигалогенкетоны удаляют HX в условиях реакции с образованием α, β-ненасыщенных карбонильных соединений.[1][2][3][4][5][6][7][8]
Механизм реакции
В механизм реакции считается, что это связано с формированием энолировать на стороне кетон подальше от хлор атом. Этот енолят циклически превращается в циклопропанон промежуточный продукт, который затем подвергается воздействию гидроксида нуклеофил.

Вторая стадия также была предложена в качестве ступенчатого процесса, при этом хлорид-анион выходит первым, чтобы получить цвиттерионный оксиаллильный катион, прежде чем произойдет дисротационное электроциклическое замыкание кольца с получением промежуточного циклопропанона.[9]
Использование алкоксид анионы, такие как метоксид натрия, вместо гидроксида натрия, дают суженное кольцо сложный эфир товар.
Когда образование енолята невозможно, перегруппировка Фаворского происходит по альтернативному механизму, при котором происходит присоединение гидроксида к кетону, за которым следует согласованный коллапс тетраэдрического интермедиата и миграция соседнего углерода со смещением галогенида. Это иногда называют псевдо-перегруппировкой Фаворского, хотя до исследований по маркировке считалось, что все перегруппировки Фаворского протекают через этот механизм.
 |
| Анимация механизма реакции |
Деградация Уоллаха
В связанных Деградация Уоллаха (Отто Валлах, 1918) не один, а два атома галогена фланкируют кетон, что приводит к новому сжатому кетону после окисления и декарбоксилирование[10][11]
Фото-реакция Фаворского
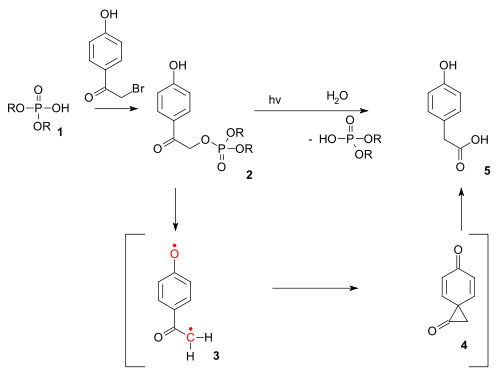
Тип реакции также существует как фотохимическая реакция. В фото-реакция Фаворского использовался при фотохимической разблокировке некоторых фосфаты (например, из АТФ ) защищенный так называемым п-гидроксифенацил группы.[12] Снятие защиты происходит через триплет бирадикал (3) и диона спиро средний (4), хотя последнее до сих пор ускользало от обнаружения.[13]
Смотрите также
- Классика кубан синтез содержит две перегруппировки Фаворского.
- Циклоприсоединение триметиленметана, который может происходить по аналогичному механизму
Рекомендации
- ^ Фаворский, А. (1894). J. Russ. Phys. Chem. Soc. 26: 590. Отсутствует или пусто
| название =(помощь) - ^ Фаворский, А. (1905). J. Russ. Phys. Chem. Soc. 37: 643. Отсутствует или пусто
| название =(помощь) - ^ Фаворский, А. (1913). "Über die Einwirkung von Phosphorhalogenverbindungen auf Ketone, Bromketone und Ketonalkohole". J. Prakt. Chem. (на немецком). 88 (1): 641–698. Дои:10.1002 / prac.19130880148.
- ^ Коуп, Артур (1960). Объем органической реакции XI (1-е изд.). Нью-Йорк: Wiley-Interscience. Дои:10.1002 / jps.2600500225. ISBN 9780471171270.
- ^ Wohllebe, J .; Гарбиш, Э. В. (1977). "Кольцо сжатия через Перегруппировка типа Фаворского: циклоундеканон ". Органический синтез. 56: 107. Дои:10.15227 / orgsyn.056.0107.; Коллективный объем, 6, п. 368
- ^ Шиоири, Такаюки; Кавай, Нобутака (1978). «Новые методы и реагенты в органическом синтезе. 2. Простое превращение алкиларилкетонов в α-арилалкановые кислоты с использованием дифенилфосфоразидата. Его применение в новом синтезе ибупрофена и напроксена, нестероидных противовоспалительных агентов». J. Org. Chem. 43 (14): 2936–2938. Дои:10.1021 / jo00408a049.
- ^ Хамада, Ясумаса; Шиоири, Такаюки (1982). «Циклоундеканкарбоновая кислота». Органический синтез. 62: 191. Дои:10.15227 / orgsyn.062.0191.; Коллективный объем, 7, п. 135
- ^ Goheen, D.W .; Воан, У. Р. (1963). «Циклопентанкарбоновая кислота, метиловый эфир». Органический синтез. 39: 37. Дои:10.15227 / orgsyn.039.0037.; Коллективный объем, 4, п. 594
- ^ Ахрем, А А; Устынюк, Т К; Титов Ю.А. (30 сентября 1970 г.). «Перестановка Фаворского». Российские химические обзоры. 39 (9): 732–746. Дои:10.1070 / rc1970v039n09abeh002019. ISSN 0036-021X.
- ^ Валлах, О. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle. Uber das Verhalten zweifach gebromter hexacyclischer Ketone в Abhängigkeit von der Stellung der Bromatome". Justus Liebigs Ann. Chem. (на немецком). 414 (3): 271–296. Дои:10.1002 / jlac.19184140303.
- ^ Валлах, О. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle". Justus Liebigs Ann. Chem. (на немецком). 414 (3): 296–366. Дои:10.1002 / jlac.19184140304.
- ^ Парк, Чан-Хо; Гивенс, Ричард С. (1997). «Новые фотоактивированные защитные группы. 6. п-Гидроксифенацил: фотонагреватель для химических и биохимических проб ». Варенье. Chem. Soc. 119 (10): 2453–2463. Дои:10.1021 / ja9635589.
- ^ Гивенс, Ричард С .; Хегер, Доминик; Hellrung, Бруно; Камджилов, Явор; Мак, Марек; Конрад, Питер Дж .; Коп, Элизабет; Ли, Чон И .; Мата-Сегреда, Хулио Ф .; Schowen, Ричард Л .; Вирц, Якоб (2008). "Фото-Фаворская реакция п-Гидроксифенацильные соединения инициируются водной адиабатической экструзией триплетного бирадикала ». Варенье. Chem. Soc. 130 (11): 3307–3309. Дои:10.1021 / ja7109579. ЧВК 3739295. PMID 18290649.