Электрофорез белков сыворотки - Serum protein electrophoresis
| Электрофорез белков сыворотки | |
|---|---|
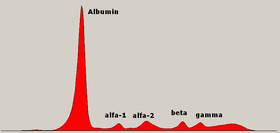 Диаграмма электрофореза нормальных белков сыворотки крови с обозначениями различных зон. | |
| MeSH | D001797 |

Электрофорез белков сыворотки (SPEP или же SPE) - это лабораторный тест, исследующий определенные белки в крови называется глобулины.[1] Наиболее частыми показаниями к электрофорезу сывороточного протеина являются диагностика или мониторинг множественная миелома, а моноклональная гаммопатия неопределенного значения (MGUS), или дополнительно исследовать несоответствие между низким содержанием альбумина и относительно высоким уровнем общего белка. Необъяснимая боль в костях, анемия, протеинурия, хроническая болезнь почек, и гиперкальциемия также являются признаками множественной миеломы и показаниями для SPE.[2] Кровь сначала необходимо собрать, обычно в герметичный флакон или шприц. Электрофорез это лабораторный метод, в котором сыворотка крови (жидкая часть крови после свертывания крови) наносится на ацетатную мембрану, пропитанную жидким буфером.,[3][4] к забуференной агарозе гель матрицу или в жидкость в капилляр трубке и подвергается электрический ток разделить белковые компоненты сыворотки на пять основных фракций по размеру и электрическому заряду: сывороточный альбумин, альфа-1 глобулины, альфа-2 глобулины, бета 1 и 2 глобулины, и гамма-глобулины.
Ацетатный или гель-электрофорез
Белки разделяются как электрическими силами, так и электроэндоосмостическими силами. Чистый заряд белка основан на суммарном заряде его аминокислот и pH буфера. Белки наносят на твердую матрицу, такую как агарозный гель, или мембрану из ацетата целлюлозы в жидком буфере, и прикладывают электрический ток. Белки с отрицательным зарядом будут перемещаться к положительно заряженному аноду. Альбумин имеет самый отрицательный заряд и будет мигрировать дальше всего к аноду. Эндоосмотический поток - это движение жидкости к катоду, которое заставляет белки с более слабым зарядом двигаться назад от места нанесения. Гамма-белки в первую очередь разделяются эндоосмотическими силами.[5]
Капиллярный электрофорез
В капиллярном электрофорезе твердой матрицы нет. Белки разделяются в первую очередь сильными электроэндоосмотическими силами. Образец вводится в капилляр с отрицательным поверхностным зарядом. Подается сильный ток, и отрицательно заряженные белки, такие как альбумин, пытаются двигаться к аноду. Жидкий буфер течет к катоду и увлекает белки с более слабым зарядом.[6][7]
Белковые фракции сыворотки

Альбумин
Альбумин является основной долей в нормальном SPEP. Необходимо снижение на 30% до того, как уменьшение покажет при электрофорезе. Обычно видна одна полоса. Гетерозиготный люди могут производить бисальбуминемия - две одинаково окрашиваемые полосы, продукт двух генов. Некоторые варианты приводят к появлению широкой полосы или двух полос неравной интенсивности, но никто этих вариантов связано с болезнью.[8] Повышенная анодная подвижность является результатом связывания билирубин, неэтерифицированный жирные кислоты, пенициллин и Ацетилсалициловая кислота, а иногда от триптического переваривания при остром панкреатит.
Отсутствие альбумина, известного как анальбуминемия, редко. Однако пониженный уровень альбумина характерен для многих заболеваний, в том числе болезнь печени, недоедание, мальабсорбция, нефропатия с потерей белка и энтеропатия.[9]
Альбумин - альфа-1 межзональный
Даже окрашивание в этой зоне связано с липопротеином альфа-1 (липопротеины высокой плотности - ЛПВП). Уменьшение происходит при сильном воспалении, остром гепатит, и цирроз. Также, нефротический синдром может привести к снижению уровня альбумина; из-за его потери с мочой из-за поврежденного протекающего клубочки. Увеличение наблюдается у тяжелых алкоголиков, а также у женщин во время беременности и в период полового созревания.
Высокий уровень AFP что может произойти в гепатоцеллюлярная карцинома может привести к резкой полосе между альбумином и зоной альфа-1.
Зона Альфа-1
Оросомукоид и антитрипсин мигрируют вместе, но пятна оросомукоида плохо альфа-1-антитрипсин (AAT) составляет большую часть диапазона альфа-1. Альфа-1-антитрипсин имеет группу SG, и тиоловые соединения могут связываться с белком, изменяя их подвижность. В состоянии дефицита наблюдается уменьшение полосы. Уменьшается в нефротический синдром[10] и отсутствие может указывать на возможный дефицит альфа-1-антитрипсина. Это в конечном итоге приводит к эмфизема от нерегулируемой активности эластазы нейтрофилов в легочной ткани. Однако фракция альфа-1 не исчезает при дефиците альфа-1-антитрипсина, поскольку другие белки, включая альфа-липопротеин и оросомукоид также мигрируют туда. В качестве положительного реагента острой фазы ААТ увеличивается при остром воспалении.
Белок Бенс Джонса может связываться и задерживать альфа-1 полосу.[нужна цитата ]
Альфа-1 - межзонный альфа-2
Можно увидеть две слабые полосы, представляющие альфа-1-антихимотрипсин и Витамин Д связывающий белок. Эти полосы сливаются и усиливаются при раннем воспалении из-за увеличения альфа-1-антихимотрипсина, белок острой фазы.
Зона Альфа-2
Эта зона состоит в основном из альфа-2 макроглобулин (AMG или A2M) и гаптоглобин. Обычно есть низкие уровни в гемолитическая анемия (гаптоглобин - это самоубийственная молекула, которая связывается со свободными гемоглобин выпущенный из красные кровяные тельца и эти комплексы быстро удаляются фагоциты ). Гаптоглобин повышается как часть реакции острой фазы, что приводит к типичному повышению зоны альфа-2 во время воспаления. Нормальная зона альфа-2 и повышенная зона альфа-1 - типичная картина в печени. метастаз и цирроз печени.
Комплексы гаптоглобин / гемаглобин мигрируют более катодно, чем гаптоглобин, как видно в интерзоне альфа-2-бета. Обычно это рассматривается как расширение зоны альфа-2.
Уровень альфа-2 макроглобулина может быть повышен у детей и пожилых людей. Это видно как резкий фронт альфа-2 диапазона. Уровень AMG заметно повышается (в 10 раз или больше) в связи с потерей клубочкового белка, как в нефротический синдром. Из-за своего большого размера AMG не может проходить через клубочки, тогда как другие белки с более низкой молекулярной массой теряются. Повышенный синтез AMG объясняет его абсолютное увеличение при нефротическом синдроме. Повышенный уровень АМГ также отмечается у крыс без альбумина, что указывает на то, что это реакция на низкий уровень альбумина, а не сам нефротический синдром.[11]
AMG слегка повышен в начале диабетическая нефропатия.
Альфа-2 - межзонная бета
Холодный нерастворимый глобулин здесь образует полосу, которая не видна в плазма потому что он осаждается гепарин. Есть низкие уровни воспаления и высокие уровни во время беременности.
Бета-липопротеин образует нерегулярный зубчатый группа в этой зоне. Высокие уровни наблюдаются при типе II. гиперхолестеринемия, гипертриглицеридемия, и при нефротическом синдроме.
Бета-зона
Трансферрин и бета-липопротеин (ЛПНП ) состоит из бета-1. Повышенный уровень белка бета-1 из-за повышенного уровня свободного трансферрина типичен для железодефицитная анемия, беременность, и эстроген терапия. Повышение уровня белка бета-1 из-за повышения ЛПНП происходит в гиперхолестеринемия. Снижение уровня белка бета-1 возникает при остром или хроническом воспалении.
Бета-2 включает C3 (белок комплемента 3). Он повышается в острой фазе ответа. Депрессия C3 возникает при аутоиммунных заболеваниях, когда активируется система комплемента, и C3 связывается с иммунными комплексами и удаляется из сыворотки. Фибриноген, белок бета-2, обнаруживается в нормальной плазме, но отсутствует в нормальной сыворотке. Иногда кровь, взятая у гепаринизированных пациентов, не полностью свертывается, что приводит к появлению видимой полосы фибриногена между бета- и гамма-глобулинами.
Бета-гамма межзонный
С-реактивный белок находится между бета- и гамма-зонами, производя бета / гамма-синтез. IgA имеет наибольшую анодную подвижность и обычно мигрирует в области между бета- и гамма-зонами, также вызывая бета / гамма-слияние у пациентов с циррозом, респираторной инфекцией, заболевание кожи, или же ревматоидный артрит (повышенный IgA). Фибриноген из плазма образцы будут видны в области бета-гаммы. Фибриноген, белок бета-2, обнаруживается в нормальной плазме, но отсутствует в нормальной сыворотке. Иногда кровь, взятая у гепаринизированных пациентов, не полностью свертывается, что приводит к появлению видимой полосы фибриногена между бета- и гамма-глобулинами.
Гамма-зона
В иммуноглобулины или же антитела обычно являются единственными белками, присутствующими в нормальной гамма-области. Следует отметить, что любой белок, мигрирующий в гамма-области, будет окрашен и появится на геле, что может включать примеси белка, артефакты или определенные лекарства. В зависимости от того, используется ли агарозный или капиллярный метод, помехи различаются. Иммуноглобулины состоят из тяжелых цепей (IgA, IgM, IgG, IgE и IgD) и легких цепей (каппа и лямбда). Нормальная гамма-зона должна выглядеть как гладкий «румянец» или мазок без асимметрии или резких пиков.[12] Гамма-глобулины могут быть повышены (гипергаммаглобулинемия ), уменьшилось (гипогаммаглобулинемия ) или имеют аномальный пик или пики. Обратите внимание, что иммуноглобулины также могут быть найдены в других зонах; IgA обычно мигрирует в бета-гамма-зону, и, в частности, патогенные иммуноглобулины могут мигрировать куда угодно, включая альфа-области.
Гипогаммаглобулинемию легко определить как «спад» или уменьшение гамма-зоны. Это нормально для младенцев. Встречается у пациентов с Х-сцепленная агаммаглобулинемия. Дефицит IgA встречается у 1: 500 населения, о чем свидетельствует бледность в гамма-зоне. Следует отметить, что гипогаммаглобулинем может наблюдаться в контексте MGUS или множественной миеломы.
Если гамма-зона показывает увеличение, первым шагом в интерпретации является определение, является ли область узкой или широкой. Широкий «набухший» образ (широкий) указывает на продукцию поликлонального иммуноглобулина. Если он повышен асимметрично или с одним или несколькими пиками или узкими «пиками», это может указывать на клональную продукцию одного или нескольких иммуноглобулинов,[13]
На поликлональную гаммапатию указывает «набухшее» возвышение в гамма-зоне, которое обычно указывает на неопухолевое состояние (хотя и не только для неопухолевых состояний). Наиболее частыми причинами поликлональной гипергаммаглобулинемии, обнаруживаемой с помощью электрофореза, являются тяжелые инфекционное заболевание, хроническое заболевание печени, ревматоидный артрит, системный Красная волчанка и другие заболевания соединительной ткани.
Узкий спайк свидетельствует о моноклональной гаммопатии, также известной как ограниченная полоса или «М-спайк». Чтобы подтвердить, что ограниченная полоса представляет собой иммуноглобулин, последующее тестирование с иммунофиксация, или иммунодезамещение / иммуносубтракция (капиллярные методы). Лечебный моноклональные антитела (mAb), также мигрируют в эту область и могут быть ошибочно интерпретированы как моноклональная гаммопатия, а также могут быть идентифицированы с помощью иммунофиксации или иммунодезамещения / иммуносубтракции, поскольку они структурно сопоставимы с иммуноглобулинами человека.[14] Наиболее частой причиной ограниченной полосы является MGUS (моноклональная гаммопатия неопределенного значения), которая, хотя и является необходимым предшественником, лишь в редких случаях прогрессирует до множественной миеломы. (В среднем 1% / год.)[15] Как правило, моноклональная гаммопатия имеет злокачественное или клональное происхождение, Миелома являясь наиболее частой причиной IgA и IgG шипы. хронический лимфолейкоз и лимфосаркома не редкость и обычно вызывают IgM парапротеины. Обратите внимание, что до 8% здоровых гериатрических пациентов могут иметь моноклональный спайк.[16] Макроглобулинемия Вальденстрема (IgM), моноклональная гаммопатия неустановленного значения (MGUS), амилоидоз, лейкоз плазматических клеток и одиночные плазмоцитомы также вызывают M-спайк.
На олигоклональную гаммапатию указывают один или несколько отдельных клонов.
Лизоцим можно рассматривать как полосу катодно-гамма в миеломоноцитарной лейкемия в котором он освобожден от опухоль клетки.
Рекомендации
- ^ Дженкинс, Маргарет А. (1999). «Электрофорез белков сыворотки». Клиническое применение капиллярного электрофореза. Методы молекулярной медицины. 27. С. 11–20. Дои:10.1385/1-59259-689-4:11. ISBN 1-59259-689-4. PMID 21374283.
- ^ Харрис, Нил С .; Зима, Уильям Э. (2012). Множественная миелома и связанные с ней нарушения белков сыворотки: руководство по электрофоретике. Demos Medical. п. 5. ISBN 978-1-933864-75-4.CS1 maint: ref = harv (связь)
- ^ Каплан, А; Сэвори, Дж (1965). «Оценка системы электрофореза ацетата целлюлозы для фракционирования сывороточного белка». Клиническая химия. 11 (10): 937–42. Дои:10.1093 / Clinchem / 11.10.937. PMID 4158264.
- ^ Химия / «Оценка системы электрофореза ацетата целлюлозы для фракционирования белков сыворотки» Проверять
| url =ценить (помощь). Клиническая химия. Получено 1 мая 2016. - ^ Харрис 2012 С. 9–16.
- ^ Харрис, 2012 и стр. 117–123..
- ^ Керен, Дэвид Ф. (2003). Белковый электрофорез в клинической диагностике. Ходдер Арнольд. С. 1–14. ISBN 0340-81213-3.CS1 maint: ref = harv (связь)
- ^ Hoang, Mai P; Баскин, Лиланд Б; Wians, Франк Х (1999). «Бисальбуминурия у взрослого с бисальбуминемией и нефротическим синдромом». Clinica Chimica Acta. 284 (1): 101–7. Дои:10.1016 / S0009-8981 (99) 00054-6. PMID 10437648.
- ^ Перальта, Рубен; Рубери, Брэд А. (30 июля 2012 г.). Пинский, Майкл Р; Шарма, сб; Талавера, Франсиско; Мэннинг, Гарольд Л; Райс, Тимоти Д. (ред.). «Гипоальбуминемия». Medscape. Получено 2 октября 2013.
- ^ Лонгсворт, LG; Macinnes, DA (1 января 1940 г.). «Электрофоретическое исследование нефротической сыворотки и мочи». Журнал экспериментальной медицины. 71 (1): 77–82. Дои:10.1084 / jem.71.1.77. ЧВК 2135007. PMID 19870946.
- ^ Стивенсон, FT; Грин, S; Кайсен, Джорджия (январь 1998 г.). «Концентрации альфа-2-макроглобулина и альфа-1-ингибитора 3 в сыворотке крови повышаются при гипоальбуминемии за счет посттранскрипционных механизмов». Kidney International. 53 (1): 67–75. Дои:10.1046 / j.1523-1755.1998.00734.x. PMID 9453001.
- ^ Керен 2003 С. 93–97.
- ^ Туазон, Шерилин Альваран; Скарпачи, Энтони П. (11 мая 2012 г.). Старос, Эрик Б. (ред.). «Электрофорез белков сыворотки». Medscape. Получено 2 октября 2013.
- ^ Маккудден, К. (2016). «Мониторинг пациентов с множественной миеломой, получавших даратумумаб: устранение помех от моноклональных антител». Clin Chem Lab Med. 54 (6): 1095–104. Дои:10.1515 / cclm-2015-1031. PMID 27028734.
- ^ Харрис 2012, п. 60.
- ^ Wadhera, Rishi K .; Раджкумар, С. Винсент (2010). «Распространенность моноклональной гаммопатии неопределенной значимости: систематический обзор». Труды клиники Мэйо. 85 (10): 933–42. Дои:10.4065 / mcp.2010.0337. ЧВК 2947966. PMID 20713974.
внешняя ссылка
- Электрофорез белков при Лабораторные тесты онлайн
