Тромб - Thrombus
| Тромб | |
|---|---|
| Другие имена | Тромб |
 | |
| Схема тромба (сгустка крови), который заблокировал клапан кровеносного сосуда | |
| Специальность | Сосудистая хирургия |
А тромб, в просторечии называется сгусток крови, является конечным продуктом коагуляция крови войти гемостаз. У тромба есть два компонента: агрегированный тромбоциты и красные кровяные клетки которые образуют пробку, и сетку из сшитых фибрин белок. Вещество, образующее тромб, иногда называют грубый. Тромб - это здоровый ответ на травма, повреждение предназначен для предотвращения кровотечения, но может быть вредным в тромбоз, когда сгустки препятствуют кровотоку по здоровым кровеносным сосудам.
Настенные тромбы - это тромбы, которые прилипают к стенке кровеносного сосуда. Они возникают в крупных сосудах, таких как сердце и аорта, и может ограничивать кровоток, но обычно не блокирует его полностью. Они кажутся серо-красными с чередующимися светлыми и темными линиями (известные как линии Zahn ), которые представляют собой полосы захваченных лейкоцитов и красных кровяных телец (более темные).
Причина
Триада Вирхова описывает патогенез образования тромба:[1][2]
- Эндотелиальная травма: травма эндотелий (внутренняя поверхность кровеносного сосуда), вызывая активацию и агрегацию тромбоцитов;
- Общие причины включают: травма, курение, гипертония, атерома.
- Гемодинамический изменения (застой, турбулентность): застой крови способствует большему контакту между тромбоцитами / факторами свертывания крови с эндотелием сосудов. Если быстрое кровообращение (например, из-за тахикардия ) возникает в сосудах с повреждениями эндотелия, что создает беспорядочный кровоток (турбулентность), что может привести к образованию тромбоза;[3]
- Общие причины застоя включают все, что приводит к длительной неподвижности и снижению кровотока, например: травма /сломанные кости и расширенный воздушное путешествие.
- Гиперкоагуляция[4] (также называемый тромбофилия; любое заболевание крови, предрасполагающее к тромбозу);
Диссеминированное внутрисосудистое свертывание (ДВС-синдром) включает широко распространенное образование микротромбов в большинстве кровеносных сосудов. Это связано с чрезмерным расходом факторов свертывания и последующей активацией фибринолиз используя все доступные тела тромбоциты и факторы свертывания крови. Конечным результатом является кровотечение и ишемический некроз тканей / органов. Причины сепсис, острый лейкемия, шок, укусы змей, жировая эмболия от переломов костей или других тяжелых травм. DIC также можно увидеть в беременные самки. Лечение предполагает использование свежезамороженная плазма для восстановления уровня факторов свертывания в крови, а также тромбоцитов и гепарина для предотвращения дальнейшего образования тромбов.
Классификация
Тромбы делятся на две основные группы в зависимости от их расположения и относительного количества тромбоцитов и эритроцитов (эритроцитов).[5] Две основные группы:
- Артериальные или белые тромбы (характеризуются преобладанием тромбоцитов)
- Венозные или красные тромбы (характеризуются преобладанием эритроцитов).
Патофизиология

Тромб возникает, когда гемостатический процесс, который обычно возникает в ответ на травму, активируется в неповрежденном или слегка поврежденном сосуде. Тромб в большом кровеносном сосуде уменьшит кровоток через этот сосуд (так называемый настенный тромб). В небольшом кровеносном сосуде кровоток может быть полностью перекрыт (это называется окклюзионным тромбом), что приведет к гибели ткани, снабжаемой этим сосудом. Если тромб смещается и становится свободно плавающим, это считается эмбол.
Некоторые из условий, повышающих риск образования тромбов, включают: мерцательная аритмия (форма аритмия сердца ), замена сердечного клапана, недавняя острое сердечно-сосудистое заболевание (также известный как инфаркт миокарда ), длительные периоды бездействия (см. тромбоз глубоких вен ), а также генетические или связанные с заболеванием недостаточности свертываемости крови.
Формирование
Активация тромбоцитов происходит из-за травм, которые повреждают эндотелий кровеносных сосудов, обнажая фермент, называемый фактор VII, белок, обычно циркулирующий в сосудах, к тканевый фактор, который представляет собой белок, кодируемый геном F3. Активация тромбоцитов может потенциально вызвать каскад, в конечном итоге приводящий к образованию тромба.[6] Этот процесс регулируется тромборегуляция.
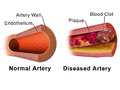
Иллюстрация сравнения нормальной артерии и пораженной артерии со сгустком крови

Микрофотография показывая тромб (центр изображения) в кровеносном сосуде плацента. H&E пятно.
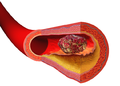
Иллюстрация, изображающая образование тромба над артериальной бляшкой.
Профилактика и лечение
Антикоагулянты препараты, которые используются для предотвращения образования тромбов, снижая риск Инсульт, острое сердечно-сосудистое заболевание и легочная эмболия. Гепарин и варфарин используются для подавления образования и роста существующих тромбов, причем первые используются для острой антикоагуляции, а вторые - для длительной антикоагуляции.[2] Механизм действия гепарина и варфарина различен, поскольку они воздействуют на разные пути обмена веществ. каскад коагуляции.[7] Гепарин связывает и активирует ингибитор фермента. антитромбин III, фермент, который действует путем инактивации тромбина и фактора Ха.[7] Напротив, варфарин ингибирует эпоксид редуктаза витамина К, фермент, необходимый для синтеза витамин К-зависимых факторов свертывания крови II, VII, IX и X.[7][8] Время кровотечения при терапии гепарином и варфарином можно измерить с помощью частичного тромбопластинового времени (ЧТВ) и протромбинового времени (ПВ) соответственно.[8]
После образования сгустков можно использовать другие препараты для стимулирования тромболизис или распад сгустка. Стрептокиназа, фермент, производимый стрептококковые бактерии, является одним из старейших тромболитических препаратов.[8] Этот препарат можно вводить внутривенно растворять тромбы в коронарные сосуды. Однако стрептокиназа вызывает системное фибринолитическое состояние и может привести к кровотечениям. Активатор тканевого плазминогена (tPA) - это другой фермент, который способствует разложению фибрина в сгустках, но не свободного фибриногена.[8] Этот препарат вырабатывается трансгенными бактериями и превращает плазминоген в фермент, растворяющий сгустки, плазмин.[9] Недавние исследования показывают, что tPA может оказывать токсическое действие на центральную нервную систему. В случае тяжелого инсульта tPA может пересекать гематоэнцефалический барьер и попадает в интерстициальную жидкость, где увеличивает эксайтотоксичность, потенциально влияя на проницаемость гематоэнцефалического барьера,[10] и вызывая кровоизлияние в мозг.[11]
Есть также некоторые антикоагулянты, полученные от животных, которые растворяют фибрин. Например, Haementeria ghilianii, Amazon пиявка, производит фермент, называемый гементин из его слюнные железы.[12]
Прогноз
Формирование тромба может иметь один из четырех результатов: распространение, эмболизация, растворение, а также организация и реканализация.[13]
- Распространение тромба происходит в направлении сердца и связано с накоплением дополнительных тромбоцитов и фибрина. Это означает, что он является антероградным в венах или ретроградным в артериях.
- Эмболизация происходит, когда тромб отрывается от стенки сосуда и становится подвижным, перемещаясь, таким образом, к другим участкам сосудистой сети. Венозный эмбол (в основном от тромбоз глубоких вен в нижние конечности ) будет проходить через большой круг кровообращения, достигать правого края сердца и проходить через легочную артерию, что приводит к тромбоэмболии легочной артерии. Артериальный тромбоз в результате гипертонии или атеросклероза может стать подвижным, и образовавшиеся эмболы могут закупорить любую артерию или артериолу ниже по течению от образования тромба. Это означает, что может быть поражен церебральный инсульт, инфаркт миокарда или любой другой орган.
- Растворение происходит, когда фибринолитические механизмы разбивают тромб, и кровоток к сосуду восстанавливается. Этому могут помочь фибринолитические препараты, такие как активатор тканевого плазминогена (tPA) в случаях окклюзии коронарной артерии. Лучший ответ на фибринолитические препараты - в течение нескольких часов, прежде чем фибриновая сеть тромба полностью разовьется.
- Организация и реканализация предполагает врастание гладкая мышца клетки фибробласты и эндотелий в фибрин -обогатый тромб. Если реканализация продолжается, она обеспечивает каналы размером с капилляр через тромб для непрерывного кровотока через весь тромб, но может не восстановить достаточный кровоток для метаболических потребностей нижерасположенной ткани.[1]
Смотрите также
- Тромбоз
- Эмболия
- Тромболизис («разрушение сгустка»)
- Тромбогенность (склонность к свертыванию)
- Национальный альянс по сгустку крови
- Протромбиновое время
- Геморрой
Рекомендации
- ^ а б Кумар, Винай; Аббас, Абул; Астер, Джон (2014). Патологическая основа болезни Роббинса и Котрана (9-е изд.). Филадельфия, Пенсильвания: Эльзевьер. ISBN 9781455726134. OCLC 879416939.
- ^ а б "Венозная тромбоэмболия (ВТЭ) | Обзор патофизиологии Макмастера". www.pathophys.org. Получено 2018-11-03.
- ^ Кушнер, Эбигейл; West, William P .; Пилларисетти, Лила Шарат (2020), "Триада Вирхова", StatPearls, Остров сокровищ (Флорида): StatPearls Publishing, PMID 30969519, получено 2020-06-18
- ^ Атага К.И. (10 мая 2020 г.). «Гиперкоагуляция и тромботические осложнения при гемолитических анемиях».. 94 (11). Haematologica. Дои:10.3324 / haematol.2009.013672. Получено 2 мая 2020. Цитировать журнал требует
| журнал =(Помогите) - ^ «Тромбообразование - триада Вирхова и типы тромбов». www.thrombosisadviser.com. Bayer AG. Получено 20 марта 2020.
- ^ Фьюри, Брюс; Фури, Барбара (2008). «Механизмы тромбообразования». Медицинский журнал Новой Англии. 359 (9): 938–49. Дои:10.1056 / NEJMra0801082. PMID 18753650.
- ^ а б c Harter, K .; Левин, М .; Хендерсон, С. О. (2015). «Антикоагулянтная лекарственная терапия: обзор». Западный журнал неотложной медицины. 16 (1): 11–17. Дои:10.5811 / westjem.2014.12.22933. ЧВК 4307693. PMID 25671002.
- ^ а б c d Уэлен, Карен; Финкель, Ричард С .; Панавелил, Томас А. (2015). Lippincott Illustrated Reviews: Фармакология (6-е изд.). Филадельфия: Вольтерс Клувер. ISBN 9781451191776. OCLC 881019575.
- ^ Саладин, Кеннет С. (2012). Анатомия и физиология: единство формы и функции (6-е изд.). Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. п. 710. ISBN 978-0-07-337825-1.
- ^ Fredriksson, L .; Лоуренс, Д. А .; Медкалф, Р. Л. (2016). "Модуляция TPA гематоэнцефалического барьера: объединяющее объяснение плейотропных эффектов tPA в ЦНС?". Семинары по тромбозу и гемостазу. 43 (2): 154–168. Дои:10.1055 / с-0036-1586229. ЧВК 5848490. PMID 27677179.
- ^ Медкалф, Р. (2011). «Тромболизис на основе активации плазминогена при ишемическом инсульте: разнообразие мишеней может потребовать новых подходов». Текущие цели в отношении лекарств. 12 (12): 1772–1781. Дои:10.2174/138945011797635885. PMID 21707475.
- ^ Будзинский, А. З. (1991). «Взаимодействие гементина с фибриногеном и фибрином». Свертывание крови и фибринолиз: международный журнал по гемостазу и тромбозу. 2 (1): 149–52. Дои:10.1097/00001721-199102000-00022. PMID 1772982.
- ^ Кумар, Винай; и другие. (2007). Базовая патология Роббинса (8-е изд.). Филадельфия: Сондерс / Эльзевьер. ISBN 978-1-4160-2973-1.
внешняя ссылка
- Лечение и симптомы сгустков крови -- MDhealthnetwork.org, Медицинский информационный ресурс, 1999 г.
- Североамериканский форум по тромбозу - NATF - некоммерческая организация, занимающаяся продвижением исследований, профилактики и обучения тромбозов, государственной политики и пропаганды.
- Препараты, расслабляющие мышцы, уменьшают образование тромбов со смертельным исходом
- Загрязнение воздуха вызывает образование тромбов - исследование США.
- Национальный альянс по тромбозам и тромбофилии - содержит обширные рассказы пациентов и членов их семей о жизни с тромбозом и тромбофилией, собрал часто задаваемые вопросы и создал публикации, посвященные конкретным проблемам с тромбами.
| Классификация |
|---|



