Поверхность Ван-дер-Ваальса - Van der Waals surface
Эта статья нужны дополнительные цитаты для проверка. (Июль 2011 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Эта научная статья требует дополнительных цитаты к вторичные или третичные источники (Июнь 2015 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Элемент | радиус (Å ) |
|---|---|
| Водород | 1.2 (1.09)[1] |
| Углерод | 1.7 |
| Азот | 1.55 |
| Кислород | 1.52 |
| Фтор | 1.47 |
| Фосфор | 1.8 |
| Сера | 1.8 |
| Хлор | 1.75 |
| Медь | 1.4 |
| Радиусы Ван-дер-Ваальса взяты из Сборник Бонди (1964).[2] Значения из других источников могут существенно различаются (см текст) | |
В поверхность Ван-дер-Ваальса из молекула представляет собой абстрактное представление или модель этой молекулы, показывающую, где, в очень грубом выражении, может располагаться поверхность молекулы, на основе жестких отсечений радиусы Ван-дер-Ваальса для отдельных атомов, и он представляет собой поверхность, через которую молекула может рассматриваться как взаимодействующая с другими молекулами.[нужна цитата ] Также упоминается как конверт ван дер Ваальса поверхность Ван-дер-Ваальса названа в честь Йоханнес Дидерик ван дер Ваальс, голландский физик-теоретик и термодинамик, который разработал теорию, чтобы обеспечить уравнение состояния жидкость-газ что объясняет ненулевой объем атомов и молекул, и на их проявление сила притяжения когда они взаимодействовали (теоретические конструкции, которые также носят его имя). Таким образом, поверхности Ван-дер-Ваальса являются инструментом, используемым в абстрактных представлениях молекул, независимо от того, были ли они доступны, как это было изначально, с помощью ручных расчетов или с помощью физических моделей дерева / пластика, или теперь в цифровом виде, с помощью вычислительная химия программного обеспечения. Практически говоря, Модели CPK, разработан и назван в честь Роберт Кори, Линус Полинг, и Вальтер Колтун,[3] были первыми широко используемыми физическими молекулярными моделями, основанными на радиусах Ван-дер-Ваальса, и позволили широко использовать в педагогических и исследовательских целях модель, показывающую ван-дер-ваальсовы поверхности молекул.
Объем Ван-дер-Ваальса и площадь ван-дер-Ваальса

С концепцией названия связаны идеи объем Ван-дер-Ваальса, Vш, а площадь поверхности Ван-дер-Ваальса, сокращенно Aш, vdWSA, VSA и WSA.[нужна цитата ] Площадь поверхности Ван-дер-Ваальса - это абстрактное понятие площади поверхности атомов или молекул на основе математической оценки, вычисляемой либо из первых принципов, либо путем интегрирования по соответствующему ван-дер-ваальсовому объему. В простейшем случае для сферического одноатомного газа это просто вычисленная площадь поверхности сферы с радиусом, равным ван-дер-ваальсовому радиусу газообразного атома:
.
В объем Ван-дер-Ваальса, тип атомный или же молекулярный объем, это свойство, непосредственно связанное с радиус Ван-дер-Ваальса, и определяется как объем, занимаемый отдельным атомом или, в совокупности, всеми атомами молекулы. Его можно рассчитать для атомов, если известен ван-дер-ваальсов радиус, и для молекул, если известны радиусы атомов, межатомные расстояния и углы. Как и выше, в простейшем случае для сферического одноатомного газа Vш - это просто вычисленный объем сферы радиуса, равного ван-дер-ваальсовому радиусу газового атома:
.
Для молекулы Vш объем, заключенный поверхность Ван-дер-Ваальса; следовательно, вычисление Vш предполагает способность описывать и вычислять поверхность Ван-дер-Ваальса. Ван-дер-Ваальсовы объемы молекул всегда меньше суммы ван-дер-ваальсовых объемов составляющих их атомов, из-за того, что межатомные расстояния, возникающие из химическая связь меньше суммы атомных ван-дер-ваальсовых радиусов. В этом смысле поверхность Ван-дер-Ваальса гомоядерный двухатомный Молекулу можно рассматривать как графическое перекрытие двух сферических ван-дер-ваальсовых поверхностей отдельных атомов, а также для более крупных молекул, таких как метан, аммиак и т. д. (см. изображения).
Радиусы и объемы Ван-дер-Ваальса могут быть определены из механических свойств газов (первоначальный метод, определяющий постоянная Ван-дер-Ваальса ), от критическая точка (например, жидкости), от кристаллографический измерения расстояния между парами несвязанных атомов в кристаллах или измерения электрических или оптических свойств (т. е. поляризуемость или же молярная рефракция ). Во всех случаях измерения проводятся на макроскопических образцах, и результаты выражаются как коренной зуб количества. Ван-дер-ваальсовы объемы отдельного атома или молекул достигаются путем деления макроскопически определенных объемов на Константа Авогадро. Различные методы дают значения радиуса, которые похожи, но не идентичны - обычно в пределах 1-2Å (100–200 вечера ). Полезные табличные значения радиусов Ван-дер-Ваальса получаются путем взятия средневзвешенное значение ряда различных экспериментальных значений, и по этой причине в разных таблицах будут представлены разные значения ван-дер-ваальсового радиуса одного и того же атома. Также утверждалось, что радиус Ван-дер-Ваальса не является фиксированным свойством атома при любых обстоятельствах, скорее, он будет изменяться в зависимости от химического окружения атома.[2]
Галерея
Аммиак, NH3, заполнение пространства, представление Ван-дер-Ваала, азот (N) синим цветом, водород (H) белым.
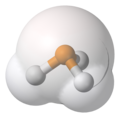
Фосфин, PH3, заполнение пространства, представление Ван-дер-Вааля, наложенная модель шара и палки, фосфор (P) в оранжевом, водород (H) в белом.
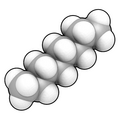
Модель заполнения пространства п-октан, прямая цепь (нормальная) углеводород состоит из 8 атомов углерода и 18 атомов водорода, формулы: CH3CH2(CH2)4CH2CH3 или же C
8ЧАС
18. Обратите внимание, что показанный представитель имеет Один конформационный "поза" популяции молекул, которые из-за низкой Энергия Гиббса препятствуют вращению углерод-углеродных связей (что придает углеродной «цепи» большую гибкость). обычно состоит из очень большого количества различных таких конформаций (например, в растворе).
Пример трехмерной, заполняющей пространство, основанной на Ван-дер-Ваале модели сложной молекулы, THC, активный агент медицинской марихуаны. Возможно, вам потребуется щелкнуть изображение, чтобы увидеть поворот.
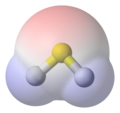
Сероводород, H2S, заполнение пространства, представление на основе Ван-дер-Ваала, наложенная модель шара и палки, сера (S) желтым цветом, водород (H) белым цветом, заштрихованными синим цветом. Он также показывает на его поверхности поверхность электростатического потенциала, вычислено для молекулы неизвестным способом,[нужна цитата ] с помощью вычислительная химия инструменты. Он закрашен синим цветом для электроположительный области для красного цвета электроотрицательный области.
Смотрите также
дальнейшее чтение
- Округ Колумбия Уитли, Графики поверхности Ван-дер-Ваальса и форма молекул, Журнал математической химии, Volume 23, Numbers 3-4, 1998, pp. 377–397 (21).
- М. Петижан, Об аналитическом расчете ван-дер-ваальсовых поверхностей и объемов: некоторые численные аспекты, Журнал вычислительной химии, Volume 15, Number 5, 1994, pp. 507–523.
Ссылки и примечания
- ^ Роуленд Р.С., Тейлор Р. (1996). «Межмолекулярные несвязанные контактные расстояния в органических кристаллических структурах: сравнение с расстояниями, ожидаемыми от радиусов Ван-дер-Ваальса». J. Phys. Chem. 100 (18): 7384–7391. Дои:10.1021 / jp953141 +.
- ^ а б Бонди, А. (1964). «Объемы и радиусы Ван дер Ваальса». J. Phys. Chem. 68 (3): 441–51. Дои:10.1021 / j100785a001.
- ^ Роберт Б. Кори и Линус Полинг, 1953, «Молекулярные модели аминокислот, пептидов и белков». Rev. Sci. Instrum., 24(8), pp. 621–627, DOI 10.1063 / 1.1770803, см. [1], по состоянию на 23 июня 2015 г.
внешняя ссылка
- VSA для различных молекул Антона Антонова, Демонстрационный проект Wolfram, 2007.
- Радиусы Ван-дер-Ваальса, Глоссарий структурной биологии, Библиотека изображений биологических макромолекул.
- Аналитический расчет поверхностей и объемов Ван-дер-Ваальса.







