Оксим ацетона - Acetone oxime
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-пропанон оксим | |
| Другие имена Ацетоксим; N-Гидрокси-2-пропанимин; Метилметилкетоксим | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.004.383 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C3ЧАС7NО | |
| Молярная масса | 73.095 г · моль−1 |
| Внешность | Белая игла, как кристаллы |
| Плотность | 0,901 г / мл[1] |
| Температура плавления | От 60 до 63 ° C (от 140 до 145 ° F, от 333 до 336 K) |
| Точка кипения | 135 ° С (275 ° F, 408 К) |
| 330 г / л (20 ° С) | |
| -44.42·10−6 см3/ моль | |
| Опасности | |
| Главный опасности | Может быть вреден при проглатывании |
| Пиктограммы GHS |     |
| Сигнальное слово GHS | Опасность |
| H228, H302, H317, H318, H351 | |
| P201, P202, P210, P240, P241, P261, P264, P270, P272, P280, P281, P301 + 312, P302 + 352, P305 + 351 + 338, P308 + 313, P310, P321, P330, P333 + 313, P363, P370 + 378, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 60 ° С (140 ° F, 333 К) |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 4000 мг / кг внутрибрюшинно - мышь |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
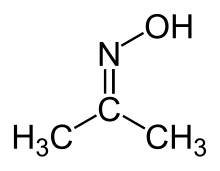
Оксим ацетона (ацетоксим) это органическое соединение по формуле (CH3)2CNOH. Это простейший пример кетоксим. Это белое кристаллическое твердое вещество, растворимое в воде, этаноле, эфире, хлороформе и лигроине. Он используется как реагент в органический синтез.[2]
Оксим ацетона (ацетоксим) был впервые получен и назван в 1882 году немецким химиком. Виктор Мейер и его швейцарский ученик Алоис Жанни.[3]
Подготовка
Оксим ацетон синтезируется конденсацией ацетон и гидроксиламин в присутствии HCl:[4][2]
- (CH3)2CO + H2NOH → (CH3)2CNOH + H2О
Его также можно создать с помощью аммоксидирование ацетона в присутствии перекиси водорода.[5]
Использует
Ацетоноксим - отличный ингибитор коррозии (раскислитель) с меньшей токсичностью и большей стабильностью по сравнению с обычным агентом. гидразин. Он также полезен при определении кетонов, кобальта и в органическом синтезе.[6]
Рекомендации
- ^ Каталог химикатов Sigma-Aldrich «Ацетоноксим». Получено 2 сентября 2016.
- ^ а б Стивен М. Вайнреб, Кристина Борстник "Ацетоноксим" e-EROS Энциклопедия реагентов для органического синтеза, 2007. Дои:10.1002 / 047084289X.rn00765
- ^ Мейер, Виктор; Дженни, Алоис (1882). "Ueber die Einwirkung von Hydroxylamin auf Aceton" [О действии гидроксиламина на ацетон]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 15: 1324–1326. Дои:10.1002 / cber.188201501285. С п. 1324: "Die Substanz, welche wir, wegen ihrer nahen Beziehungen zur Acetoximsäure, und da sie keine sauren Eigenschaften besitzt, vorläufig Acetoxim nennen wollen,…" (Вещество, которое мы - из-за его близкого родства с ацетоксимовой кислотой и поскольку оно не обладает кислотными свойствами - в настоящее время назовем «ацетоксим»…)
- ^ Справочник по химии и физике «Ацетоноксим». Получено 23 апреля 2014.
- ^ Синьхуа Лян, Чжентао Ми, Якуань Ван, Ли Ван, Сянвен Чжан "Синтез оксима ацетона посредством аммоксимации ацетона над TS-1", Письма о кинетике и катализе реакции, том 82, стр. 333-337. [1].
- ^ Свойства ацетоноксима, дополнительный текст.

