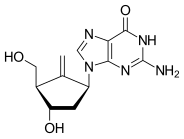
Карбоциклический нуклеозид - Carbocyclic nucleoside

Карбоциклические нуклеозиды (также называемые карбануклеозидами) являются нуклеозид аналоги, в которых метиленовая группа заменил атом кислорода фураноза звенеть.[1]Эти аналоги имеют азотистое основание присоединены к простому алкильному углероду, а не являются частью полуаминальный эфир связь. В результате они обладают повышенной химической стабильностью. Они также обладают повышенной метаболической стабильностью, поскольку не подвержены влиянию фосфорилазы и гидролазы которые раскалывают гликозидная связь между азотистым основанием и фуранозным кольцом нуклеозидов. Они сохраняют многие биологические свойства исходных нуклеозидов в отношении распознавания различными ферментами и рецепторами.
Карбоциклические нуклеозиды первоначально были ограничены пятичленной кольцевой системой, соответствующей размеру кольца нуклеозидов; однако этот термин был расширен до трех-, четырех- и шестичленных колец.[2][3][4]

Натуральные продукты


5-членное кольцо карбоциклических нуклеозидов аристеромицин, аналог аденозин, и непланоцин А, циклопентен аналог аристеромицина, были выделены из природных источников. Оба они демонстрируют значительные биологическая активность как противовирусные и противоопухолевые средства.[1]
Классы
Большое количество новых карбоциклических нуклеозидов пиримидины и пурины были приготовлены, и многие из этих соединений обладают интересной биологической активностью.
Пиримидин карбоциклические нуклеозиды


Циклопентенилцитозин (CPE-C) был разработан как мощное противоопухолевое и противовирусное средство (испытания 1 фазы).[5] и продемонстрировал мощную антиортопоксвирусную активность, а также активность против вируса Западного Нила.[3] Карбоциклический (E) -5- (2-бромовинил) -2-дезоксиуридин ((+) C-BVDU) GR95168 обладает активностью против Вирус простого герпеса тип l (HSV-1) и вирус ветряной оспы (VZV, ветряная оспа и опоясывающий лишай) in vitro и in vivo.[6]
Карбоциклические нуклеозиды пурина
Два гуаниновых противовирусных карбоциклических нуклеозида, анти-ВИЧ агент абакавир и анти-гепатит Б агент энтекавир, находятся ингибиторы обратной транскриптазы. Абакавир, был разработан из рацемический (±) -карбовир, о котором сообщил в 1988 г. Роберт Винс в качестве первого аналога карбоциклических нуклеозидов, демонстрирующего сильную активность против ВИЧ с низкой цитотоксичностью.[7] (-) энантиомер Позднее было показано, что карбовир является биологически активной формой ингибирования ВИЧ.[8] Однако низкая растворимость карбовира в воде и низкая биодоступность при пероральном приеме, а также неэффективное проникновение в центральную нервную систему препятствовали его дальнейшему развитию в качестве средства против ВИЧ. Эти трудности были преодолены путем исследования пролекарство аналоги (-) карбовира, которые приводят к 6-циклопропиламино-2-аминопуриннуклеозиду абакавиру,[9] который был одобрен в 1998 году FDA для лечения ВИЧ-инфекции.
- Противовирусные карбоциклические пуриновые нуклеозиды

(-) Карбовир

Карбоциклический 2'-ара-фтор-гуанозин
Энтекавир, а гуанозин аналог, о котором сообщалось в 1997 году как о сильном и селективном ингибиторе вирус гепатита В,[10] и одобрено FDA в марте 2005 г. для перорального лечения инфекции гепатита В. Фторкарбоциклический нуклеозид карбоциклический 2'-ара-фтор-гуанозин был описан в 1988 году как первый пример карбоциклического аналога неприродного нуклеозида, который проявляет большую антигерпетическую активность против герпесвирусы ВПГ-1 и ВПГ-2 in vitro, чем его родительская фураноза.[11]
Синтез
При синтезе карбоциклических нуклеозидов используются два подхода.[12] Линейные подходы к хиральным карбоциклическим нуклеозидам 2 полагаться на построение гетероциклического основания на подходящий защищенный хиральный циклопентиламин (1 → 2). В конвергентном подходе интактное гетероциклическое основание непосредственно связано с соответствующим образом защищенным функционализированным карбоциклическим фрагментом (3 → 2).

История
- 1966: Впервые описан синтез рацемического (±) карбоциклического аналога аденозина.[13]
- 1968: (-) энантиомер, названный аристеромицином. был выделен как метаболит Streptomyces citricolor.[14]
- 1981: Выделение карбоциклических нуклеозидов семейства непланоцинов и, в частности, циклопентенильного производного непланоцина А из Ampukwiella regularis [15]
- 1983: Первый энантиоспецифический синтез (-) аристеромицина и (-) непланоцина A [16]
- 1986: Первый всесторонний обзор карбоциклических нуклеозидов, включая линейный химический синтез и биологические свойства этих ранних рацемических аналогов и природных продуктов - аристеромицина и непланоцина А.[1]
- 1988: Синтезирован первый фторкарбоциклический нуклеозид C-AFG, который был в 1000 раз более активен, чем родительский нуклеозид фуранозы, против HSV-1 и HSV-2 in vitro.[11]
- 1988: Обзор синтеза фторокарбоциклических нуклеозидов Glaxo [17]
- 1988: (±) -Карбовир впервые сообщил о высокой активности против ВИЧ и низкой цитотоксичности. [7]
- 1992: Первый всесторонний обзор синтеза хиральных карбоциклических нуклеозидов.[12]
- 1994: Обзор рацемических циклопентилкарбоциклических нуклеозидов [18] был расширен за счет включения биоактивности карбоциклических нуклеозидов в 1998 г. [19]
- 1997: Сообщается об абакавире, пролекарстве (-) карбовира,[9] одобрен FDA в декабре 1998 г. для лечения ВИЧ-инфекции под торговой маркой Ziagen ™.
- 1997: Первое сообщение об энтекавире (BMS-200475) как мощном и селективном ингибиторе гепатита B,[10] одобрен FDA в марте 2005 г. для перорального лечения инфекции гепатита В. торговые наименования Baraclude или Entaliv.
- 1998: Обзор новых разработок в области энантиоселективного синтеза циклопентилкарбоциклических нуклеозидов.[20]
- 2003: Обзор новых достижений в энантиоселективном синтезе и биологических свойствах карбоциклических нуклеозидов, включая 3, 4 и 6-членные карбоциклические кольца.[4]
- 2011: Обзор охватывает самые последние достижения в области синтеза и биологической активности карбоциклических нуклеозидов до сентября 2010 года.[3]
- 2013: Два обзора наиболее представительных методов асимметричного синтеза карбоциклических нуклеозидов с 1998 года [21][22]
- 2014: Обзор синтеза карбоциклических нуклеозидов с участием метатезиса с замыканием цикла (RCM) в качестве ключевого этапа.[23]
Рекомендации
- ^ а б c Маркес В.Е., Лим М.И. (январь 1986 г.). «Карбоциклические нуклеозиды». Обзоры медицинских исследований. 6 (1): 1–40. Дои:10.1002 / med.2610060102. PMID 3512934. S2CID 221956841.
- ^ Чжу XF (март 2000 г.). «Последние достижения в синтезе карбоциклических нуклеозидов». Нуклеозиды, нуклеотиды и нуклеиновые кислоты. 19 (3): 651–690. Дои:10.1080/15257770008035015. PMID 10843500. S2CID 43360920.
- ^ а б c Ван Дж; Равал РК; Чу СК (август 2011). «Последние достижения в области карбоциклических нуклеозидов: синтез и биологическая активность». В L.-H. Чжан, З. Си и Дж. Чаттопадхьяя (ред.). Лечебная химия нуклеиновых кислот. Хобокен: Джон Уайли и сыновья. стр.1 –100. ISBN 9780470596685.
- ^ а б Родргес Дж. Б., Комин М. Дж. (Март 2003 г.). «Новые достижения в энантиоселективном синтезе и биологических свойствах карбоциклических нуклеозидов». Мини-обзоры по медицинской химии. 3 (2): 95–114. Дои:10.2174/1389557033405331. PMID 12570843.
- ^ Маркес, В. Э. (апрель 1996 г.). «КАРБКЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ». В Э. Де Клерк (ред.). Достижения в разработке противовирусных препаратов. 2. JAI Press Inc., стр. 89–146. ISBN 1-55938-693-2.
- ^ Кэмерон Дж. М. (декабрь 1993 г.). «Новые антигерпесные препараты в разработке». Обзоры в медицинской вирусологии. 3 (4): 225–236. Дои:10.1002 / rmv.1980030406.
- ^ а б Винс Р., Хуа М., Браунелл Дж., Далуге С., Ли Ф., Шеннон В. М., Лавел Дж. К., Куаллс Дж., Вейслоу О.С., Кисер Р., Канонико PG (октябрь 1988 г.) «Сильная и селективная активность нового аналога карбоциклических нуклеозидов (карбовир: NSC 614846) против вируса иммунодефицита человека in vitro». Сообщения о биохимических и биофизических исследованиях. 156 (2): 1046–1053. Дои:10.1016 / S0006-291X (88) 80950-1. PMID 2847711.CS1 maint: использует параметр авторов (связь)
- ^ Картер С.Г., Кесслер Дж. А., Ранкин К.Д. (июнь 1990 г.). «Активность (-) - карбовира и 3'-азидо-3'-дезокситимидина против вируса иммунодефицита человека in vitro». Противомикробные препараты и химиотерапия. 34 (6): 1297–1300. Дои:10.1128 / AAC.34.6.1297. ЧВК 171808. PMID 2393292.CS1 maint: использует параметр авторов (связь)
- ^ а б Daluge SM, Good SS, Faletto MB, Miller WH, St Clair MH, Boone LR, Tisdale M, Parry NR, Reardon JE, Dornsife RE, Averett DR (май 1997 г.). «1592U89, новый аналог карбоциклического нуклеозида с сильной избирательной активностью против вируса иммунодефицита человека». Противомикробные препараты и химиотерапия. 41 (5): 1082–1093. Дои:10.1128 / AAC.41.5.1082. ЧВК 163855. PMID 9145874.
- ^ а б Bisacchi GS, Chao ST, Bachard C, Daris JP, Innaimo S, Jacobs GA, Kocy O, Lapointe P, Martel A, Merchant ZL, Slusarchyk WA (январь 1997 г.). «BMS-200475, новый карбоциклический аналог 2'-дезоксигуанозина с сильной и селективной активностью против вируса гепатита B in vitro». Письма по биоорганической и медицинской химии. 7 (2): 127–132. Дои:10.1016 / S0960-894X (96) 00594-X.
- ^ а б Borthwick AD, Butt S, Biggadike K, Exall AM, Робертс SM, Youds PM, Kirk BE, Booth BR, Cameron JM, Cox SW, Marr CL (1988). «Синтез и ферментативное разделение карбоциклических 2-ара-фтор-гуанозин: новое мощное противогерпетическое средство ». Журнал химического общества, химические коммуникации (10): 656–658. Дои:10.1039 / C39880000656.
- ^ а б Borthwick AD, Biggadike K (1992). «Синтез хиральных карбоциклических нуклеозидов». Тетраэдр. 48 (4): 571–623. Дои:10.1016 / S0040-4020 (01) 88122-9.
- ^ Шили YF, Клейтон JD (август 1966). «9- [β-DL-2α, 3α-дигидрокси-4β- (гидроксиметил) циклопентил] аденин, карбоциклический аналог аденозина». Журнал Американского химического общества. 88 (16): 3885–3887. Дои:10.1021 / ja00968a055.
- ^ Кусака Т., Ямамото Х., Шибата М., Мурои М., Киши Т., Мидзуно К. (1968). «Streptomyces citricolor nov. Sp. И новый антибиотик аристеромицин». Журнал антибиотиков. 21 (4): 255–263. Дои:10.7164 / антибиотики.21.255. PMID 5671989.
- ^ Ягинума С., Муто Н., Цуджино М., Судате Ю., Хаяси М., Отани М. (1981). «Исследования непланоцина А, нового противоопухолевого антибиотика. I. Организм-продуцент, выделение и характеристика». Журнал антибиотиков. 34 (4): 359–366. Дои:10.7164 / антибиотики. 34.359. PMID 7275815.
- ^ Арита М., Адачи К., Ито Й, Савай Х, Оно М. (июнь 1983 г.). «Энантиоселективный синтез карбоциклических нуклеозидов (-) - аристеромицин и (-) - непланоцин А с помощью химико-ферментативного подхода». Журнал Американского химического общества. 105 (12): 4049–4055. Дои:10.1021 / ja00350a050.
- ^ Робертс С.М.; Biggadike K; Borthwick AD; Кирк BE (1988). «Синтез некоторых противовирусных карбоциклических нуклеозидов». В П. Р. Лиминге (ред.). Темы медицинской химии. Лондон: Королевское химическое общество. С. 172–188. ISBN 0-85186-726-X.
- ^ Agrofoglio L, Suhas E, Farese A, Condom R, Challand SR, Earl RA, Guedj R (декабрь 1994 г.). «Синтез карбоциклических нуклеозидов». Тетраэдр. 50 (36): 10611–10670. Дои:10.1016 / S0040-4020 (01) 89258-9.
- ^ Agrofoglio LA; Challand SR (1998). «Химия карбоциклических нуклеозидов, Биологическая активность карбоциклических нуклеозидов». В Agrofoglio LA, Challand SR (ed.). Ациклические, карбоциклические и L-нуклеозиды. Дордрехт: Kluwer Academic Publishers. С. 174–284. ISBN 978-94-010-3734-1.
- ^ Crimmins MT (август 1998 г.). «Новые разработки в энантиоселективном синтезе циклопентилкарбоциклических нуклеозидов». Тетраэдр. 54 (32): 9229–9272. Дои:10.1016 / S0040-4020 (98) 00320-2.
- ^ Leclerc E (февраль 2013 г.). «Химический синтез карбоциклических аналогов нуклеозидов». Химический синтез аналогов нуклеозидов. Хобокен: Джон Уайли и сыновья. С. 535–604. Дои:10.1002 / 9781118498088.ch12. ISBN 9781118498088.
- ^ Бутурейра О., Матеу М.И., Диас И., Кастильон С. (март 2013 г.). «Успехи в энантиоселективном синтезе карбоциклических нуклеозидов». Обзоры химического общества. 42 (12): 5056–5072. Дои:10.1039 / C3CS00003F. PMID 23471263.
- ^ Муламоттил В.А., Наяк А., Чон Л.С. (июль 2014 г.). «Последние достижения в синтезе карбоциклических нуклеозидов через метатезис с замыканием кольца». Азиатский журнал органической химии. 3 (7): 748–761. Дои:10.1002 / ajoc.201402032.