Этилацетоацетат - Ethyl acetoacetate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Этил 3-оксобутаноат | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.015 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1993 |
| |
| |
| Характеристики | |
| C6ЧАС10О3 | |
| Молярная масса | 130,14 г / моль |
| Внешность | Бесцветная жидкость |
| Запах | Фрукты или же ром |
| Плотность | 1,021 г / см3, жидкость |
| Температура плавления | -45 ° С (-49 ° F, 228 К) |
| Точка кипения | 180,8 ° С (357,4 ° F, 453,9 К) |
| 2.86 г / 100 мл (20 ° C) | |
| Кислотность (пKа) |
|
| −71.67×10−6 см3/ моль | |
| Опасности | |
Классификация ЕС (DSD) (устарело) | Нет в списке |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 70 ° С (158 ° F, 343 К) |
| Родственные соединения | |
Связанный сложные эфиры | |
Родственные соединения | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В органическое соединение этилацетоацетат (EAA) это этил сложный эфир из ацетоуксусная кислота. В основном используется как химический промежуточный продукт в производстве самых разных компаундов, таких как аминокислоты, анальгетики, антибиотики, противомалярийные препараты, антипирин и аминопирин, и витамин B1; а также изготовление красители, чернила, лаки, духи, пластмассы, и желтый краска пигменты. В одиночку он используется как ароматизатор за еда.
Подготовка
Этилацетоацетат получают промышленным способом путем обработки дикетен с этанолом.[1]
Приготовление этилацетоацетата - классическая лабораторная процедура.[2] Готовится через Клейзеновская конденсация из ацетат этила. Два моля ацетат этила конденсируются с образованием по одному моль этилацетоацетата и этиловый спирт.
Реактивность
Этилацетоацетат подлежит кето-енольная таутомерия. В чистой жидкости при 33 ° C енол составляет 15% от общего количества.[3]
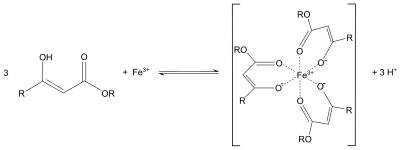
Этилацетоацетат часто используется в синтез эфира ацетоуксусной кислоты похожий на диэтилмалонат в синтез эфира малоновой кислоты или Конденсация Кневенагеля. Протоны альфа к карбонильные группы являются кислыми, и образовавшийся карбанион может подвергаться нуклеофильное замещение. Последующий термическое декарбоксилирование тоже возможно.[4] Подобно поведению ацетилацетон, енолят этилацетоацетата также может служить бидентатным лигандом. Например, образует фиолетовый координационные комплексы с солями железа (III):
Этилацетоацетат также можно восстановить до этил-3-гидроксибутирата.
Этилацетоацетат при нагревании (без катализатора) с бензиловым спиртом образует синтетически полезный бензилацетоацетат (бензильные группы легко удаляются позже каталитическим гидрогенолизом над Pd / C в нейтральных условиях) через механизм, включающий ацетилкетен. Этил (и другие) ацетоацетатнитрозат легко с эквимолярным нитритом натрия в уксусной кислоте с получением соответствующих эфиров оксиминоацетоацетата. Восстановление их растворением цинка в уксусной кислоте в присутствии кетоэфиров или бета-дикетонов составляет синтез пирролов по Кнорру, полезных для синтеза порфиринов.
Смотрите также
- Фруктон, этиленгликолькеталь этилацетоацетата, ароматическое соединение
Рекомендации
- ^ Вильгельм Рименшнайдер и Герман М. Болт "Сложные органические эфиры" Энциклопедия промышленной химии Ульмана 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a09_565.pub2
- ^ Дж. К. Х. Инглис и К. К. Робертс (1926). «Этилацетоацетат». Органический синтез.; Коллективный объем, 1, п. 235
- ^ Джейн Л. Бёрдетт; Макс Т. Роджерс (1964). «Кето-енольная таутомерия в β-дикарбонилах, изученная с помощью спектроскопии ядерного магнитного резонанса. I. Протонные химические сдвиги и константы равновесия чистых соединений». Варенье. Chem. Soc. 86: 2105–2109. Дои:10.1021 / ja01065a003.
- ^ Кэри, Фрэнсис А. (2006). Органическая химия (Шестое изд.). Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. ISBN 0-07-111562-5.