Контрольная точка повреждения ДНК G2-M - Википедия - G2-M DNA damage checkpoint

В г2-M Контрольная точка повреждения ДНК это важный контрольная точка клеточного цикла в эукариотический организмов, что гарантирует, что клетки не инициируют митоз пока поврежденная или не полностью реплицированная ДНК не будет восстановлена в достаточной степени. Ячейки с дефектным G2-M контрольная точка, если они входят в фазу M до восстановления своей ДНК, это приводит к апоптоз или смерть после деления клеток.[1] Определяющим биохимическим признаком этой контрольной точки является активация M-фаза комплексы циклин-ЦДК, которые фосфорилируют белки, способствующие шпиндель сборку и довести ячейку до метафаза.[2]
Циклин B-CDK 1 Активность
В клеточный цикл управляется белками, называемыми циклинзависимые киназы которые связаны с циклин регуляторные белки на разных контрольных точках клеточного цикла. На разных фазах клеточного цикла происходит активация и / или дезактивация специфических комплексов циклин-CDK.
Активность CyclinB-CDK1 специфична для контрольной точки G2 / M. Накопление циклин B увеличивает активность циклинзависимой киназы Cdk1, гомолог человека Cdc2 поскольку клетки готовятся вступить в митоз. Активность Cdc2 дополнительно регулируется фосфорилирование /дефосфорилирование соответствующих активаторов и ингибиторов. Через положительный отзыв петля, CyclinB-Cdc2 активирует фосфатазу Cdc25 что, в свою очередь, дезактивирует ингибиторы CyclinB-Cdc2, Wee1 и Myt1. Cdc25 активирует комплекс путем удаления фосфатов из активного центра, в то время как Wee1 инактивирует комплекс посредством фосфорилирования остатков тирозина, в частности тирозина-15.[3]
Эта петля дополнительно косвенно усиливается через скоординированное взаимодействие Киназа Aurora A и кофактор Бора. В течение Фаза G2, Bora накапливается и образует комплекс активации с Aurora A. Этот комплекс затем регулирует активацию Поло-подобная киназа 1 (Plk1). Plk1 фосфорилирует Wee1, направляя его на деградацию посредством комплекса убиквитинлигазы SCF (СКФ комплекс ) и активирует Cdc25 посредством фосфорилирования с комбинированным действием, активируя Cdc2. Комбинированная активность и комплекс Cdc2, Cdc25 и Plk1 с накоплением циклина B активирует комплекс CyclinB-Cdc2, способствуя вступлению в митоз.[4]
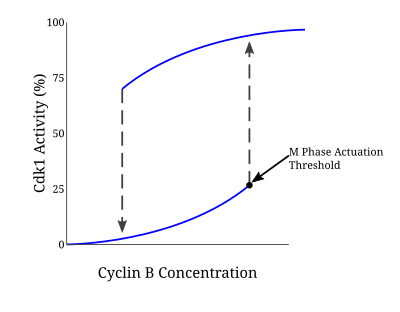
Многие белки, участвующие в этой петле положительной обратной связи, управляют активацией комплекса CyclinB-Cdc2, потому что вступление в митоз требует реакции типа "все или ничего". В Модель Новака-Тайсона представляет собой математическую модель, используемую для объяснения такой регуляторной петли, которая предсказала необратимый переход в митоз, вызванный гистерезисом.[5]Через эксперименты в Xenopus laevis бесклеточные экстракты яиц, такая модель была подтверждена как основа для вступления в митоз. Как только концентрация циклина достигает определенного минимального порога активации, Cdc2 быстро активируется. Он остается в этом состоянии до тех пор, пока активность не упадет ниже отдельного порога инактивации, при котором он внезапно инактивируется посредством фосфорилирования тирозина Wee1 и Myt1. В случае нереплицированной ДНК порог концентрации циклина для активации Cdc2 дополнительно увеличивается. Благодаря этому механизму существует два отдельных стационарных состояния, разделенных нестабильным устойчивым состоянием. Бистабильный и гистерезисный характер CyclinB-Cdc2 обеспечивает строго регулируемый характер контрольной точки G2 / M.[6]
Реакция пути на повреждение ДНК
Белки, которые локализуются в участках повреждения ДНК в фазе G2, инициируют сигнальный каскад, который регулирует важные компоненты пути, как описано выше, таким образом контролируя вход в митоз посредством активности CyclinB-Cdc2. Отрицательная регуляция активности CyclinB-Cdc2 приводит к задержке митотического входа, что важно для клеток для восстановления любых повреждений ДНК, которые могли накопиться после Фаза S и необходимо перед продолжением деления клеток.
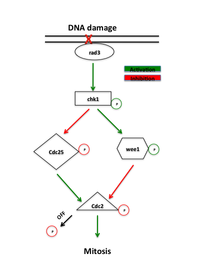
Белки, которые функционируют в контрольной точке G2-M, были первоначально идентифицированы в дрожжевых скринингах, которые искали мутанты, проявляющие повышенную чувствительность к радиации, названные мутантами «rad».[1] Неэффективная репарация ДНК, поврежденная ионизирующим излучением или химическими агентами у этих мутантов, выявила белки, необходимые для этого пути. Ранние сигнальные белки в пути контрольной точки являются членами семейства фосфатидилинозитол-3-киназ, rad3 у дрожжей и ATR у позвоночных, которые, как полагают, локализуются в местах повреждения ДНК.[7] Rad3 фосфорилирует rad26, который необходим для инициирования, но не для поддержания контрольной точки. Rad3 также фосфорилирует ряд других белков, отсутствие которых отменяет репарацию ДНК контрольных точек, включая rad1, rad9, hus1 и rad17.[1] Было высказано предположение, что rad9, hus1 и rad17 похожи на белки, участвующие в формировании зажима, который увеличивает процессивность из ДНК-полимераза в течение Репликация ДНК.[8] В соответствии с этой идеей, rad17 похож на белки, участвующие в загрузке зажима на ДНК. Это поддерживает модель, в которой фосфорилирование с помощью rad3 вызывает рекрутирование этих белков в участки повреждения ДНК, где они опосредуют активность ДНК-полимераз, участвующих в Ремонт ДНК.[1]
Основным эффектором rad3 является киназа. Chk1, который необходим для остановки G2-M в ответ на повреждающие ДНК агенты.[9]Chk1 представляет собой эффекторную протеинкиназу, которая поддерживает митотический циклин в неактивном состоянии и фосфорилируется с помощью rad3 между фазой S и митозом, что указывает на его специфическую роль в остановке G2.[10]это усиление регулирования через чрезмерное выражение может вызывать арест независимо от повреждения ДНК.[11]Кроме того, избыточная экспрессия Chk1 устраняет радиационную чувствительность rad мутантов, по-видимому, позволяя репарации ДНК происходить до вступления в митоз.[7]
Наличие повреждения ДНК вызывает Банкомат (Мутировавшая атаксия телеангиэктазии) или ATR (Связанные с атаксией, телеангиэктазией и Rad3) пути, которые активируют киназы Chk2 и Chk1 соответственно. Эти киназы действуют выше Cdc25 и Wee1, прямых регуляторов комплекса CyclinB-Cdc2. Chk1 и Chk2 фосфорилируют Cdc25, ингибируя его фосфорилирующую активность и маркируя его для убиквитинированной деградации.[11][12]Эти пути также стимулируют супрессор опухолей. p53. p53 регулирует функцию ингибитора Cdk2 стр.21 и 14-3-3 белков которые фосфорилируют (и тем самым инактивируют) и секвестрируют Cdc25 в цитоплазме, соответственно.[13]Недавние исследования также подтвердили, что Cdk1 и 14-3-3 положительно регулируют Wee1 аналогичным образом. В гиперфосфорилирование Wee1 с помощью Cdk1 делает возможным связывание 14-3-3, секвестрируя Wee1 с ядром и усиливая его способность фосфорилировать Cdc2.[14] Фосфорилирование Wee1 и Cdc25 предотвращает активацию Cdc2.[12]
Путь ATM / ATR также приводит к негативной регуляции Plk1, что способствует стабильности Wee1. Стабилизация Wee1 и Myt1 обеспечивает остановку клеток в G2 и позволяет репарацию ДНК.[13][15]
Множественные пути участвуют в ответе контрольной точки и, таким образом, нацеливание на Cdc25 не является единственным механизмом, лежащим в основе задержки клеточного цикла, как предлагают некоторые модели. В сотрудничество между положительной регуляцией Wee1 и отрицательной регуляцией Cdc25 с помощью Chk1 в ответ на нереплицированную или поврежденную ДНК приводит к сильному аресту G2.[1][11][13][15] Увеличение количества Wee1 и уменьшение количества Cdc25 способствует увеличению порогового значения концентрации циклина B в петле гистерезиса, необходимого для приведения клетки в состояние митоза.
Обслуживание контрольно-пропускного пункта
Rad3 необходим для активации Chk1 и инициации ареста G2, но полагают, что различные белки поддерживают арест G2, так что может происходить достаточная репарация ДНК. Одним из таких белков является рад18 это необходимо для остановки G2, даже если Chk1 фосфорилирован и активен. Таким образом, rad18 требуется для обслуживания контрольной точки G2 / M, в то время как Chk1 требуется для запуска контрольной точки.[16] Это также подтверждается его дополнительной функцией в репарации ДНК, особенно в поддержании хромосомных структур. Его необходимость демонстрируется тем фактом, что в отсутствие rad18 ДНК не может быть восстановлена, даже когда задержка G2 продлевается другими способами.
Поддержание такого ареста в фазе G2 дополнительно поддерживается p53 и p21. В отсутствие p53 или p21 было продемонстрировано, что облученные клетки прогрессируют в митоз.[17] Отсутствие p21 или 14-3-3 не может в достаточной степени ингибировать комплекс CyclinB-Cdc2, таким образом демонстрируя регуляторный контроль p53 и p21 в контрольной точке G2 в ответ на повреждение ДНК.[12] Мутации p53 могут привести к значительному дефициту контрольных точек, что имеет важное значение для лечения рака.
Деактивация контрольной точки
Инактивация и то и другое Wee1 и Cdc25 отменяют контрольную точку повреждения ДНК G2-M. Отсутствие Wee1 или удаление сайта тирозина-15 устраняет негативную регуляцию активности Cdc2 и заставляет клетки входить в митоз без завершения репарации, что эффективно устраняет контрольную точку G2-M.[18] Отсутствие Cdc25 задерживает клетки в G2, но все же позволяет активировать контрольную точку G2-M, подразумевая, что и активация Wee1, и дезактивация Cdc25 являются важными регуляторными шагами в контрольной точке.[11]
Инактивации Chk1 достаточно, чтобы преодолеть контрольную точку и способствовать вступлению в митоз, независимо от того, исправлено ли повреждение ДНК. Тем не менее, до сих пор мало что известно о точном механизме завершения контрольной точки с возможными механизмами, включая протеинфосфатазы, обращающие активирующее фосфорилирование, целевое расщепление активирующих белков убиквитином и антагонисты контрольных точек, способствующие митозу независимыми путями.[10]
Рак
Было обнаружено, что многие регуляторы клеточного цикла, такие как Cdks, циклины и p53, имеют аномальную экспрессию при раке. Более конкретно, они вовлечены в переход G2 / M, локализуясь в центросоме, что, таким образом, приводит к исследованиям по манипулированию такими белками с целью улучшения чувствительности рака к радиации и химиотерапии.[13] Chk1 играет важную роль в нацеливании лекарств на рак, поскольку его функция действует в ответ на повреждение ДНК. Цитотоксические эффекты химиотерапии в настоящее время изучаются при модуляции перехода G2 / M, что касается как отмены контрольной точки, так и остановки контрольной точки.[19] Многие методы лечения сосредоточены на инактивации контрольной точки, чтобы заставить клетки с избыточным повреждением ДНК пройти митоз и вызвать гибель клеток.[12]
использованная литература
- ^ а б c d е Cuddihy, Эндрю Р .; О'Коннелл, Мэтью Дж. (2003). «Ответы клеточного цикла на повреждение ДНК в G2». Международный обзор цитологии. 222: 99–140. Дои:10.1016 / s0074-7696 (02) 22013-6. ISBN 9780123646262. ISSN 0074-7696. PMID 12503848.
- ^ Морган, Дэвид Оуэн, 1958- (2007). Клеточный цикл: принципы контроля. Лондон: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Gould, K. L .; Медсестра, П. (1989). «Фосфорилирование тирозина протеинкиназы cdc2 + делящихся дрожжей регулирует вступление в митоз». Природа. 342 (6245): 39–45. Bibcode:1989Натура 342 ... 39G. Дои:10.1038 / 342039a0. PMID 2682257.
- ^ Секи, А .; Coppinger, J. A .; Jang, C.-Y .; Yates, J. R .; Фанг, Г. (20 июня 2008 г.). «Бора и киназа Aurora A совместно активируют киназу Plk1 и контролируют митотический вход». Наука. 320 (5883): 1655–1658. Bibcode:2008Sci ... 320.1655S. Дои:10.1126 / science.1157425. ЧВК 2834883. PMID 18566290.
- ^ Новак, Б .; Тайсон, Дж. Дж. (1993). «Численный анализ комплексной модели контроля М-фазы в экстрактах ооцитов Xenopus и интактных эмбрионах». Журнал клеточной науки. 106: 1153–1168. PMID 8126097.
- ^ Ша, Вэй; и другие. (Сентябрь 2002 г.). «Гистерезис управляет переходами клеточного цикла в яичных экстрактах Xenopus laevis». Труды Национальной академии наук. 100 (3): 975–980. Bibcode:2003ПНАС..100..975С. Дои:10.1073 / pnas.0235349100. ЧВК 298711. PMID 12509509.
- ^ а б Аль-Ходайри, Ф .; Карр, А. М. (1992). «Мутанты репарации ДНК, определяющие пути контрольных точек G2 у Schizosaccharomyces pombe». Журнал EMBO. 11 (4): 1343–1350. Дои:10.1002 / j.1460-2075.1992.tb05179.x. ЧВК 556583. PMID 1563350.
- ^ Thelen, M. P .; Venclovas, C .; Фиделис, К. (1999). «Модель скользящего зажима для семейства Rad1 белков контрольной точки клеточного цикла». Ячейка. 96 (6): 769–770. Дои:10.1016 / s0092-8674 (00) 80587-5. PMID 10102265.
- ^ Walworth, N .; Davey, S .; Бич, Д. (1993). «Делящаяся дрожжевая протеинкиназа chkl связывает путь контрольной точки rad с cdc2». Природа. 363 (6427): 368–371. Bibcode:1993 Натур.363..368Вт. Дои:10.1038 / 363368a0. PMID 8497322.
- ^ а б Calonge, T. M .; О'Коннелл, М. Дж. (2007). «Отключение контрольной точки повреждения ДНК G2». Ремонт ДНК (Amst). 7 (2): 136–140. Дои:10.1016 / j.dnarep.2007.07.017. ЧВК 2233850. PMID 17851138.
- ^ а б c d Raleigh, J.M .; О'Коннелл, М. Дж. (2000). «Контрольная точка повреждения ДНК G (2) нацелена как на Wee1, так и на Cdc25». Журнал клеточной науки. 113 (10): 1727–1736. PMID 10769204.
- ^ а б c d Морган, Дэвид (2007). Принципы контроля клеточного цикла. New Science Press. С. 227–245.
- ^ а б c d Wang, Y .; Ji, P .; Liu, J .; Broaddus, R. R .; Xue, F .; Чжан, В. (2009). «Связанные с центросомами регуляторы контрольной точки G2 / M как мишени для лечения рака». Молекулярный рак. 8 (1): 8. Дои:10.1186/1476-4598-8-8. ЧВК 2657106. PMID 19216791.
- ^ Lee, J .; Кумагаи, А .; Данфи, В. Г. (2001). «Положительная регуляция Wee1 белками Chk1 и 14-3-3». Молекулярная биология клетки. 12 (3): 551–563. Дои:10.1091 / mbc.12.3.551. ЧВК 30963. PMID 11251070.
- ^ а б Харпер, Дж. В .; Элледж, С. Дж. (Декабрь 2007 г.). «Реакция на повреждение ДНК: десять лет спустя». Молекулярная клетка. 28 (5): 739–745. Дои:10.1016 / j.molcel.2007.11.015. PMID 18082599.
- ^ Verkade, H.M .; Bugg, S.J .; Lindsay, H.D .; Carr, A.M .; О'Коннелл, М. Дж. (1999). «Rad18 необходим для репарации ДНК и контрольных точек у делящихся дрожжей». Молекулярная биология клетки. 10 (9): 2905–2918. Дои:10.1091 / mbc.10.9.2905. ЧВК 25529. PMID 10473635.
- ^ Bunz, F .; Dutriaux, A .; Ленгауэр, С .; Waldman, T .; Чжоу, S .; Brown, J. P .; Sedivy, J.M .; Kinzler, K. W .; Волгестайн, Б. (1998). «Потребность в p53 и p21 для поддержания G2-ареста после повреждения ДНК». Наука. 282 (5393): 1497–1501. Дои:10.1126 / science.282.5393.1497. PMID 9822382.
- ^ Lundgren, K .; Walworth, N .; Booher, R .; Дембски, М .; Киршнер, М .; Бич, Д. (1991). «Mik1 и wee1 взаимодействуют в ингибирующем фосфорилировании тирозина cdc2». Ячейка. 64 (6): 1111–1122. Дои:10.1016/0092-8674(91)90266-2. PMID 1706223.
- ^ ДиПаола, Р. С. (2002). "Арестовать или не арестовывать клеточного цикла G2-M". Клинические исследования рака. 8 (11): 3311–3314.
