Иммунотерапия - Immunotherapy
Эта статья нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Апрель 2018 г.) |
Эта статья слишком полагается на Рекомендации к основные источники. (Апрель 2018 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Иммунотерапия | |
|---|---|
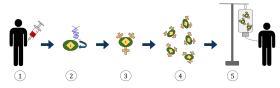 На приведенной выше диаграмме показан процесс Т-клеточной терапии химерного антигенного рецептора (CAR), это метод иммунотерапии, который становится все более распространенной практикой в лечении рака. Конечным результатом должно быть производство оснащенных Т-клеток, которые могут распознавать инфицированные раковые клетки в организме и бороться с ними.
| |
| MeSH | D007167 |
| Код ОПС-301 | 8-03 |
Иммунотерапия или же биологическая терапия лечение болезнь путем активации или подавления иммунная система. Иммунотерапия, предназначенная для вызова или усиления иммунного ответа, классифицируется как активационная иммунотерапия, в то время как иммунотерапия, уменьшающая или подавляющая, классифицируется как подавляющая иммунотерапия.
В последние годы иммунотерапия вызывает большой интерес у исследователей, клиницистов и Фармацевтические компании, особенно в его обещании лечить различные формы рак.[1][2][3]
Иммуномодулирующие схемы часто имеют меньше побочных эффектов, чем существующие препараты, в том числе меньший потенциал для создания сопротивление при лечении микробного заболевания.[4]
Клеточная иммунотерапия эффективна при некоторых видах рака. Иммунные эффекторные клетки, такие как лимфоциты, макрофаги, дендритные клетки, естественные клетки-киллеры (Ячейка NK), цитотоксические Т-лимфоциты (CTL) и т. Д. Работают вместе, чтобы защитить организм от рака, воздействуя на аномальные антигены, экспрессируемые на поверхности опухолевых клеток.
Такие методы лечения, как колониестимулирующий фактор гранулоцитов (G-CSF), интерфероны, имиквимод и фракции клеточных мембран из бактерии лицензированы для медицинского применения. Другие, включая Ил-2, Ил-7, Ил-12, разные хемокины, синтетические цитозинфосфат-гуанозиновые (CpG) олигодезоксинуклеотиды и глюканы участвуют в клинических и доклинических исследованиях.
Иммуномодуляторы
Иммуномодуляторы - активные агенты иммунотерапии. Это разнообразные рекомбинантные, синтетические и натуральные препараты.
| Учебный класс | Примеры агентов |
|---|---|
| Интерлейкины | Ил-2, Ил-7, Ил-12 |
| Цитокины | Интерфероны, G-CSF |
| Хемокины | CCL3, CCL26, CXCL7 |
| Иммуномодулирующие имидные препараты (IMiD) | талидомид и его аналоги (леналидомид, помалидомид, и апремиласт ) |
| Другой | цитозинфосфат-гуанозин, олигодезоксинуклеотиды, глюканы |
Активационные иммунотерапии
Рак
Раньше лечение рака было сосредоточено на уничтожении или удалении раковых клеток и опухолей с помощью химиотерапии, хирургического вмешательства или облучения. Эти методы лечения могут быть очень эффективными и во многих случаях все еще используются. В 2018 г. Нобелевская премия в области физиологии и медицины был награжден Джеймс П. Эллисон и Тасуку Хондзё «За открытие лечения рака путем подавления негативной иммунной регуляции». Иммунотерапия рака пытается стимулировать иммунная система для уничтожения опухолей. Различные стратегии используются или проходят исследования и испытания. Сообщалось о рандомизированных контролируемых исследованиях различных видов рака, приводящих к значительному увеличению выживаемости и периода без болезни.[2] и его эффективность увеличивается на 20–30%, когда клеточная иммунотерапия сочетается с традиционными методами лечения.[2]
Одна из старейших форм иммунотерапии рака - это использование Вакцина БЦЖ, который изначально был предназначен для вакцинации против туберкулез и позже было обнаружено, что он полезен при лечении Рак мочевого пузыря.[5] Иммунотерапия БЦЖ вызывает как местные, так и системные иммунные ответы. Механизмы, с помощью которых иммунотерапия БЦЖ опосредует противоопухолевый иммунитет, широко изучены, но до сих пор полностью не изучены.[6]
Использование моноклональные антитела в терапии рака была впервые представлена в 1997 году с ритуксимаб, анти-CD20-антитело для лечения В-клеточной лимфомы.[7] С тех пор несколько моноклональных антител были одобрены для лечения различных гематологических злокачественных новообразований, а также солидных опухолей.[8][9]
Добыча G-CSF лимфоциты из крови и размножаются in vitro против опухолевого антигена перед повторной инъекцией клеток с соответствующими стимулирующими цитокины. Затем клетки разрушают опухолевые клетки, которые экспрессируют антиген.[нужна цитата ]Для местной иммунотерапии используется крем для повышения иммунитета (имиквимод ) который производит интерферон, в результате чего убийца получателя Т-клетки разрушать бородавки,[10] актинический кератоз, базально-клеточный рак, вагинальная интраэпителиальная неоплазия,[11] плоскоклеточный рак,[12][13] кожная лимфома,[14] и поверхностная злокачественная меланома.[15] Инъекционная иммунотерапия ("внутри очага" или "внутри опухоли") использует паротит, кандидоз, вакцину против ВПЧ.[16][17] или же трихофитин антиген инъекции для лечения бородавок (опухолей, вызванных ВПЧ).
Приемный перенос клеток был протестирован на легкое [18] и другие виды рака, причем наибольший успех достигнут в меланома.
Насосная помпа или вакцинация на основе дендритных клеток
Дендритные клетки (ДК) можно стимулировать, чтобы активировать цитотоксический ответ на антиген. Дендритные клетки, тип антигенпрезентирующая клетка, получены от человека, нуждающегося в иммунотерапии. Затем в эти клетки вводят антиген или опухолевый лизат, или трансфицированный с вирусный вектор, заставляя их отображать антиген. При переливании крови человеку эти активированные клетки представляют антиген эффекторным лимфоцитам (CD4 + хелперные Т-клетки, цитотоксический CD8 + Т-клетки и В-клетки ). Это инициирует цитотоксический ответ против опухолевых клеток, экспрессирующих антиген (против которых теперь примирован адаптивный ответ). В вакцина против рака Sipuleucel-T является одним из примеров такого подхода.[19]
Современные подходы к Вакцинация на основе DC в основном основаны на нагрузке антигеном на in vitro-сгенерированные DC из моноциты или же CD34 + клетки, активируя их разными TLR лиганды, цитокин комбинации, и вводить их обратно пациентам. В in vivo подходы нацеливания включают введение определенных цитокинов (например, Flt3L, GM-CSF ) и нацеливание на ДК антителами к рецепторам лектина С-типа или агонистическим антителам (например, анти-CD40 ), которые конъюгированы с представляющим интерес антигеном. В будущем подход может быть нацелен на подмножества DC на основе их конкретно выраженных Лектиновые рецепторы С-типа или же хемокиновые рецепторы. Другой потенциальный подход - создание генетически модифицированных DC из индуцированные плюрипотентные стволовые клетки и использование неоантиген -загруженные ДК для улучшения клинического исхода.[20]
Адаптивный перенос Т-клеток
Приемный перенос клеток in vitro культивирует аутологичные экстрагированные Т-клетки для последующего переливания.[21]
В качестве альтернативы, Генно-инженерные Т-клетки создаются путем сбора Т-клеток и последующего заражения Т-клеток ретровирус который содержит копию Рецептор Т-клеток (TCR) ген, который специализируется на распознавании опухолевых антигенов. Вирус интегрирует рецептор в Т-клетки. геном. Клетки неспецифично размножаются и / или стимулируются. Затем клетки повторно вводят и вызывают иммунный ответ против опухолевых клеток.[22] Методика апробирована на рефрактерных метастатических меланомах IV стадии.[21] и продвинутый рак кожи.[23][24][25]
Независимо от того, являются ли Т-клетки генно-инженерными или нет, перед реинфузией требуется лимфодеплеция реципиента для устранения регуляторных Т-клеток, а также немодифицированных эндогенных лимфоцитов, которые конкурируют с перенесенными клетками за гомеостатические цитокины.[21][26][27][28] Лимфодеплеции можно добиться с помощью миелоаблативный химиотерапия, к которой можно добавить облучение всего тела для большего эффекта.[29] Перенесенные клетки умножились in vivo и сохраняется в периферической крови у многих людей, иногда составляя 75% всех CD8.+ Т-клетки через 6–12 месяцев после инфузии.[30] По состоянию на 2012 год[Обновить], клинические испытания метастатической меланомы продолжаются в нескольких центрах.[31] Клинические ответы на адоптивный перенос Т-клеток наблюдались у пациентов с метастатической меланомой, устойчивой к множественной иммунотерапии.[32]
Ингибиторы КПП
Анти-PD-1 / PD-L1 и антитела против CTLA-4 - это два типа ингибиторов контрольных точек, доступных в настоящее время пациентам. Утверждение антицитотоксического белка, ассоциированного с Т-лимфоцитами 4 (CTLA-4 ) и белок 1 против запрограммированной гибели клеток (ПД-1 ) антитела для использования человеком уже привели к значительному улучшению исходов заболеваний при различных формах рака.[33]
Хотя эти молекулы были первоначально обнаружены как молекулы, играющие роль в Активация Т-клеток или же апоптоз, последующие доклинические исследования показали их важную роль в поддержании периферической иммунной толерантности.[34]
Ингибиторы иммунных контрольных точек одобрены для лечения некоторых пациентов с различными типами рака, включая меланому, рак молочной железы, Рак мочевого пузыря, рак шейки матки, рак толстой кишки, рак головы и шеи, или же лимфома Ходжкина.[35]
Эти методы лечения произвели революцию иммунотерапия рака как они показали впервые за многие годы исследований метастатических меланома, который считается одним из самых иммуногенный человеческий рак, улучшение общей выживаемости с увеличением группы пациентов, получающих долгосрочную пользу от этого лечения.[34]
Иммунная терапия
Аутологичная терапия для повышения иммунитета использовать собственную периферическую кровь человека естественные клетки-киллеры, цитотоксические Т-лимфоциты, эпителиальные клетки и другие соответствующие иммунные клетки увеличиваются in vitro а затем повторно вливают.[36] Терапия была протестирована против Гепатит С,[37][38][39] Синдром хронической усталости[40][41] и HHV6 инфекционное заболевание.[42]
Подавляющая иммунотерапия
Иммунное подавление смягчает ненормальный иммунная реакция в аутоиммунные заболевания или снижает нормальный иммунная реакция предотвращать отказ из пересаженный органы или клетки.
Иммунодепрессанты
Иммунодепрессанты помочь справиться с трансплантацией органов и аутоиммунными заболеваниями. Иммунные ответы зависят от пролиферации лимфоцитов. Цитостатические препараты обладают иммунодепрессивным действием. Глюкокортикоиды являются несколько более специфическими ингибиторами активации лимфоцитов, тогда как ингибиторы иммунофилины более конкретно нацелены на активацию Т-лимфоцитов. Иммунодепрессивные антитела целевые шаги в иммунном ответе. Другие препараты модулировать иммунные ответы и могут использоваться для индукции иммунной регуляции. В доклинических испытаниях было замечено, что регулирование иммунной системы небольшими иммуносупрессивными молекулами, такими как витамин D и дексаметазон, вводимых в режиме низких доз и подкожно, может быть полезным для предотвращения или лечения хронического воспаления.[43]
Иммунная толерантность
Организм, естественно, не атакует собственные ткани иммунной системой. Модели обычно определяют CD4 + Т-клетки в центре аутоиммунный ответ. Затем потеря толерантности Т-клеток высвобождает В-клетки и другие иммунные эффекторные клетки к ткани-мишени. Идеал толерогенная терапия будет нацеливаться на конкретный клон (ы) Т-клеток, координирующий аутоиммунную атаку.[44]
Иммунная толерантность методы лечения стремятся перезагрузить иммунную систему, чтобы организм перестал ошибочно атаковать собственные органы или клетки в аутоиммунное заболевание или принимает инородные ткани в трансплантация органов.[45] Недавний терапевтический подход - это вливание регуляторные иммунные клетки в реципиентов трансплантата. Перенос регуляторных иммунных клеток может подавлять активность эффектора.[46][47]
Создание иммунная толерантность снижает или устраняет необходимость в пожизненной иммуносупрессии и сопутствующих побочных эффектах. Проверено на трансплантации, ревматоидный артрит, диабет 1 типа и другие аутоиммунные заболевания.
| Модальность | Подробности | ||
| Неантигенспецифический | • Моноклональные антитела | Истощение Анти-CD52 Анти-CD4 Анти-LFA2 | Не истощающий Анти-CD4 Анти-CD3 Анти-LFA-1 CTLA4-Ig Анти-CD25 |
| • Трансплантация гемопоэтических стволовых клеток | Немиелоаблативный | Миелоаблативный | |
| • Трансплантация мезенхимальных стволовых клеток | |||
| • Регуляторная Т-клеточная терапия | Неантигенспецифический | Антиген-специфичный | |
| • Низкие дозы ИЛ-2 для увеличения регуляторных Т-клеток | |||
| • Манипуляции с микробиомом | |||
| Антигенспецифический | • Пептидная терапия | Подкожно, внутрикожно, через слизистую оболочку (орально, вдыхание) Толерогенные дендритные клетки, липосомы и наночастицы | |
| • Измененные пептидные лиганды | |||
Аллергии
Иммунотерапия также может использоваться для лечения аллергия. Во время лечения аллергии (например, антигистаминные препараты или же кортикостероиды ) лечить аллергические симптомы, иммунотерапия может снизить чувствительность к аллергены, уменьшая его серьезность.
Иммунотерапия может принести долгосрочную пользу.[50] Иммунотерапия частично эффективна для одних людей и неэффективна для других, но дает страдающим аллергией шанс уменьшить или прекратить симптомы.
Терапия показана людям с сильной аллергией или тем, кто не может избежать определенных аллергены.
IgE-опосредованный пищевая аллергия это глобальная проблема здравоохранения, которая затрагивает миллионы людей и затрагивает все аспекты жизни пациента.[51] Перспективным подходом к лечению пищевой аллергии является использование пероральная иммунотерапия (ОИТ). OIT заключается в постепенном воздействии увеличивающегося количества аллергена, что может привести к тому, что большинство субъектов будут переносить дозы пищи, достаточные для предотвращения реакции на случайное воздействие.[52] Дозировки со временем увеличиваются, поскольку человек теряет чувствительность. Этот метод был протестирован на младенцах для предотвращения аллергии на арахис.[53]
Аллерген-специфическая иммунотерапия (ASIT) стал золотым стандартом для лечения аллергических заболеваний, опосредованных IgE, в отношении большого количества различных аллергенов. Можно с любопытством ожидать новых разработок, которые еще больше улучшат наше понимание механизмов аллергии и улучшат ASIT для следующих поколений пациентов и врачей.[54]
Гельминтозная терапия
Власоглав яйцеклетка (Trichuris suis) и Анкилостомы (Некатор американский) прошли испытания на иммунологические заболевания и аллергию. Гельминтозная терапия был исследован в качестве лечения рецидива ремиттирующей рассеянный склероз[55] Крона,[56][57][58] аллергия и астма.[59] Механизм того, как гельминты модулируют иммунный ответ, неизвестен. Предполагаемые механизмы включают переполяризацию ответа Th1 / Th2.[60] и модуляция функции дендритных клеток.[61][62] Гельминты подавляют активность провоспалительных цитокинов Th1, Интерлейкин-12 (IL-12), интерферон-гамма (IFN-γ) и Фактор-альфа некроза опухоли (TNF-), способствуя выработке регуляторных цитокинов Th2, таких как Ил-10, Ил-4, Ил-5 и Ил-13.[60][63]
Совместная эволюция с гельминтами сформировала некоторые гены, связанные с Интерлейкин экспрессия и иммунологические расстройства, такие как Крона, язвенный колит и глютеновая болезнь. Отношения гельминтов с людьми как хозяевами следует классифицировать как мутуалистические или симбиотический.[нужна цитата ]
Смотрите также
- Модификатор биологической реакции
- Сепсивак
- Ингибитор КПП
- Иммунотерапия интерлейкином-2
- Иммуностимулятор
- Микротрансплантация
- Фотоиммунотерапия in vitro или in vivo[64][65][66][67][68][69][70]
Рекомендации
- ^ "Иммунотерапия | Мемориальный онкологический центр им. Слоуна Кеттеринга". mskcc.org. Получено 2017-07-27.
- ^ а б c Syn NL, Teng MW, Mok TS, Soo RA (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет. Онкология. 18 (12): e731 – e741. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ Conforti L (февраль 2012 г.). «Сеть ионных каналов в Т-лимфоцитах, мишень для иммунотерапии». Клиническая иммунология. 142 (2): 105–6. Дои:10.1016 / j.clim.2011.11.009. PMID 22189042.
- ^ Масихи К.Н. (июль 2001 г.). «Борьба с инфекцией с помощью иммуномодулирующих средств». Мнение эксперта по биологической терапии. 1 (4): 641–53. Дои:10.1517/14712598.1.4.641. PMID 11727500. S2CID 33308465.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). «Иммунотерапия рака мочевого пузыря». Исследования и отчеты в урологии. 7: 65–79. Дои:10.2147 / RRU.S63447. ЧВК 4427258. PMID 26000263.
- ^ Петтенати, Кэролайн; Ингерсолл, Молли А. (октябрь 2018 г.). «Механизмы иммунотерапии БЦЖ и ее перспективы при раке мочевого пузыря». Обзоры природы Урология. 15 (10): 615–625. Дои:10.1038 / s41585-018-0055-4. ISSN 1759-4820. PMID 29991725. S2CID 49670901.
- ^ Саллес Дж., Барретт М., Фоа Р., Маурер Дж., О'Брайен С., Валенте Н. и др. (Октябрь 2017 г.). «Ритуксимаб при В-клеточных гематологических злокачественных новообразованиях: обзор 20-летнего клинического опыта». Достижения в терапии. 34 (10): 2232–2273. Дои:10.1007 / с12325-017-0612-х. ЧВК 5656728. PMID 28983798.
- ^ Hoos A (апрель 2016 г.). «Разработка иммуноонкологических препаратов - от CTLA4 до PD1 для следующих поколений». Обзоры природы. Открытие наркотиков. 15 (4): 235–47. Дои:10.1038 / nrd.2015.35. PMID 26965203. S2CID 54550859.
- ^ Pento JT (ноябрь 2017 г.). «Моноклональные антитела для лечения рака». Противораковые исследования. 37 (11): 5935–5939. Дои:10.21873 / anticanres.12040. PMID 29061772.
- ^ ван Сетерс М., ван Берден М., тен Кейт Ф.Дж., Бекманн И., Юинг П.С., Эйкеманс М.Дж. и др. (Апрель 2008 г.). «Лечение интраэпителиальной неоплазии вульвы имиквимодом для местного применения». Медицинский журнал Новой Англии. 358 (14): 1465–73. Дои:10.1056 / NEJMoa072685. PMID 18385498.
- ^ Бак HW, Гут KJ (октябрь 2003 г.). «Лечение интраэпителиальной неоплазии влагалища (преимущественно низкой степени) кремом имиквимод 5%». Журнал болезней нижних отделов половых путей. 7 (4): 290–3. Дои:10.1097/00128360-200310000-00011. PMID 17051086. S2CID 44649376.
- ^ Ярвинен Р., Каасинен Э., Санкила А., Ринтала Э. (август 2009 г.). «Долгосрочная эффективность поддерживающей бациллы Кальметта-Герена по сравнению с поддерживающей терапией инстилляциями митомицина С при часто рецидивирующих опухолях TaT1 без карциномы in situ: анализ подгрупп проспективного рандомизированного исследования FinnBladder I с последующим 20-летним наблюдением». Европейская урология. 56 (2): 260–5. Дои:10.1016 / j.eururo.2009.04.009. PMID 19395154.
- ^ Дэвидсон ХК, Лейбовиц М.С., Лопес-Альбайтеро А., Феррис Р.Л. (сентябрь 2009 г.). «Иммунотерапия рака головы и шеи». Оральная онкология. 45 (9): 747–51. Дои:10.1016 / j.oraloncology.2009.02.009. PMID 19442565.
- ^ Дэни Т., Ноблер Р. (январь 2009 г.). «Экстракорпоральная фотоиммунотерапия-фотоферез». Границы биологических наук. 14 (14): 4769–77. Дои:10.2741/3566. PMID 19273388.
- ^ Эггермонт AM, Шадендорф Д. (июнь 2009 г.). «Меланома и иммунотерапия». Гематологические / онкологические клиники Северной Америки. 23 (3): 547–64, ix – x. Дои:10.1016 / j.hoc.2009.03.009. PMID 19464602.
- ^ Чуанг К.М., Мони А., Ву А., Хунг С.Ф. (май 2009 г.). «Комбинация лечения апигенином с терапевтической вакцинацией ДНК ВПЧ дает усиленный терапевтический противоопухолевый эффект». Журнал биомедицинских наук. 16 (1): 49. Дои:10.1186/1423-0127-16-49. ЧВК 2705346. PMID 19473507.
- ^ Павлита М., Гиссманн Л. (апрель 2009 г.). «[Рецидивирующий респираторный папилломатоз: показание к вакцинации против ВПЧ?]». Deutsche Medizinische Wochenschrift (на немецком). 134 Приложение 2: S100-2. Дои:10.1055 / с-0029-1220219. PMID 19353471.
- ^ Кан Н, Чжоу Дж, Чжан Т., Ван Л., Лу Ф, Цуй И и др. (Август 2009 г.). «Адоптивная иммунотерапия рака легких с иммобилизованными антителами против TCRgammadelta, увеличенными человеческими гаммадельта-Т-клетками в периферической крови». Биология и терапия рака. 8 (16): 1540–9. Дои:10.4161 / cbt.8.16.8950. PMID 19471115.
- ^ Ди Лоренцо Дж., Буонерба С., Кантофф П. В. (май 2011 г.). «Иммунотерапия для лечения рака простаты». Обзоры природы. Клиническая онкология. 8 (9): 551–61. Дои:10.1038 / nrclinonc.2011.72. PMID 21606971. S2CID 5337484.
- ^ Сабадо, Рэйчел Л; Балан, Срикумар; Бхардвадж, Нина (январь 2017 г.). «Иммунотерапия на основе дендритных клеток». Клеточные исследования. 27 (1): 74–95. Дои:10.1038 / cr.2016.157. ISSN 1001-0602. ЧВК 5223236. PMID 28025976.
- ^ а б c Розенберг С.А., Рестифо Н.П., Ян Дж.С., Морган Р.А., Дадли М.Э. (апрель 2008 г.). «Перенос адоптивных клеток: клинический путь к эффективной иммунотерапии рака». Обзоры природы. Рак. 8 (4): 299–308. Дои:10.1038 / nrc2355. ЧВК 2553205. PMID 18354418.
- ^ Морган Р.А., Дадли М.Э., Вундерлих Дж. Р., Хьюз М. С., Ян Дж. К., Шерри Р. М. и др. (Октябрь 2006 г.). «Регресс рака у пациентов после переноса генно-инженерных лимфоцитов». Наука. 314 (5796): 126–9. Bibcode:2006Научный ... 314..126М. Дои:10.1126 / science.1129003. ЧВК 2267026. PMID 16946036.
- ^ Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R и др. (Июнь 2008 г.). «Лечение метастатической меланомы аутологичными CD4 + Т-клетками против NY-ESO-1». Медицинский журнал Новой Англии. 358 (25): 2698–703. Дои:10.1056 / NEJMoa0800251. ЧВК 3277288. PMID 18565862.
- ^ «Программа симпозиума 2008 г. и докладчики». Научно-исследовательский институт рака. Архивировано из оригинал на 2008-10-15.
- ^ Highfield R (18 июня 2008 г.). «Больной раком выздоравливает после инъекции иммунных клеток». Телеграф. Архивировано из оригинал 12 сентября 2008 г.. Получено 22 декабря 2019.
- ^ Antony PA, Piccirillo CA, Akpinarli A, Finkelstein SE, Speiss PJ, Surman DR, et al. (Март 2005 г.). «CD8 + Т-клеточный иммунитет против опухоли / аутоантигена усиливается CD4 + Т-хелперами и сдерживается естественными Т-регуляторными клетками». Журнал иммунологии. 174 (5): 2591–601. Дои:10.4049 / jimmunol.174.5.2591. ЧВК 1403291. PMID 15728465.
- ^ Gattinoni L, Finkelstein SE, Klebanoff CA, Antony PA, Palmer DC, Spiess PJ, et al. (Октябрь 2005 г.). «Удаление поглотителей гомеостатических цитокинов путем лимфодеплеции увеличивает эффективность адоптивно перенесенных опухолеспецифических CD8 + Т-клеток». Журнал экспериментальной медицины. 202 (7): 907–12. Дои:10.1084 / jem.20050732. ЧВК 1397916. PMID 16203864.
- ^ Даммер В., Нитхаммер А.Г., Баккала Р., Лоусон Б.Р., Вагнер Н., Райсфельд Р.А., Теофилопулос А.Н. (июль 2002 г.). «Гомеостатическая пролиферация Т-клеток вызывает эффективный противоопухолевый аутоиммунитет». Журнал клинических исследований. 110 (2): 185–92. Дои:10.1172 / JCI15175. ЧВК 151053. PMID 12122110.
- ^ Дадли М.Э., Ян Дж. К., Шерри Р., Хьюз М.С., Роял Р., Каммула Ю. и др. (Ноябрь 2008 г.). «Адоптивная клеточная терапия для пациентов с метастатической меланомой: оценка подготовительных схем интенсивной миелоаблативной химиолучевой терапии». Журнал клинической онкологии. 26 (32): 5233–9. Дои:10.1200 / JCO.2008.16.5449. ЧВК 2652090. PMID 18809613.
- ^ Дадли М.Э., Вундерлих Дж. Р., Роббинс П. Ф., Ян Дж. К., Хву П., Шварцентрубер Д. Д. и др. (Октябрь 2002 г.). «Регресс рака и аутоиммунитет у пациентов после клональной репопуляции противоопухолевыми лимфоцитами». Наука. 298 (5594): 850–4. Bibcode:2002Наука ... 298..850D. Дои:10.1126 / science.1076514. ЧВК 1764179. PMID 12242449.
- ^ Пилон-Томас С., Кун Л., Элвангер С., Янссен В., Ройстер Е., Марцбан С. и др. (Октябрь 2012 г.). «Эффективность адоптивного переноса лимфоцитов, инфильтрирующих опухоль, после индукции лимфопении при метастатической меланоме». Журнал иммунотерапии. 35 (8): 615–20. Дои:10.1097 / CJI.0b013e31826e8f5f. ЧВК 4467830. PMID 22996367.
- ^ Андерсен Р., Борч Т.Х., Драги А., Гокульдасс А., Рана М.А., Педерсен М. и др. (Июль 2018). «Т-клетки, выделенные от пациентов с меланомой, устойчивой к ингибиторам контрольных точек, являются функциональными и могут опосредовать регрессию опухоли». Анналы онкологии. 29 (7): 1575–1581. Дои:10.1093 / annonc / mdy139. PMID 29688262.
- ^ Seidel, Judith A .; Оцука, Ацуши; Кабасима, Кендзи (28.03.2018). «Анти-PD-1 и анти-CTLA-4 терапии рака: механизмы действия, эффективность и ограничения». Границы онкологии. 8: 86. Дои:10.3389 / fonc.2018.00086. ISSN 2234-943X. ЧВК 5883082. PMID 29644214.
- ^ а б Haanen, John B.A.G .; Роберт, Кэролайн (2015). «Ингибиторы иммунных контрольных точек». Иммуноонкология. Прогресс в исследовании опухолей. 42: 55–66. Дои:10.1159/000437178. ISBN 978-3-318-05589-4. PMID 26382943.
- ^ «Ингибиторы иммунных контрольных точек - Национальный институт рака». www.cancer.gov. 2019-09-24. Получено 2020-08-24.
- ^ Манджунатх С.Р., Раманан Г., Дедепия В.Д., Терунума Х., Дэн Х, Баскар С. и др. (Январь 2012 г.). «Аутологичная терапия для повышения иммунитета при рецидивирующем раке яичников с метастазами: клинический случай». Отчеты о случаях в онкологии. 5 (1): 114–8. Дои:10.1159/000337319. ЧВК 3364094. PMID 22666198.
- ^ Ли И, Чжан Т., Хо Ц, Orange JS, Дуглас С.Д., Хо В.З. (декабрь 2004 г.). «Естественные клетки-киллеры подавляют экспрессию вируса гепатита С». Журнал биологии лейкоцитов. 76 (6): 1171–9. Дои:10.1189 / jlb.0604372. PMID 15339939.
- ^ Доскали М., Танака Й, Охира М., Исияма К., Таширо Х., Чаяма К., Охдан Х (март 2011 г.). «Возможность адоптивной иммунотерапии с использованием CD3⁻CD56 + и CD3 + CD56 + клеток периферической крови для индукции антигепатоцеллюлярной карциномы и активности вируса гепатита C». Журнал иммунотерапии. 34 (2): 129–38. Дои:10.1097 / CJI.0b013e3182048c4e. PMID 21304407. S2CID 26385818.
- ^ Терунума Х., Дэн Х, Деван З., Фудзимото С., Ямамото Н. (2008). «Потенциальная роль NK-клеток в индукции иммунных ответов: значение для иммунотерапии на основе NK-клеток при раке и вирусных инфекциях». Международные обзоры иммунологии. 27 (3): 93–110. Дои:10.1080/08830180801911743. PMID 18437601. S2CID 27557213.
- ^ См. DM, Tilles JG (1996). «Лечение альфа-интерфероном больных с синдромом хронической усталости». Иммунологические исследования. 25 (1–2): 153–64. Дои:10.3109/08820139609059298. PMID 8675231.
- ^ Охо-Амайз Э.А., Конли Э.Дж., Питер Дж.Б. (январь 1994 г.). «Снижение активности естественных клеток-киллеров связано с серьезностью синдрома иммунной дисфункции хронической усталости». Клинические инфекционные болезни. 18 Приложение 1: S157-9. Дои:10.1093 / Clinids / 18.Supplement_1.S157. PMID 8148445.
- ^ Кида К., Исодзуми Р., Ито М. (декабрь 2000 г.). «Уничтожение клеток, инфицированных вирусом герпеса 6 человека, лимфоцитами, культивированными с интерлейкином-2 или -12». Международная педиатрия. 42 (6): 631–6. Дои:10.1046 / j.1442-200x.2000.01315.x. PMID 11192519.
- ^ Оспина-Кинтеро, Лаура; Харамилло, Хулио С .; Табарес-Гевара, Хорхе Х .; Рамирес-Пинеда, Хосе Р. (24 апреля 2020 г.). «Переформулирование малых молекул для иммунного вмешательства при сердечно-сосудистых заболеваниях: низкие дозы комбинированного витамина D / дексаметазона способствуют выработке IL-10 и защите атеросклероза у мышей с дислипидемией». Границы иммунологии. 11: 743. Дои:10.3389 / fimmu.2020.00743. ЧВК 7197409. PMID 32395119.
- ^ а б Райнер, Фиона; Айзекс, Джон Д. (2018-12-01). «Терапевтическая толерантность при аутоиммунном заболевании». Семинары по артриту и ревматизму. 48 (3): 558–562. Дои:10.1016 / j.semarthrit.2018.09.008. ISSN 0049-0172. PMID 30348449.
- ^ Ротрозен Д., Мэтьюз Дж. Б., Блустоун Дж. А. (июль 2002 г.). «Сеть иммунной толерантности: новая парадигма для разработки методов лечения, вызывающих толерантность». Журнал аллергии и клинической иммунологии. 110 (1): 17–23. Дои:10.1067 / mai.2002.124258. PMID 12110811. S2CID 30884739.
- ^ Столп, Джессика; Дзайцу, Масааки; Вуд, Кэтрин Дж. (2019), Бойд, Эшли С. (редактор), «Иммунная толерантность и отторжение при трансплантации органов», Иммунологическая толерантность, Нью-Йорк, Нью-Йорк: Springer New York, 1899, стр. 159–180, Дои:10.1007/978-1-4939-8938-6_12, ISBN 978-1-4939-8936-2, PMID 30649772
- ^ Макмерчи, Алисия Н .; Бушелл, Эндрю; Левингс, Меган К .; Вуд, Кэтрин Дж. (01.08.2011). «Переход к толерантности: клиническое применение Т-регуляторных клеток». Семинары по иммунологии. Достижения в трансплантологии. 23 (4): 304–313. Дои:10.1016 / j.smim.2011.04.001. ISSN 1044-5323. ЧВК 3836227. PMID 21620722.
- ^ Бейкер, Кеннет Ф; Айзекс, Джон Д. (март 2014 г.). «Перспективы терапевтической толерантности у людей». Текущее мнение в ревматологии. 26 (2): 219–227. Дои:10.1097 / BOR.0000000000000029. ISSN 1040-8711. ЧВК 4640179. PMID 24378931.
- ^ Cooles, Faye A.H .; Айзекс, Джон Д. (01.08.2010). «Лечение для восстановления толерантности при воспалительном артрите - уроки других болезней». Передовая практика и исследования в клинической ревматологии. Фармакотерапия: концепции патогенеза и новых методов лечения. 24 (4): 497–511. Дои:10.1016 / j.berh.2010.01.007. ISSN 1521-6942. PMID 20732648.
- ^ Дарем С.Р., Уокер С.М., Варга Е.М., Якобсон М.Р., О'Брайен Ф., Нобл В. и др. (Август 1999 г.). «Долгосрочная клиническая эффективность иммунотерапии пыльцой трав». Медицинский журнал Новой Англии. 341 (7): 468–75. Дои:10.1056 / NEJM199908123410702. PMID 10441602. S2CID 14629112.
- ^ Джонс, Стейси М .; Беркс, А. Уэсли; Дюпон, Кристоф (01.02.2014). «Современное состояние иммунотерапии пищевых аллергенов: пероральное, сублингвальное и надкожное». Журнал аллергии и клинической иммунологии. 133 (2): 318–323. Дои:10.1016 / j.jaci.2013.12.1040. ISSN 0091-6749. PMID 24636471.
- ^ MacGinnitie, Эндрю Дж .; Рашид, Рима; Грэгг, Хана; Литтл, Сара В .; Лакин, Пол; Чианферони, Антонелла; Хеймалл, Дженнифер; Махиджа, Мелани; Робисон, Рэйчел; Чинтраджа, Р. Шарон; Ли, Джон (2017-03-01). «Омализумаб способствует быстрой пероральной десенсибилизации при аллергии на арахис». Журнал аллергии и клинической иммунологии. 139 (3): 873–881.e8. Дои:10.1016 / j.jaci.2016.08.010. ISSN 0091-6749. ЧВК 5369605. PMID 27609658. S2CID 3626708.
- ^ «Результаты поиска клинических испытаний - Медицинский факультет Стэнфордского университета». med.stanford.edu. Получено 2016-04-03.
- ^ Ring, J .; Гутермут, Дж. (2011). «100 лет гипосенсибилизации: история аллерген-специфической иммунотерапии (АСИТ)». Аллергия. 66 (6): 713–724. Дои:10.1111 / j.1398-9995.2010.02541.x. ISSN 1398-9995. PMID 21320133. S2CID 19390006.
- ^ Корреале Дж., Фарез М (февраль 2007 г.). «Связь между паразитарной инфекцией и иммунными реакциями при рассеянном склерозе». Анналы неврологии. 61 (2): 97–108. Дои:10.1002 / ana.21067. PMID 17230481. S2CID 1033417.
- ^ Круз Дж., О'нейл Дж., Массон Дж., Кук С., Мелроуз В., Причард Д., Спир Р. (январь 2006 г.). «Доказательство концепции исследования по установлению Necator americanus у пациентов с болезнью Крона и доноров резервуаров». Кишечник. 55 (1): 136–7. Дои:10.1136 / gut.2005.079129. ЧВК 1856386. PMID 16344586.
- ^ Редди А., Фрид Б. (январь 2009 г.). «Обновленная информация об использовании гельминтов для лечения болезни Крона и других аутоиммунных заболеваний». Паразитологические исследования. 104 (2): 217–21. Дои:10.1007 / s00436-008-1297-5. PMID 19050918. S2CID 19279688.
- ^ Laclotte C, Oussalah A, Rey P, Bensenane M, Pluvinage N, Chevaux JB и др. (Декабрь 2008 г.). «[Гельминты и воспалительные заболевания кишечника]». Gastroenterologie Clinique et Biologique (На французском). 32 (12): 1064–74. Дои:10.1016 / j.gcb.2008.04.030. PMID 18619749.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (октябрь 2006 г.). «Паразитарные глисты и воспалительные заболевания». Иммунология паразитов. 28 (10): 515–23. Дои:10.1111 / j.1365-3024.2006.00879.x. ЧВК 1618732. PMID 16965287.
- ^ а б Брукер С., Бетони Дж., Хотез П. Дж. (2004). Человеческая анкилостомическая инфекция в 21 веке. Достижения в паразитологии. 58. С. 197–288. Дои:10.1016 / S0065-308X (04) 58004-1. ISBN 9780120317585. ЧВК 2268732. PMID 15603764.
- ^ Fujiwara RT, Cançado GG, Freitas PA, Santiago HC, Massara CL, Dos Santos Carvalho O и др. (2009). Язданбахш М (ред.). «Инфекция Necator americanus: возможная причина изменения дифференцировки дендритных клеток и профиля эозинофилов у хронически инфицированных лиц». PLOS забытые тропические болезни. 3 (3): e399. Дои:10.1371 / journal.pntd.0000399. ЧВК 2654967. PMID 19308259.
- ^ Карвалью Л., Сан Дж., Кейн С., Маршалл Ф., Кравчик С., Пирс Э. Дж. (Январь 2009 г.). «Серия обзоров по гельминтам, иммунной модуляции и гигиенической гипотезе: механизмы, лежащие в основе модуляции гельминтами функции дендритных клеток». Иммунология. 126 (1): 28–34. Дои:10.1111 / j.1365-2567.2008.03008.x. ЧВК 2632707. PMID 19120496.
- ^ Фумагалли М., Поццоли Ю., Кальяни Р., Коми Г. П., Рива С., Клеричи М. и др. (Июнь 2009 г.). «Паразиты представляют собой главную селективную силу для генов интерлейкинов и формируют генетическую предрасположенность к аутоиммунным состояниям». Журнал экспериментальной медицины. 206 (6): 1395–408. Дои:10.1084 / jem.20082779. ЧВК 2715056. PMID 19468064.
- ^ Hong CH, Tang MR, Hsu SH, Yang CH, Tseng CS, Ko YC, et al. (Сентябрь 2019 г.). «Усиленный ранний иммунный ответ лептоспирального белка внешней мембраны LipL32, стимулированный воздействием узкой полосы в среднем инфракрасном диапазоне». Журнал фотохимии и фотобиологии. B, Биология. 198: 111560. Дои:10.1016 / j.jphotobiol.2019.111560. PMID 31336216.
- ^ Chang HY, Li MH, Huang TC, Hsu CL, Tsai SR, Lee SC и др. (Февраль 2015 г.). «Количественная протеомика выявляет сети, подверженные помехам в среднем инфракрасном диапазоне в клетках рака груди». Журнал протеомных исследований. 14 (2): 1250–62. Дои:10.1021 / pr5011873. PMID 25556991.
- ^ Нагая Т., Окуяма С., Огата Ф., Маруока Ю., Чойке П.Л., Кобаяши Х. (май 2019 г.). «Фотоиммунотерапия в ближнем инфракрасном диапазоне с использованием оптоволоконного диффузора для лечения распространения перитонеального рака желудка». Рак желудка. 22 (3): 463–472. Дои:10.1007 / s10120-018-0871-5. ЧВК 7400986. PMID 30171392.
- ^ Мицунага М., Огава М., Косака Н., Розенблюм Л.Т., Чойк П.Л., Кобаяши Н. (ноябрь 2011 г.). «Селективная для раковых клеток фотоиммунотерапия в ближнем инфракрасном диапазоне in vivo, нацеленная на специфические мембранные молекулы». Природа Медицина. 17 (12): 1685–91. Дои:10,1038 / нм.2554. ЧВК 3233641. PMID 22057348.
- ^ Сато К., Сато Н., Сюй Б., Накамура Ю., Нагая Т., Чойк П.Л. и др. (Август 2016 г.). «Пространственно-селективное истощение связанных с опухолью регуляторных Т-клеток с помощью фотоиммунотерапии в ближнем инфракрасном диапазоне». Научная трансляционная медицина. 8 (352): 352ra110. Дои:10.1126 / scitranslmed.aaf6843. PMID 27535621.
- ^ Нагая Т., Накамура Ю., Сато К., Харада Т., Чойк П.Л., Кобаяши Н. (июнь 2016 г.). «Улучшенное микрораспределение конъюгатов антитело-поглотитель фотонов после начальной фотоиммунотерапии в ближней инфракрасной области (NIR-PIT)». Журнал контролируемого выпуска. 232: 1–8. Дои:10.1016 / j.jconrel.2016.04.003. ЧВК 4893891. PMID 27059723.
- ^ Zhen Z, Tang W, Wang M, Zhou S, Wang H, Wu Z и др. (Февраль 2017). "Протеиновая наноклетка, опосредованная активацией фибробластов, фотоиммунотерапия, направленная на протеин, для усиления инфильтрации цитотоксических Т-клеток и контроля опухолей". Нано буквы. 17 (2): 862–869. Bibcode:2017NanoL..17..862Z. Дои:10.1021 / acs.nanolett.6b04150. PMID 28027646.
