Миоцит - Myocyte
| Миоцит | |
|---|---|
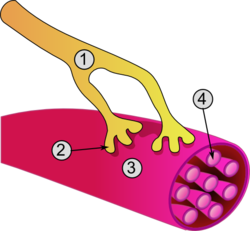 Общее строение мышечной клетки и нервно-мышечного соединения:
| |
| Подробности | |
| Место расположения | Мышцы |
| Идентификаторы | |
| латинский | Миоцит |
| MeSH | D032342 |
| TH | H2.00.05.0.00002 |
| FMA | 67328 |
| Анатомические термины микроанатомии | |
А миоцит (также известный как мышечная клетка)[1] это тип клетка найдено в некоторых типах мышечная ткань. Миоциты развиваются из миобласты формировать мышцы в процессе, известном как миогенез.[2] Есть две специализированные формы миоцитов с различными свойствами: сердечный, и гладкая мышца клетки. С другой стороны, скелетные мышцы образованы морфологическими единицами, называемыми мышечные волокна.[3] Кардиомиоциты клетки, которые образуют камеры сердца и имеют единую центральную ядро.[4] Волокна скелетных мышц помогают поддерживать и двигать тело и называются синцития – многоядерный структуры, образованные путем слияния отдельных миобластов во время эмбрионального развития.[5][6] Клетки гладких мышц контролируют непроизвольные движения, такие как перистальтика сокращение в пищевод и желудок.
Структура
Терминология
Необычная микроструктура мышечных клеток привела к клеточные биологи создавать специализированную терминологию. Однако каждому термину, характерному для мышечных клеток, есть аналог, который используется в терминологии, применяемой к другим типам клеток:
| Мышечная клетка | Другие клетки организма |
|---|---|
| саркоплазма | цитоплазма |
| саркоплазматический ретикулум | гладкая эндоплазматическая сеть (SER) |
| саркосома | митохондрия |
| сарколемма | клеточная мембрана |
В саркоплазма это цитоплазма мышечного волокна / клетки. Большая часть саркоплазмы заполнена миофибриллы, которые представляют собой длинные белковые тяжи, состоящие из миофиламентов. Саркоплазма также состоит из гликоген, полисахарид мономеров глюкозы, который обеспечивает клетку энергией при повышенных физических нагрузках, и миоглобин, красный пигмент, который сохраняет кислород до тех пор, пока он не понадобится для мышечной активности.[7]
Существует три типа миофиламентов:[7]
- Толстые нити, состоящие из белковых молекул, называемые миозин. В полосах мышечных полос это темные волокна, составляющие полосу А.
- Тонкие нити состоят из белковых молекул, называемых актин. В полосах мышечных лент это светлые волокна, составляющие I-полосу.
- Эластичные нити состоят из тайтин, большой упругий белок; эти нити прикрепляют толстые нити к Z-диску.
Вместе эти миофиламенты вызывают сокращение мышц.
В саркоплазматический ретикулум, специализированный вид гладкая эндоплазматическая сеть, образует сеть вокруг каждой миофибриллы мышечного волокна. Эта сеть состоит из двух расширенных концевых мешочков, называемых терминальными цистернами, и одного поперечного канальца, или Т-трубочка, которые проходят сквозь ячейку и выходят на другую сторону; вместе эти три компонента образуют триады, которые существуют в сети саркоплазматического ретикулума, в котором каждый Т-канальец имеет две терминальные цистерны с каждой стороны. Саркоплазматический ретикулум служит резервуаром для ионов кальция, поэтому, когда потенциал действия распространяется по Т-канальцу, он дает сигнал саркоплазматическому ретикулуму высвободить ионы кальция из закрытых мембранных каналов, чтобы стимулировать сокращение мышц.[7][8]
В сарколемма исторически был синонимом клеточная мембрана из поперечно-полосатое мышечное волокно или мышечная клетка. Однако есть два других компонента, которые формируют сарколемму - базальная пластинка и ретикулярные волокна. Клеточная мембрана сарколеммы принимает и проводит раздражители. В скелетных мышцах, на конце каждого мышечного волокна, внешний слой сарколеммы соединяется с сухожильными волокнами.[9] Внутри мышечного волокна, прижатого к сарколемме, имеется множество уплощенных ядра; Эмбриологически это многоядерное состояние возникает в результате слияния нескольких миобластов с образованием каждого мышечного волокна, где каждый миобласт вносит вклад в одно ядро.[7]
Внутренний

Клеточная мембрана миоцита имеет несколько специализированных областей, которые могут включать вставной диск и поперечная трубчатая система. Клеточная мембрана покрыта слоистой оболочкой шириной примерно 50 нм. Ламинарное покрытие разделяется на два слоя; то ламина денса и ламина люцида. Между этими двумя слоями может находиться несколько различных типов ионов, в том числе кальций.[10]
Клеточная мембрана прикреплена к клетке. цитоскелет якорными волокнами шириной около 10 нм. Обычно они располагаются на Z-линиях, так что образуют бороздки и выходят поперечные канальцы. В сердечных миоцитах это образует зубчатую поверхность.[10]
Цитоскелет - это то, из чего строится остальная часть клетки, и он выполняет две основные задачи; первая заключается в стабилизации топографии внутриклеточных компонентов, а вторая - в помощи в управлении размером и формой клетки. Хотя первая функция важна для биохимических процессов, последняя имеет решающее значение для определения отношения поверхности к объему клетки. Это сильно влияет на потенциальные электрические свойства возбудимых клеток. Кроме того, отклонение от стандартной формы и размера клетки может иметь негативный прогностический эффект.[10]
Миофибриллы
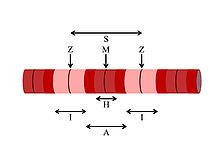
S = Саркомер, единица мышечной функции
А = А-полоса, область миозина
я = I-полоса, область только актина
ЧАС = H-зона, область только миозина
Z = Z-линия, граница саркомера
M = M-линия, центр саркомера
Каждое мышечное волокно содержит миофибриллы, которые представляют собой очень длинные цепочки саркомеры, сократительные единицы клетки. Ячейка из двуглавая мышца плеча может содержать 80 000 саркомеров.[11] Миофибриллы гладкая мышца клетки не расположены в саркомеры. Саркомеры состоят из тонких и толстых нитей. Тонкие нити состоят из актин и прикрепите к Z линиям, которые помогут им правильно выровняться друг с другом.[12] Тропонины находятся на интервалах вдоль тонких нитей. Толстые нити состоят из удлиненного протеина. миозин.[13] Саркомер не содержит органелл или ядра. Саркомеры отмечены Z линиями, которые показывают начало и конец саркомера. Отдельные миоциты окружены эндомизий.
Миоциты связаны между собой перимизий в пучки, называемые [[мышечный пучок]; затем пучки группируются вместе, чтобы сформировать мышечная ткань, заключенный в оболочку из эпимизий. Перимизий содержит кровеносные сосуды и нервы, которые обеспечивают мышечные волокна. Мышечные веретена распределяются по мышцам и обеспечивают сенсорную обратную связь Центральная нервная система. Миозин имеет форму длинного стержня с закругленным концом, направленным к поверхности. Эта структура образует поперечный мостик, который соединяется с тонкими нитями.[13]
Разработка
А миобласт это тип эмбрионального клетка-предшественница который отличает дать начало мышечным клеткам.[14] Дифференциация регулируется миогенные регуляторные факторы, включая MyoD, Myf5, миогенин, и MRF4.[15] GATA4 и GATA6 также играют роль в дифференцировке миоцитов.[16]
Волокна скелетных мышц образуются при слиянии миобластов; мышечные волокна - это клетки с несколько ядер, известный как миоядер, с каждым ядро клетки происходящие из одного миобласта. Слияние миобластов характерно для скелетных мышц (например, двуглавая мышца плеча ) и нет сердечная мышца или же гладкая мышца.
Миобласты в скелетных мышцах, не образующие мышечных волокон дедифференцировать назад в миоспателлитные клетки. Эти сателлитные клетки остаются рядом с волокном скелетных мышц, расположенным между сарколеммой и базальной мембраной.[17] из эндомизий (соединительная ткань, которая разделяет мышечные пучки на отдельные волокна). Чтобы повторно активировать миогенез, необходимо стимулировать сателлитные клетки, чтобы они дифференцировались в новые волокна.
Миобласты и их производные, включая сателлитные клетки, теперь можно генерировать in vitro с помощью направленная дифференциация из плюрипотентные стволовые клетки.[18]
Киндлин-2 играет роль в удлинении развития во время миогенеза.[19]
Рост мышечных волокон
Мышечные волокна растут, когда они тренируются, и сокращаются, когда они не используются. Это связано с тем, что упражнения стимулируют увеличение миофибриллы которые увеличивают общий размер мышечных клеток. Хорошо тренированные мышцы могут не только увеличить размер, но и развить митохондрии, миоглобин, гликоген и более высокая плотность капилляры. Однако мышечные клетки не могут делиться для производства новых клеток, и в результате у нас меньше мышечных клеток во взрослом возрасте, чем у новорожденного.[20]
Функция
Сокращение мышц
При сокращении тонкие и толстые нити скользят друг относительно друга за счет использования аденозинтрифосфат. Это сближает Z-диски друг с другом в процессе, называемом механизмом скользящей нити. Сокращение всех саркомеры приводит к сокращению всего мышечного волокна. Это сокращение миоцита вызывается потенциал действия над клеточная мембрана миоцита. Потенциал действия использует поперечные канальцы чтобы попасть с поверхности внутрь миоцита, который непрерывен внутри клеточной мембраны. Саркоплазматические ретикулы представляют собой мембранные мешки, которые соприкасаются поперечными канальцами, но остаются отдельными от них. Они обертываются вокруг каждого саркомера и наполнены Ca2+.[13]
Возбуждение миоцита вызывает деполяризацию его синапсов, нервно-мышечные соединения, который запускает потенциал действия. С единственным нервномышечное соединение каждое мышечное волокно получает сигнал только от одного соматического эфферентного нейрона. Потенциал действия в соматическом эфферентном нейроне вызывает высвобождение нейромедиатора ацетилхолин.[21]
Когда ацетилхолин высвобождается, он диффундирует через синапс и связывается с рецептором на сарколемма, термин, уникальный для мышечных клеток, который относится к клеточной мембране. Это инициирует импульс, который проходит через сарколемму.[20]
Когда потенциал действия достигает саркоплазматического ретикулума, он вызывает высвобождение кальция2+ из Ca2+ каналы. CA2+ течет из саркоплазматического ретикулума в саркомер обоими его нитями. Это приводит к тому, что нити начинают скользить, а саркомеры становятся короче. Для этого требуется большое количество АТФ, поскольку он используется как для прикрепления, так и для высвобождения каждого миозин голова. Очень быстро Ca2+ активно транспортируется обратно в саркоплазматический ретикулум, который блокирует взаимодействие между тонкой и толстой нитью. Это, в свою очередь, заставляет мышечную клетку расслабляться.[20]
Виды сокращения
Существует четыре основных типа сокращения мышц: подергивание, треппа, столбняк и изометрический / изотонический. Сокращение подергивания - это процесс, в котором один стимул сигнализирует об одном сокращении. При сокращении подергивания длина сокращения может варьироваться в зависимости от размера мышечной клетки. Во время треппе (или суммирования) сокращение мышц не запускается с максимальной эффективностью; вместо этого они достигают повышенной силы сокращения из-за повторяющихся раздражителей. Столбняк включает длительное сокращение мышц из-за серии быстрых раздражителей, которое может продолжаться до тех пор, пока мышцы не утомятся. Изометрические сокращения - это сокращения скелетных мышц, которые не вызывают движения мышцы. Однако изотонические сокращения - это сокращения скелетных мышц, которые вызывают движение.[20]
Специализированный кардиомиоциты расположен в синоатриальный узел отвечают за генерацию электрических импульсов, которые управляют сердце ставка. Эти электрические импульсы координируют сокращение остальной сердечной мышцы через электрическая проводящая система сердца. Активность синоатриального узла, в свою очередь, модулируется нервными волокнами обоих сочувствующий и парасимпатический нервная система. Эти системы действуют, увеличивая и уменьшая, соответственно, скорость производства электрических импульсов синоатриальным узлом.
Типирование волокна

Существует множество методов, используемых для типирования волокон, и неспециалисты часто путают их. Часто путают два метода: гистохимический окрашивание для миозин-АТФаза деятельность и иммуногистохимический окрашивание для Тяжелая цепь миозина (MHC) типа. Активность миозин-АТФазы обычно - и правильно - называют просто «типом волокна», и она является результатом прямого анализа активности АТФазы в различных условиях (например, pH ).[22] Тяжелая цепь миозина окрашивание наиболее точно обозначается как «тип волокна MHC», например «Волокна MHC IIa» и результаты определения различных MHC изоформы.[22] Эти методы тесно связаны физиологически, поскольку тип MHC является основным фактором, определяющим активность АТФазы. Обратите внимание, однако, что ни один из этих методов типирования не имеет прямого метаболического характера; они не касаются напрямую окислительной или гликолитической способности волокна.
Когда волокна «типа I» или «типа II» упоминаются в общем, это наиболее точно относится к сумме числовых типов волокон (I против II), оцениваемой по окрашиванию активности миозиновой АТФазы (например, волокна «типа II» относятся к типу IIA + тип IIAX + тип IIXA ... и т. Д.).
Ниже приведена таблица, показывающая взаимосвязь между этими двумя методами, ограниченная типами клетчатки, обнаруженными у людей. Обратите внимание на заглавные буквы подтипа, используемые при типировании волокон по сравнению с типированием MHC, и что некоторые типы ATPase фактически содержат несколько типов MHC. Также подтип B или b не экспрессируется у людей ни одним из методов.[23] Ранние исследователи полагали, что люди экспрессируют MHC IIb, что привело к классификации IIB по АТФазе. Однако более поздние исследования показали, что человеческий MHC IIb на самом деле был IIx,[23] что указывает на то, что IIB лучше назвать IIX. IIb экспрессируется у других млекопитающих, поэтому до сих пор точно встречается (вместе с IIB) в литературе. Типы волокон, отличных от человека, включают настоящие волокна IIb, IIc, IId и т. Д.
| Тип АТФазы | Тяжелая цепь (и) MHC |
|---|---|
| Тип I | MHC Iβ |
| Тип IC | MHC Iβ> MHC IIa |
| Тип IIC | MHC IIa> MHC Iβ |
| Тип IIA | MHC IIa |
| Тип IIAX | MHC IIa> MHC IIx |
| Тип IIXA | MHC IIx> MHC IIa |
| Тип IIX | MHC IIx |
Другие методы типирования волокна менее формально определены и существуют в большей части спектра. Они, как правило, больше сосредоточены на метаболических и функциональных возможностях (т.е. гликолитический, быстрое и медленное время сокращения). Как отмечалось выше, типирование волокон с помощью АТФазы или MHC напрямую не измеряет и не определяет эти параметры. Однако многие из различных методов механически связаны, а другие взаимосвязаны. in vivo.[26][27] Например, тип волокна АТФазы связан со скоростью сокращения, потому что высокая активность АТФазы позволяет быстрее Велоспорт через мост.[22] В то время как активность АТФазы является лишь одним из компонентов скорости сокращения, волокна типа I «медленные», отчасти потому, что они имеют низкую скорость активности АТФазы по сравнению с волокнами типа II. Однако измерение скорости сокращения - это не то же самое, что типирование волокна АТФазы.
Из-за этих типов взаимоотношений волокна Типа I и Типа II обладают относительно разными метаболическими, сократительными и моторными свойствами. В таблице ниже представлены эти типы свойств. Эти типы свойств - хотя они частично зависят от свойств отдельных волокон - обычно актуальны и измеряются на уровне моторный блок, а не отдельные волокна.[22]
| Характеристики | Волокна типа I | Волокна типа IIA | Волокна типа IIX |
|---|---|---|---|
| Тип блока двигателя | Медленное окисление (SO) | Быстрое окисление / гликолитик (ВОГ) | Быстрый гликолитик (ФГ) |
| Скорость подергивания | Медленный | Быстрый | Быстрый |
| Сила подергивания | Маленький | Середина | Большой |
| Устойчивость к переутомлению | Высоко | Высоко | Низкий |
| Содержание гликогена | Низкий | Высоко | Высоко |
| Капиллярная подача | Богатые | Богатые | Бедные |
| Миоглобин | Высоко | Высоко | Низкий |
| красный цвет | Тьма | Тьма | Бледный |
| Плотность митохондрий | Высоко | Высоко | Низкий |
| Капиллярная плотность | Высоко | Средний | Низкий |
| Емкость окислительного фермента | Высоко | Средний-высокий | Низкий |
| Ширина Z-линии | Средний | Широкий | Узкий |
| Щелочная активность АТФазы | Низкий | Высоко | Высоко |
| Кислая активность АТФазы | Высоко | Средней высоты | Низкий |
- Цвет волокна
Традиционно волокна классифицировались в зависимости от их цвета, что является отражением миоглобин содержание. Волокна типа I кажутся красными из-за высокого уровня миоглобина. Красные мышечные волокна, как правило, имеют больше митохондрий и большую локальную плотность капилляров. Эти волокна больше подходят для выносливости и медленно утомляются, потому что используют окислительный метаболизм для генерации АТФ (аденозинтрифосфат ). Волокна типа II с меньшей окислительностью имеют белый цвет из-за относительно низкого уровня миоглобина и зависимости от гликолитических ферментов.
- Скорость подергивания
Волокна также можно разделить на быстрые и медленные по их способности сокращаться. Эти признаки в значительной степени, но не полностью, перекрывают классификации, основанные на цвете, АТФазе или MHC.
Некоторые авторы определяют быстро сокращающееся волокно как волокно, в котором миозин может очень быстро расщеплять АТФ. В основном это волокна АТФазы типа II и MHC типа II. Однако быстросокращающиеся волокна также демонстрируют более высокую способность к электрохимической передаче потенциалов действия и быстрый уровень высвобождения и поглощения кальция саркоплазматическим ретикулумом. Быстро сокращающиеся волокна опираются на хорошо развитую, анаэробный, краткосрочная, гликолитическая система для передачи энергии и может сокращаться и развивать напряжение в 2–3 раза быстрее, чем медленные волокна. Быстро сокращающиеся мышцы намного лучше генерируют короткие всплески силы или скорости, чем медленные, и поэтому быстрее утомляются.[28]
Медленно сокращающиеся волокна генерируют энергию для повторного синтеза АТФ посредством длительной системы аэробный передача энергии. В основном это волокна АТФазы типа I и MHC типа I. Они, как правило, имеют низкий уровень активности АТФазы, более медленную скорость сокращения с менее развитой гликолитической способностью. Они содержат большой объем митохондрий и высокий уровень миоглобина, который придает им красную пигментацию. Было продемонстрировано, что они имеют высокие концентрации митохондриальных ферментов, поэтому они устойчивы к усталости. Медленно сокращающиеся мышцы работают медленнее, чем быстро сокращающиеся волокна, но они способны сокращаться дольше, прежде чем утомятся.[28]
- Распределение типов
Отдельные мышцы, как правило, представляют собой смесь различных типов волокон, но их пропорции варьируются в зависимости от действия этой мышцы и вида. Например, у человека четырехглавые мышцы содержат ~ 52% волокон типа I, а камбаловидная мышца - ~ 80% волокон типа I.[29] Orbicularis oculi глаза только ~ 15% типа I.[29] Моторные агрегаты внутри мышцы, однако, имеют минимальные различия между волокнами этой единицы. Именно этот факт определяет размер набор моторных единиц жизнеспособный.
Традиционно считалось, что общее количество волокон скелетных мышц не меняется. Считается, что в распределении волокон нет никаких половых или возрастных различий; однако пропорции типов волокон значительно различаются от мышцы к мышце и от человека к человеку.
Сидячие мужчины и женщины (а также маленькие дети) имеют 45% волокон типа II и 55% волокон типа I.[нужна цитата ]Люди, занимающиеся более высоким уровнем любого вида спорта, как правило, демонстрируют закономерности распределения клетчатки, например Спортсмены на выносливость демонстрируют более высокий уровень волокон типа I. Спортсменам со спринтом, с другой стороны, требуется большое количество волокон типа IIX. У спортсменов на средние дистанции наблюдается примерно одинаковое распределение этих двух типов. Это также часто бывает у силовых атлетов, таких как метатели и прыгуны. Было высказано предположение, что различные виды упражнений могут вызывать изменения в волокнах скелетных мышц.[30]
Считается, что если вы выполняете упражнения на выносливость в течение длительного периода времени, некоторые волокна типа IIX превращаются в волокна типа IIA. Однако нет единого мнения по этому поводу: вполне может быть, что волокна типа IIX демонстрируют повышение окислительной способности после высокоинтенсивных тренировок на выносливость, что приводит их к уровню, на котором они могут осуществлять окислительный метаболизм так же эффективно, как и медленные сокращения. волокна неподготовленных людей. Это может быть вызвано увеличением размера и количества митохондрий и связанными с ними изменениями, а не изменением типа волокна.
Смотрите также
Рекомендации
- ^ др.], консультанты Даниэль Альберт ... [и др. (2012). Иллюстрированный медицинский словарь Дорланда (32-е изд.). Филадельфия, Пенсильвания: Saunders / Elsevier. п. 321. ISBN 978-1-4160-6257-8.
- ^ Миоциты в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ др.], консультанты Даниэль Альберт ... [и др. (2012). Иллюстрированный медицинский словарь Дорланда (32-е изд.). Филадельфия, Пенсильвания: Saunders / Elsevier. С. 321 и 697. ISBN 978-1-4160-6257-8.
- ^ «Мышечные ткани». Архивировано из оригинал 13 октября 2015 г.. Получено 29 сентября 2015.
- ^ Скотт, Вт; Стивенс, Дж; Биндер-Маклеод, С.А. (2001). «Классификация типов волокон скелетных мышц человека». Физиотерапия. 81 (11): 1810–1816. Дои:10.1093 / ptj / 81.11.1810. PMID 11694174. Архивировано из оригинал 13 февраля 2015 г.
- ^ «Кто-нибудь знает, почему волокна скелетных мышц имеют периферические ядра, а кардиомиоциты нет? Каковы функциональные преимущества?». В архиве из оригинала от 19 сентября 2017 г.
- ^ а б c d Саладин, К. (2012). Анатомия и физиология: единство формы и функции (6-е изд.). Нью-Йорк: Макгроу-Хилл. С. 403–405. ISBN 978-0-07-337825-1.
- ^ Суги, Харуо; Абэ, Т; Кобаяши, Т; Chaen, S; Охнуки, Ю. Саэки, Й; Sugiura, S; Герреро-Эрнандес, Агустин (2013). «Повышение силы, создаваемой отдельными миозиновыми головками в ободранных мышечных волокнах поясничной мышцы кролика при низкой ионной силе». PLOS ONE. 8 (5): e63658. Bibcode:2013PLoSO ... 863658S. Дои:10.1371 / journal.pone.0063658. ЧВК 3655179. PMID 23691080.
- ^ Бенцингер, CF; Ван, YX; Рудницкий, М.А. (1 февраля 2012 г.). «Наращивание мышц: молекулярная регуляция миогенеза». Перспективы Колд-Спринг-Харбор в биологии. 4 (2): a008342. Дои:10.1101 / cshperspect.a008342. ЧВК 3281568. PMID 22300977.
- ^ а б c Феррари, Роберто. «Здоровые миоциты в сравнении с больными: метаболизм, структура и функции» (PDF). oxfordjournals.org/en. Издательство Оксфордского университета. В архиве (PDF) из оригинала 19 февраля 2015 г.. Получено 12 февраля 2015.
- ^ Такидзава, Питер. «Мышцы и нервно-мышечные соединения» (PDF). Йельский университет.
- ^ Тамаркин, Заря. «Состав миофибрилл». www.stcc.edu/faculty/webpages.asp. Издательство STCC Foundation Press. Архивировано из оригинал 8 сентября 2006 г.. Получено 12 февраля 2015.
- ^ а б c «Строение и функции скелетных мышц». course.washington.edu. В архиве из оригинала 15 февраля 2015 г.. Получено 13 февраля 2015.
- ^ страница 395, Биология, пятое издание, Кэмпбелл, 1999 г.
- ^ Перри Р., Рудник М. (2000). «Молекулярные механизмы, регулирующие миогенную детерминацию и дифференциацию». Передние биоски. 5: D750–67. Дои:10.2741 / Перри. PMID 10966875.
- ^ Чжао Р., Ватт А.Дж., Battle MA, Ли Дж., Бондоу Б.Дж., Дункан С.А. (май 2008 г.). «Потеря как GATA4, так и GATA6 блокирует дифференцировку сердечных миоцитов и приводит к акардии у мышей». Dev. Биол. 317 (2): 614–9. Дои:10.1016 / j.ydbio.2008.03.013. ЧВК 2423416. PMID 18400219.
- ^ Заммит, PS; Куропатка, TA; Яблонька-Реувени, Z (ноябрь 2006 г.). «Сателлитная клетка скелетных мышц: стволовая клетка, пришедшая с холода». Журнал гистохимии и цитохимии. 54 (11): 1177–91. Дои:10.1369 / jhc.6r6995.2006. PMID 16899758.
- ^ Чал Дж., Огинума М., Аль Танури З., Гоберт Б., Сумара О, Хик А., Буссон Ф., Зидуни И., Мурш С., Монкуке П., Тасси О, Винсент С., Миянари А., Бера А., Гарнье Дж. М., Гевара Дж., Хестин М, Кеннеди Л., Хаяши С., Дрейтон Б., Шерье Т., Гайро-Морель Б., Гуссони Э., Релеикс Ф, Таджбахш С., Пурки О. (август 2015 г.). «Дифференциация плюрипотентных стволовых клеток в мышечные волокна для моделирования мышечной дистрофии Дюшенна». Природа Биотехнологии. 33 (9): 962–9. Дои:10.1038 / nbt.3297. PMID 26237517. S2CID 21241434.

- ^ Доулинг Дж. Дж., Фрид А. П., Ким С., Голден Дж., Фельдман Е. Л. (2008). «Киндлин-2 необходим для удлинения миоцитов и необходим для миогенеза». BMC Cell Biol. 9: 36. Дои:10.1186/1471-2121-9-36. ЧВК 2478659. PMID 18611274.
- ^ а б c d Зисер, Стивен. «Анатомия и функции мышечных клеток» (PDF). www.austincc.edu. В архиве (PDF) из оригинала 23 сентября 2015 г.. Получено 12 февраля 2015.
- ^ «Возбуждение мышечных волокон». course.washington.edu. Вашингтонский университет. В архиве из оригинала 27 февраля 2015 г.. Получено 11 февраля 2015.
- ^ а б c d е ж Макинтош, Брайан Р .; Гардинер, Филипп Ф .; МакКомас, Алан Дж. (2006). Скелетные мышцы: форма и функции. Кинетика человека. ISBN 978-0-7360-4517-9.
- ^ а б Смерду, В .; Карш-Мизрахи, I; Кампионе, М; Leinwand, L; Скьяффино, S (декабрь 1994 г.). «Транскрипты тяжелой цепи миозина типа IIx экспрессируются в волокнах типа IIb скелетных мышц человека». Американский журнал физиологии. 267 (6, часть 1): C1723–8. Дои:10.1152 / ajpcell.1994.267.6.C1723. PMID 7545970.
- ^ Петте, D; Старон, РС (15 сентября 2000 г.). «Изоформы миозина, типы мышечных волокон и переходы». Микроскопические исследования и техника. 50 (6): 500–9. Дои:10.1002 / 1097-0029 (20000915) 50: 6 <500 :: AID-JEMT7> 3.0.CO; 2-7. PMID 10998639.
- ^ Старон, Роберт С .; Джонсон, Питер (ноябрь 1993 г.). «Полиморфизм миозина и дифференциальная экспрессия в скелетных мышцах взрослого человека». Сравнительная биохимия и физиология B. 106 (3): 463–475. Дои:10.1016 / 0305-0491 (93) 90120-Т. PMID 8281747.
- ^ Buchthal, F .; Шмальбрух, Х. (август 1970 г.). «Время сокращения и типы волокон в неповрежденной мышце человека». Acta Physiologica Scandinavica. 79 (4): 435–452. Дои:10.1111 / j.1748-1716.1970.tb04744.x. PMID 5472111.
- ^ Garnett, R.A .; О'Донован, M.J .; Stephens, J.A .; Тейлор, А. (февраль 1979 г.). "Организация двигательных единиц медиальной икроножной мышцы человека". Журнал физиологии. 287 (1): 33–43. Дои:10.1113 / jphysiol.1979.sp012643. ЧВК 1281479. PMID 430414.[постоянная мертвая ссылка ]
- ^ а б «Тип мышечных волокон». About.com. Спортивная медицина. В архиве из оригинала 21 ноября 2007 г.. Получено 27 ноября 2007.
- ^ а б Johnson, M.A .; Polgar, J .; Weightman, D .; Эпплтон, Д. (1973). «Данные о распределении типов волокон в тридцати шести мышцах человека. Вскрытие». Журнал неврологических наук. 18 (1): 111–129. Дои:10.1016 / 0022-510x (73) 90023-3. PMID 4120482.
- ^ Майкл Йессис (2006). Создайте лучшего спортсмена. Абсолютные концепции спортсмена. ISBN 978-1-930546-78-3.
внешняя ссылка
 СМИ, связанные с Миоциты в Wikimedia Commons
СМИ, связанные с Миоциты в Wikimedia Commons- Структура мышечной клетки
