Асимметричное гидрирование Нойори - Noyori asymmetric hydrogenation
| Асимметричное гидрирование Нойори | |
|---|---|
| Названный в честь | Рёдзи Нойори |
| Тип реакции | Органическая окислительно-восстановительная реакция |
В химия, то Асимметричное гидрирование Нойори относится к методологии энантиоселективного восстановления кетонов и родственных функциональных групп. Эта методология была введена Рёдзи Нойори,[1] кто поделился Нобелевская премия по химии в 2001 году за взносы в асимметричное гидрирование. Эти гидрогенизации используются в производстве нескольких лекарств, таких как антибактериальный левофлоксин, антибиотик карбапенем и антипсихотический агент BMS181100.[2][3]

История
Стехиометрическое асимметричное восстановление кетонов известно давно, например, с использованием гидридов бора.[4]
Каталитическое асимметричное гидрирование кетоны было продемонстрировано с катализаторами на основе БИНАП -Ru галогениды и карбоксилаты.[5][6]
Хотя дигалогенидный катализатор BINAP-Ru может восстанавливать функционализированные кетоны, гидрирование простых кетоны осталась нерешенной. Эта проблема была решена с использованием предкатализаторов типа RuCl2(дифосфан ) (диамин).[7] Эти катализаторы предпочтительно восстанавливают кетоны и альдегиды, не влияя на олефины и многие другие заместители.

Механизм

Предварительный катализатор BINAP-Ru-диаминдигалогенид превращается в катализаторы по реакции H2 при наличии базы:[3]
- RuCl2(БИНАП) (диамин) + 2 КОБУ-т + 2 Н2 → RuH2(БИНАП) (диамин) + 2 KCl + 2 HOBu-t
Полученные катализаторы имеют три типа лигандов:
- гидриды, которые переходят на ненасыщенный субстрат
- диамины, которые взаимодействуют с субстратом и активатором основания посредством вторая координационная сфера
- дифосфин, который придает асимметрию.
Катализаторы класса Нойори часто называют бифункциональные катализаторы чтобы подчеркнуть тот факт, что и металл, и (аминный) лиганд являются функциональными.[8] Долгое время считалось, что механизм действует за счет шестичленного перициклического соединения. переходное состояние / промежуточное звено, при котором гидридный центр гидрид рутения (ЧАСПробегЧАС) взаимодействует с карбонильным субстратом R2C=О.[9] DFT и экспериментальные исследования показали, что эта модель во многом неверна. Вместо этого основная цепь амина сильно взаимодействует с основным активатором, который часто используется в большом избытке.[3]
Объем субстрата
Катализатор BINAP / диамин-Ru эффективен для асимметричного восстановления как функционализированных, так и простых кетонов,[10] и катализатор BINAP / диамин-Ru может катализировать ароматный, гетероароматический, и олефиновый кетоны энантиоселективно.[7] Лучше стереоселективность достигается, когда один заместитель больше другого (см. Угол Флиппина-Лоджа ).

Промышленное применение
Катализаторы гидрирования, вдохновленные Нойори, были применены в промышленном синтезе ряда химических продуктов тонкой очистки. (R) -1,2-пропандиол, предшественник антибактериального левофлоксацин, может быть эффективно синтезирован из гидроксиацетона с использованием асимметричного гидрирования Нойори:[2]

Новые способы сосредоточены на гидрировании (R) -метиллактат.[3]
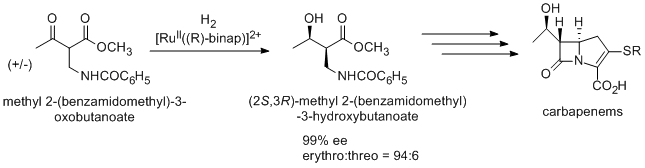
Антибиотик карбапенем также получают с использованием асимметричного гидрирования Нойори через (2S, 3R) -метил 2- (бензамидометил) -3-гидроксибутаноат, который синтезируется из рацемического метил-2- (бензамидометил) -3-оксобутаноата путем динамическое кинетическое разрешение.
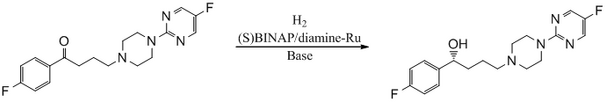
Антипсихотический агент BMS 181100 синтезируется с использованием катализатора BINAP / диамин-Ru.
Смотрите также
Рекомендации
- ^ Noyori, R .; Окума, Т .; Китамура, М .; Takaya, H .; Sayo, N .; Kumobayashi, H .; Акутагава, С. (1987), "Асимметричное гидрирование эфиров β-кетокарбоновых кислот. Практический чисто химический доступ к сложным β-гидроксиэфирам с высокой энантиомерной чистотой", Журнал Американского химического общества, 109 (19): 5856–5858, Дои:10.1021 / ja00253a051
- ^ а б Нойори, Р. (2002), «Асимметричный катализ: наука и возможности (Нобелевская лекция)», Angewandte Chemie International Edition, 41 (12): 2008–22, Дои:10.1002 / 1521-3773 (20020617) 41:12 <2008 :: aid-anie2008> 3.0.co; 2-4, PMID 19746595
- ^ а б c d е Дуб, Павел А .; Гордон, Джон С. (2018). «Роль связанной с металлом функциональности N – H в молекулярных катализаторах типа Нойори». Обзоры природы Химия. 2 (12): 396–408. Дои:10.1038 / s41570-018-0049-z. S2CID 106394152.
- ^ Рамачандран, П. В .; Браун, Х.С. (1996), "Последние достижения в асимметричном восстановлении с помощью B-хлордиизопинокамфеилборана", Журнал Американского химического общества, Серия симпозиумов ACS, 641: 84–97, Дои:10.1021 / bk-1996-0641.ch005, ISBN 0-8412-3381-0
- ^ Машима, К .; Kusano, K.-h .; Сидел на.; Matsumura, Y.-i .; Нодзаки, К .; Kumobayashi, H .; Sayo, N .; Hori, Y .; Ишизаки, Т. (1994), "Катионный БИНАП -Ru (II) галогенидные комплексы: высокоэффективные катализаторы стереоселективного асимметричного гидрирования α- и β-функционализированных кетонов », Журнал органической химии, 59 (11): 3064–3076, Дои:10.1021 / jo00090a026
- ^ Китамура, М .; Окума, Т .; Inoue, S .; Sayo, N .; Kumobayashi, H .; Akutagawa, S .; Охта, Т .; Takaya, H .; Нойори Р. (1988), "Гомогенное асимметричное гидрирование функционализированных кетонов", Журнал Американского химического общества, 110 (2): 629–631, Дои:10.1021 / ja00210a070
- ^ а б Noyori, R .; Окума, Т. (2001), "Асимметричный катализ архитектурной и функциональной молекулярной инженерией: практическое химио- и стереоселективное гидрирование кетонов", Angewandte Chemie International Edition, 40 (1): 40–73, Дои:10.1002 / 1521-3773 (20010105) 40: 1 <40 :: aid-anie40> 3.0.co; 2-5, PMID 11169691
- ^ Нойори, Рёдзи; Масаси Ямакава; Шохей Хасигучи (2001-11-01). "Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями". Журнал органической химии. 66 (24): 7931–7944. Дои:10.1021 / jo010721w. PMID 11722188.
- ^ Окума, Т .; Ooka, H .; Икария, Т .; Нойори, Р. (1995), "Предпочтительное гидрирование альдегидов и кетонов", Журнал Американского химического общества, 117 (41): 10417–10418, Дои:10.1021 / ja00146a041
- ^ Окума, Т .; Ooka, H .; Yamakawa, M .; Икария, Т .; Нойори, Р. (1996), "Стереоселективное гидрирование простых кетонов, катализируемое комплексами рутения (II)", Журнал органической химии, 61 (15): 4872–4873, Дои:10.1021 / jo960997h
