Титаноорганическое соединение - Organotitanium compound

Титаноорганические соединения в металлоорганическая химия содержать углерод -к-титан химические связи. Титаноорганическая химия это наука о титаноорганических соединениях, описывающая их физические свойства, синтез и реакции. Они реагенты в органическая химия и участвуют в основных производственных процессах.[1]
Краткая история
Хотя первая попытка получения титанового органического соединения датируется 1861 годом, о первом примере не сообщалось до 1954 года. дихлорид титаноцена был описан Уилкинсоном и Бирмингемом. Самостоятельно, на основе титана Катализаторы Циглера – Натта были описаны ведущие к основным коммерческим приложениям, для которых 1963 г. Нобелевская премия по химии был награжден. Эта технология подчеркнула техническое значение титаноорганической химии.
Свойства

Титан электронная конфигурация ([Ar] 3d24 с2) отдаленно напоминает углерод и, как углерод, +4 степень окисления доминирует. Однако титан является гораздо более крупным элементом, чем углерод, что отражается в Ti-C. длина облигаций примерно на 30% длиннее, например 210 вечера в тетрабензилтитане по сравнению с типичной связью C-C 155 пм. Однако простые соединения тетраалкилтитана обычно не выделяются из-за большого размера титана и электронодефицитной природы его тетраэдрических комплексов. Более распространенными и более полезными, чем простые тетраалкильные соединения, являются комплексы смешанных лигандов с алкоксидными и циклопентадиенильными колигандами. Титан способен образовывать комплексы с высоким координационные номера.
Что касается степеней окисления, то большая часть химии титана, по крайней мере в растворе, сосредоточена на производных Ti (IV) и Ti (III). Соединения Ti (II) встречаются реже, например дикарбонил титаноцена и Ti (CH3)2(dmpe )2. [Ti (CO)6]2− формально представляет собой комплекс Ti (-II).[3] Хотя Ti (III) участвует в катализе Циглера – Натта, органические производные Ti (III) встречаются редко. Одним из примеров является димер [Cp2TiIIICl]2.[4]
Из-за низкого электроотрицательность В титане связи Ti-C поляризованы в сторону углерода. Следовательно, алкильные лиганды во многих соединениях титана являются нуклеофильный. Для титана характерно оксофильный, который рекомендует использовать безвоздушные методы. С другой стороны, высокая оксофильность означает, что алкилы титана эффективны для отщепления или замены органильных лигандов на оксогруппы, как обсуждается ниже.
Соединения
Хлориды и алкоксиды алкилтитана
Простые алкильные комплексы титана, например Ti (CH2C6ЧАС5)4,[6] редки. Несколько смешанных галогенидов алкил-титана и алкоксидов алкил-титана используются в органическом синтезе, даже если они не всегда хорошо охарактеризованы.[7] По крайней мере, с коммерческой точки зрения, наиболее полезные титановые органические соединения получают путем объединения хлорид титана (III) и хлорид диэтилалюминия. Так как Катализаторы Циглера – Натта, такие частицы эффективно катализируют полимеризация из этилен. Процесс неоднородный и никакие титаноорганические промежуточные соединения для этого процесса не были хорошо охарактеризованы.
Многочисленные титаноорганические реагенты получают путем объединения тетрахлорида титана, тетраалкоксидов титана или их смесей с литийорганическими, магнийорганическими и цинкорганическими соединениями. Такие соединения время от времени используются в качестве стехиометрических реагентов в органический синтез. «Трихлорид метилтитана», номинально CH3TiCl3, можно приготовить путем обработки хлорид титана (IV) с участием диметилцинк в дихлорметан при -78 ° C. Он обеспечивает метильные группы к карбонильным соединениям и алкилгалогениды. «Метилтриизопропоксититан» является родственным реагентом.[8] Диалкилтитан вовлечен в Ti-промотированный циклопропанации начиная с реактива Гриньяра и сложного эфира. Эта реакция лежит в основе Кулинковича реакция:[9]
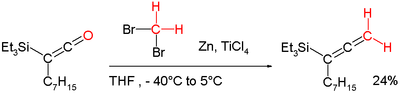
«Реагент Ломбардо» используется для метиленирования.[10] Он функционально связан с Дибромметан-цинк-титан (IV) хлорид реагент.[11] Эта химия устраняет недостаток Реагент Виттига путем метиленирования енолизируемых карбонильных групп без потери стереохимической целостности (метилирование Ломбардо). Его можно, например, также применить при преобразовании кетен в аллен:[7][12]
Производные титаноцена
Попытка синтеза «титаноцена», то есть Ti (C5ЧАС5)2, производит фульвален сложный.[13][15] Димер титаноцена был признан в 1970-х годах.[15][16][17] но структурно не характеризовался до 1992 г.,[14] и исследования привели ко многим нововведениям в области циклопентадиенильных комплексов титана.[13] Только в 1998 году было идентифицировано настоящее производное титаноцена, парамагнитные частицы (C5меня4SiMe3)2Ti.[18]
В отличие от самого титаноцена, дихлорид титаноцена и до некоторой степени монохлорид титаноцена имеют богатый и четко определенный химический состав.[13] Реактив Теббе, приготовленный из дихлорида титаноцена и триметилалюминий, используется как метиленирование агент (преобразование R2C = O к R2C = CH2).

Реагент Теббе добавляет простые алкены с образованием титаноциклобутанов, которые можно рассматривать как стабильные. метатезис олефинов промежуточные звенья. Эти соединения сами по себе являются реагентами, например: 1,1-бис (циклопентадиенил) -3,3-диметилтитаноциклобуtane, аддукт реагента Теббе с изобутен катализируется 4-диметиламинопиридином.[19]

В Реагент Петазис или диметил титаноцен (1990) получают из дихлорида титаноцена и метиллитий в диэтиловый эфир. По сравнению с реагентом Теббе его легче приготовить и легче обращаться. Это также реагент метиленирования.[19]
В Реагент Нуджент-Раджан-Бабу[20] одноэлектронный восстановитель, используемый в синтетическая органическая химия для поколения спирты через антимарковский открытие кольца эпоксиды, и генерируется как димер [(η5-Cp)2Ti (μ-Cl)]2 и использовал на месте из дихлорида титаноцена.[4][21][22][23]

Соединения MonoCp
Менее полезны в органической химии, но все же видны многие производные (циклопентадиенил) трихлорид титана, (C5ЧАС5) TiCl3. Этот комплекс фортепиано и табурета получен реакция перераспределения дихлорида титаноцена и тетрахлорида титана. С числом электронов 12, он намного более электрофильный, чем дихлорид титаноцена 16e.
Комплексы Арене
Тетрахлорид титана реагирует с гексаметилбензол дать [(η6-C6меня6) TiCl3]+ соли. Восстановленные ареновые комплексы включают степени окисления -1, 0, +1.[24][25]
Карбонильные комплексы
Соли [Ti (CO)6]2− известен.[26]
использованная литература
- ^ "Титаноорганические реагенты в органическом синтезе (концепции реакционной способности и структуры в органической химии, том 24)" Манфред Т. Ритц 1986 ISBN 0-387-15784-0
- ^ Мишель Эфритихин (1998). «Новый взгляд на реакцию Макмерри». Chem. Commun. (23): 2549–2554. Дои:10.1039 / a804394i.
- ^ Эльшенбройх, К. «Металлоорганические соединения» (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ а б Manzer, L.E .; Минц, Э. А .; Маркс, Т. Дж. (1982). Циклопентадиенильные комплексы титана (III) и ванадия (III). Неорг. Synth. Неорганические синтезы. 21. С. 84–86. Дои:10.1002 / 9780470132524.ch18. ISBN 9780470132524.
- ^ З. Давуди; М. Л. Х. Грин; В. С. Б. Мтетва; К. Прут; А. Дж. Шульц; Дж. М. Уильямс; Т. Ф. Кетцле (1986). "Доказательства взаимодействий углерод-водород-титан: синтез и кристаллические структуры агостических алкилов [TiCl3(Меня2PCH2CH2PMe2) R] (R = Et или Me) ". J. Chem. Soc., Dalton Trans. (8): 1629. Дои:10.1039 / dt9860001629.
- ^ Дэвис, Гвинет Р .; Jarvis, J. A. J .; Килборн, Б. Т. (1971). «Кристаллическая и молекулярная структура (при –40 ° C) тетрабензилов титана, гафния и олова». J. Chem. Soc. D (23): 1511–1512. Дои:10.1039 / C29710001511.
- ^ а б Хартвиг, Дж. Ф. Химия органических переходных металлов, от связывания до катализа; Научные книги университета: Нью-Йорк, 2010. ISBN 1-891389-53-X
- ^ Имвинкельрид, Рене; Зеебах, Дитер (1989). «3'-Нитро-1-фенилэтанол путем добавления метилтриизопропоксититана к м-Нитробензальдегид ». Органический синтез. 67: 180. Дои:10.15227 / orgsyn.067.0180.
- ^ Ча, Джин Кун; Кулинкович, Олег Г. (2012). «Циклопропанирование по Кулинковичу производных карбоновых кислот». Органические реакции. 77: 1–159. Дои:10.1002 / 0471264180.or077.01. ISBN 978-0471264187.
- ^ Лучано Ломбардо (1987). «Метилирование карбонильных соединений: (+) - 3-метилен-цис-п-метан ». Органический синтез. 65: 81. Дои:10.15227 / orgsyn.065.0081..
- ^ Takai, K .; Hotta, Y .; Осима, К .; Нодзаки, Х. Tetrahedron Lett. 1978: 2417–2420. Отсутствует или пусто
| название =(Помогите) - ^ Марсден, Стивен П.; Ducept, Паскаль C (2005). «Синтез высокозамещенных алленилсиланов путем алкилидирования силилкетенов». Журнал органической химии Байльштейна. 1: 5. Дои:10.1186/1860-5397-1-5. PMID 16542018.
- ^ а б c d Mehrotra, R.C .; Сингх, А. (2000). "4.3.6 η5-Циклопентадиенильные комплексы металлов d-блока ». Металлоорганическая химия: единый подход (2-е изд.). Нью-Дели: Международные издатели Нью Эйдж. С. 243–268. ISBN 9788122412581.
- ^ а б Троянов, Сергей И .; Антропиусова, Елена; Мах, Карел (1992). «Прямое доказательство молекулярной структуры димерного титаноцена; Рентгеновская структура μ (η5: η5-фульвален) -ди- (μ-гидридо) -бис (η5-циклопентадиенилтитан) · 1,5 бензол ». J. Organomet. Chem. 427 (1): 49–55. Дои:10.1016 / 0022-328Х (92) 83204-У.
- ^ а б Wailes, P.C .; Coutts, R. S. P .; Вейголд, Х. (1974). «Титаноцен». Металлоорганическая химия титана, циркония и гафния. Металлоорганическая химия. Академическая пресса. С. 229–237. ISBN 9780323156479.
- ^ Антропиусова, Елена; Доседлова, Алена; Хануш, Владимир; Карел, Мах (1981). «Приготовление μ- (η5: η5-Фульвален) -ди-μ-гидридо-бис (η5-циклопентадиенилтитан) восстановлением Cp2TiCl2 с LiAlH4 в ароматических растворителях ». Переход встретился. Chem. 6 (2): 90–93. Дои:10.1007 / BF00626113. S2CID 101189483.
- ^ Куэнка, Томас; Herrmann, Wolfgang A .; Эшворт, Теренс В. (1986). «Химия оксофильных переходных металлов. 2. Новые производные титаноцена и цирконоцена». Металлоорганические соединения. 5 (12): 2514–2517. Дои:10.1021 / om00143a019.
- ^ Чирик, Пол Дж. (2010). «Сэндвич-комплексы с переходным металлом группы 4: все еще свежи спустя почти 60 лет». Металлоорганические соединения. 29 (7): 1500–1517. Дои:10.1021 / om100016p.
- ^ а б Хартли, Ричард С .; Ли, Цзяньфэн; Main, Calver A .; Маккирнан, Гордон Дж. (2007). «Реагенты карбеноидов титана для превращения карбонильных групп в алкены». Тетраэдр. 63 (23): 4825–4864. Дои:10.1016 / j.tet.2007.03.015.
- ^ Росалес, Антонио; Родригес-Гарсия, Игнасио; Муньос-Баскон, Хуан; Ролдан-Молина, Эстер; Padial, Наталья М .; Morales, Laura P .; Гарсия-Оканья, Марта; Ольтра, Дж. Энрике (2015). «Реагент Nugent: мощный инструмент в современной радикальной и металлоорганической химии». Евро. J. Org. Chem. 2015 (21): 4567–4591. Дои:10.1002 / ejoc.201500292.
Эта обзорная статья была исправлена, чтобы относиться к «Реагенту Nugent – RajanBabu», а не «Реагенту Nugent»:
Росалес, Антонио; Родригес-Гарсия, Игнасио; Муньос-Баскон, Хуан; Ролдан-Молина, Эстер; Padial, Наталья М .; Morales, Laura P .; Гарсия-Оканья, Марта; Ольтра, Дж. Энрике (2015). «Реагент Наджента – Раджана Бабу: мощный инструмент в современной радикальной и металлоорганической химии». Евро. J. Org. Chem. 2015 (21): 4592. Дои:10.1002 / ejoc.201500761. - ^ Ханда, Юичи; Инанага, Джунджи (1987). «Высокостереоселективная пинаколизация ароматических и α, β-ненасыщенных альдегидов.dta, опосредованная комплексом титан (III) -магний (II)». Tetrahedron Lett. 28 (46): 5717–5718. Дои:10.1016 / S0040-4039 (00) 96822-9.
- ^ Nugent, William A .; Раджан Бабу, Т. В. (1988). "Переходные металлоцентрированные радикалы в органическом синтезе. Циклизация эпоксиолефинов, вызванная титаном (III)". Варенье. Chem. Soc. 110 (25): 8561–8562. Дои:10.1021 / ja00233a051.
- ^ Юнгст, Рудольф; Секутовски, Деннис; Дэвис, Джимми; Лули, Мэтью; Стаки, Гален (1977). «Структурные и магнитные свойства ди-μ-хлор-бис [бис (η5-циклопентадиенил) титан (III)] и ди-μ-бромо-бис [бис (η5-метилциклопентадиенил) титан (III)] ». Неорг. Chem. 16 (7): 1645–1655. Дои:10.1021 / ic50173a015.
- ^ Блэкберн, Дэвид У .; Бриттон, Дойл; Эллис, Джон Э. (1992). «Новый подход к бис (ареновым) комплексам титана (0) и -титана (–I). Структура бис (арен) титанатов (1–)». Angewandte Chemie International Edition на английском языке. 31: 1495–1498. Дои:10.1002 / anie.199214951.
- ^ Кальдераццо, Фаусто; Ферри, Изабелла; Пампалони, Гвидо; Энглерт, Улли; Грин, Малкольм Л. Х. (1997). «Синтез [Ti (η6-1,3,5-С6ЧАС3iPr3)2][Бар4] (Ar = C6ЧАС5, ПК6ЧАС4Ф, 3,5-С6ЧАС3(CF3)2), Первые производные титана (I) ». Металлоорганические соединения. 16: 3100–3101. Дои:10.1021 / om970155o.
- ^ Эллис, Дж. Э. (2003). «Карбонильные анионы металлов: из [Fe (CO)4]2− в [Hf (CO)6]2− и не только ». Металлоорганические соединения. 22 (17): 3322–3338. Дои:10.1021 / om030105l.