Старческие бляшки - Senile plaques
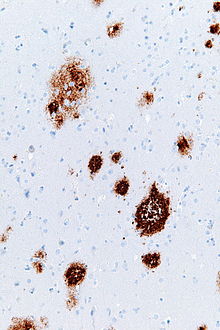
Старческие бляшки (также известен как невритические бляшки, или же амилоидные бляшки) находятся внеклеточный депозиты амилоид бета в серое вещество мозга.[1][2] Дегенеративный нейронные структуры и обилие микроглия и астроциты может быть связано с отложениями старческого налета. Эти отложения также могут быть побочным продуктом старение (старение). Однако большое количество старческих бляшек и нейрофибриллярные сплетения характерные черты Болезнь Альцгеймера.[3] Аномальный невриты у сенильных бляшек состоят в основном из парных спиральных филаментов, составляющих нейрофибриллярные клубки.[4] Бляшки различаются по форме и размеру, но в среднем их 50. мкм по размеру.[5] При болезни Альцгеймера они в основном состоят из амилоид бета пептиды. Эти полипептиды имеют тенденцию к агрегации и считаются нейротоксичный.
История
В 1892 г. Поль Блок и Георге Маринеску впервые описал наличие зубного налета в сером веществе.[6][7] В результате их сходства с актиномицеты друзы, их называли друзовый некроз к Оскар Фишер в начале 20 века. Связь между бляшками и слабоумие был обнаружен Алоис Альцгеймер в 1906 г.[8] К 1911 году Макс Бельшовски предположил амилоидную природу отложений зубного налета. В том же году Теофил Симхович ввел термин сенильные бляшки.[9] Вишневски ввел термин «нейритные бляшки» в 1973 году. Во второй половине 20-го века были предложены теории иммунологических и генетических факторов в образовании бляшек.[10] Статистические исследования были выполнены J.A.N. Корселлис и М. Франке в 1970-е гг. М. Franke показал, что деменциональное заболевание может возникать, когда количество сенильных бляшек во фронтальной коре более 200 / мм.3. К 1985 г. бета-амилоид образования были успешно идентифицированы с помощью биохимических методов, хотя многие нерешенные вопросы о важности и образовании сенильных бляшек оставались.
Формирование и описание
Сосредоточено в синапс нейронов - это белок-предшественник амилоида (APP), который распространяется через плазматическую мембрану. Часть этого белка содержит Aβ пептид последовательность. Эта область представляет собой часть сегмента ДНК, охватывающего APP, который кодирует белки.[11]
При образовании сенильных бляшек Aβ отщепляется от белка-предшественника амилоида. Хотя три фермента могут обрабатывать APP, только β- (бета) и γ- (гамма) секретаза напрямую участвует в образовании сенильных бляшек. β-секретаза (BACE) - это протеазный фермент, который расщепляет белки и пептиды. Этот протеаза расщепляет АРР для дальнейшего экспонирования карбоксильных концевых фрагментов Aβ. После того, как большая часть APP высвобождается в результате этого процесса, γ-секретаза расщепляет оставшиеся карбоксильные фрагменты на трансмембранный домен. Последовательные действия γ-секретазы вслед за активностью BACE приводят к тому, что фрагменты белка Aβ (бета-амилоид) высвобождаются во внеклеточное пространство.[11] В конце концов, накопление бета-амилоида вне синапсов нейронов образует совокупную массу бляшек, которая отодвигает мелкие разветвления и связи клеток мозга.
Формирование амилоид бета фрагменты - нормальное явление в организме человека. Однако накопление Aβ, приводящее к образованию отложений зубного налета, является необычным явлением. Хотя причина этой аномалии в значительной степени неизвестна, исследования выявили определенные виды бета-амилоида, которые различаются по длине на несколько аминокислот и легко объединяются в бляшки. Эти виды более патогенны.[12]
Идентификация

Старческие бляшки видны в световая микроскопия используя технику окрашивания серебро, Конго красный, Тиофлавин, крезиловый фиолетовый, и ПАС-реакция. Отложения налета также видны через флуоресценцию и иммунофлуоресценция микроскопия.[4][13] Окрашивание серебром по Бельшовскому оказалось наименее эффективным средством визуализации старческих бляшек, тогда как методы окрашивания серебром по Кэмпбеллу и Галлиасу показали улучшенную идентификацию и точность. При использовании конго красного была заметно окрашена только четверть имеющихся старческих бляшек.[12] Старческие бляшки также можно визуализировать с помощью иммуноокрашивания, направленного против бета-амилоид. Основная проблема, связанная с вышеуказанными методами окрашивания, заключается в том, что участки нервной ткани должны быть удалены из мозга, чтобы точно идентифицировать сенильные бляшки. Это проблематично, потому что удаление нервной ткани может быть столь же вредным, как и сами бляшки.
Болезнь
Важным критерием нейропатолого-гистологического подтверждения болезни Альцгеймера является образование сенильных бляшек. Было обнаружено, что бета-амилоидные пептиды, связанные со старческими бляшками, также играют центральную роль в риске, возникновении и прогрессировании болезни Альцгеймера. Особое значение имеет более длинный вид бета-амилоида, известный как бета-амилоид 42. Повышенные уровни бета-амилоида, а также увеличение отношения бета-амилоида 42 к более коротким основным видам бета-амилоида 40 были определены как важные для ранние события в патогенезе болезни Альцгеймера.[14]
Другие факторы в подтверждении болезни Альцгеймера включают патологические нейрофибриллы, клубки и атрофический мозг с гидроцефалией. Формирование и распространение патологических нейрофибрилляров имеют закономерность.[15] и позволяет определить стадию заболевания. В сочетании с наличием большого количества бляшек болезнь Альцгеймера может быть диагностирована с большой вероятностью. Корреляция между наличием сенильных бляшек и Синдром Дауна также был проверен.[1]
Вхождение
Старческие бляшки можно найти в мозге человека и животных (например, млекопитающих и птиц). В возрасте от 60 лет (10%) до возраста 80 лет (60%) доля людей со старческими бляшками увеличивается линейно. Небольшая часть образующихся бляшек может быть связана с физиологическим процессом старения. У женщин вероятность появления бляшек несколько выше, чем у мужчин.[5] Бляшки обычно встречаются в ядре миндалины и бороздках коры головного мозга.
Исследование
Идентифицируется все больше разнообразных соединений, снижающих уровень бета-амилоида. Некоторые из этих соединений обладают селективностью к бета-амилоиду 42, тогда как другие пытаются модулировать белок-предшественник амилоида. В настоящее время такие соединения проходят клиническую оценку, чтобы определить, насколько они могут быть полезны при лечении болезни Альцгеймера.[14]
Смотрите также
Рекомендации
- ^ а б Cras P; Kawai M; Лоури Д; Гонсалес-ДеВитт П; Гринберг Б; Перри Джи (сентябрь 1991 г.). «Нейриты старческой бляшки при болезни Альцгеймера накапливают белок-предшественник амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 88 (17): 7552–6. Дои:10.1073 / pnas.88.17.7552. ЧВК 52339. PMID 1652752.
- ^ Первес, Дейл; Августин, Джордж Дж .; Фитцпатрик, Дэвид; Холл, Уильям С .; Ламанита, Энтони-Самуэль; Белый, Леонард Э .; Муни, Ричард Д .; Платт, Майкл Л. (2012). Неврология (5-е изд.). Сандерленд, Массачусетс: Sinauer Associates. п. 713. ISBN 978-0-87893-695-3.
- ^ Баллард, К; Готье, S; Корбетт, А; Брейн, К; Aarsland, D; Джонс, Э (19 марта 2011 г.). "Болезнь Альцгеймера". Ланцет. 377 (9770): 1019–31. Дои:10.1016 / S0140-6736 (10) 61349-9. PMID 21371747.
- ^ а б Ксизак-Рединг Х., Морган К., Маттиас Л.А. и др. (Декабрь 1994 г.). «Ультраструктура и биохимический состав парных спиральных нитей при кортикобазальной дегенерации». Американский журнал патологии. 145 (6): 1496–508. ЧВК 1887493. PMID 7992852.
- ^ а б Франке, М. (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen". Берлин, Германия: Neuropathologische Abteilung. Архивировано из оригинал 19 июля 2011 г.
- ^ Блок, Пол; Маринеско, Жорж (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle. С. 445–6. OCLC 492619936.
- ^ Buda O; Арсен Д; Ceausu M; Дермэнджиу Д; Curca GC (январь 2009 г.). «Жорж Маринеско и ранние исследования в области невропатологии». Неврология. 72 (1): 88–91. Дои:10.1212 / 01.wnl.0000338626.93425.74. PMID 19122036.
- ^ Альцгеймер, А. (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin. 64: 146–8.
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. в: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der patologischen Anatomie der Geisteskrankheiten. Йена: Г. Фишер, 1911, стр. 267–444.
- ^ Op den Velde W; Стам ФК (январь 1976 г.). «Некоторые церебральные белки и ферментные системы при пресенильной и старческой деменции при болезни Альцгеймера». Журнал Американского гериатрического общества. 24 (1): 12–6. Дои:10.1111 / j.1532-5415.1976.tb03247.x. PMID 1244383.
- ^ а б Suh YH; Checler F (сентябрь 2002 г.). «Белок-предшественник амилоида, пресенилины и альфа-синуклеин: молекулярный патогенез и фармакологические применения при болезни Альцгеймера». Фармакологические обзоры. 54 (3): 469–525. Дои:10.1124 / пр.54.3.469. PMID 12223532.
- ^ а б Mavrogiorgou P; Герц HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (декабрь 2011 г.). «Достаточно ли хороши рутинные методы для окрашивания сенильных бляшек и нейрофибриллярных клубков в различных областях мозга пациентов с деменцией?» (PDF). Психиатрия Данубина. 23 (4): 334–9. PMID 22075733.
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). «Сравнение семи методов окрашивания старческих бляшек и нейрофибриллярных клубков в проспективной серии из 15 пожилых пациентов». Невропатология и прикладная нейробиология. 15 (6): 563–78. Дои:10.1111 / j.1365-2990.1989.tb01255.x. PMID 2482455.
- ^ а б Findeis MA (ноябрь 2007 г.). «Роль амилоидного бета-пептида 42 в болезни Альцгеймера». Фармакология и терапия. 116 (2): 266–86. Дои:10.1016 / j.pharmthera.2007.06.006. PMID 17716740.
- ^ Braak H; Braak E; Бол Дж (1993). «Постановка корковой деструкции, связанной с болезнью Альцгеймера». Европейская неврология. 33 (6): 403–8. Дои:10.1159/000116984. PMID 8307060.
дальнейшее чтение
- Jellinger KA. Нейродегенеративные Erkrankungen (ZNS) - Eine aktuelle Übersicht. Journal für Neurologie, Neurochirurgie und Psychiatrie. 2005;6(1):9-18.
- Круз Л., Урбанц Б., Булдырев С.В. и др. (Июль 1997 г.). «Агрегация и дезагрегация сенильных бляшек при болезни Альцгеймера». Труды Национальной академии наук Соединенных Штатов Америки. 94 (14): 7612–6. Дои:10.1073 / пнас.94.14.7612. ЧВК 23870. PMID 9207140.
