Триметилсиланол - Trimethylsilanol
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Триметилсиланол[1] | |||
| Другие имена Гидрокси (триметил) силан[1] | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.012.650 | ||
| Номер ЕС |
| ||
| MeSH | Триметилсиланол | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C3ЧАС10ОSi | |||
| Молярная масса | 90.197 г · моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Точка кипения | 99 ° С (210 ° F, 372 К) | ||
| Давление газа | 21 мбар (20 ° C) [2] | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Триметилсиланол (ТМС) является кремнийорганическое соединение по формуле (CH3)3SiOH. Центр Si несет три метил группы и один гидроксил группа. Это бесцветная летучая жидкость.[3][4]
Возникновение и производство
Вхождение
ТМС является загрязнителем в атмосфере космический корабль, где он возникает из-за деградации силикон материалы на основе.[5] В частности, это летучий продукт из гидролиз из полидиметилсилоксан, которые обычно заканчиваются триметилсилильными группами:
- (CH3)3SiO [Si (CH3)2O]пR + H2O → (CH3)3SiOH + HO [Si (CH3)2O]пр
TMS и связанные с ними летучие силоксаны образуются в результате гидролиза материалов, содержащих силиконы, которые находятся в моющие средства и косметическая продукция.
Следы триметилсиланола вместе с другими летучими силоксаны, присутствуют в биогаз и свалочный газ, опять же в результате деградации силиконы. При их сгорании образуются частицы силикаты и микрокристаллический кварц, которые вызывают истирание деталей двигателя внутреннего сгорания, они создают проблемы для использования таких газов в двигателях внутреннего сгорания.[6]
Производство
Триметилсиланол нельзя получить простым гидролизом хлортриметилсилан, поскольку эта реакция приводит к этерификация товар гексаметилдисилоксан, из-за побочный продукт соляная кислота.[7]
Триметилсиланол доступен слабо базовый гидролиз, поскольку таким образом можно избежать димеризации.[8] Триметилсиланол также можно получить основным гидролиз гексаметилдисилоксана.[9]
Использовать
Как и другие силанолы, триметилсиланол тестируется на предмет использования в качестве противомикробного агента.[10]
ТМС используется для гидрофобного покрытия силикатных поверхностей. Он реагирует с силанольные группы (Р3SiOH) подложки, в результате чего образуется слой метильных групп.
Характеристики
Триметилсиланол - летучая органическая жидкость с температурой кипения 98 ° C.[11] В теплота испарения составляет 45,64 кДж · моль−1, энтропия испарения 123 Дж · К−1· Моль−1.[2] В давление газа функция по Антуану получается как журнал10(P / 1 бар) = A - B / (T + C) (P в барах, T в K) с A = 5,44591, B = 1767,766 K и C = -44,888 К в диапазоне температур от 291 K до 358 К.[2] Ниже точки плавления при -4,5 ° C,[12] соединение затвердевает в моноклинной кристаллической решетке.[13] Триметилсиланол - слабая кислота с pKа ценить из 11.[14] Кислотность сравнима с кислотностью ортокремниевая кислота, но намного выше, чем у спиртов, подобных терт-бутанол (pKа 19[14]).
Рекомендации
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 696. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б c Grubb, W.T .; Остхофф, Р.К .: Физические свойства кремнийорганических соединений. II. Триметилсиланол и триэтилсиланол в Варенье. Chem. Soc. 75 (1953) 2230–2232; Дои:10.1021 / ja01105a061.
- ^ Пол Д. Ликисс: Синтез и структура органосиланолов., Успехи неорганической химии 1995 г., том 42, страницы 147–262, Дои:10.1016 / S0898-8838 (08) 60053-7.
- ^ Вадапалли Чандрасекар, Рамамурти Бумишанкар, Сельвараджан Нагендран: Последние достижения в синтезе и структуре органосиланолов, Chem. Rev.2004, том 104, стр. 5847–5910, Дои:10.1021 / cr0306135.
- ^ Триметилсиланол, Гарольд Л. Каплан, Мартин Э. Коулман, Джон Т. Джеймс: Предельно допустимые концентрации отдельных загрязняющих веществ в космическом аппарате, Том 1 (1994).
- ^ http://epics.ecn.purdue.edu/bgi/Documents/Fall%25202009/Removal_of_Siloxanes_.pdf[мертвая ссылка ]
- ^ Дидье Астрюк: Металлоорганическая химия и катализ. Springer Science & Business Media, 2007 г., ISBN 978-3-540-46129-6, С. 331 ([1], п. 331, в Google Книги ).
- ^ J.A. Селла, Дж. К. Карпентер: Процедуры приготовления силанолов в J. Organomet. Chem. 480 (1994), 23–23; Дои:10.1016 / 0022-328X (94) 87098-5
- ^ M. Lovric, I. Cepanec, M. Litvic, A. Bartolincic, V. Vinkovic: Croatia Chem. Acta 80 (2007), 109–115
- ^ Юн-ми Ким, Сэмюэл Фарра, Рональд Х. Бэйни (2006). «Силанол - противомикробный агент нового класса». Электронный журнал биотехнологии. 9 (2): 176. Дои:10.2225 / vol9-issue2-fulltext-4.CS1 maint: несколько имен: список авторов (связь)
- ^ Степовик, Л. П .; Казакина, С.В .; Мартынова И. М. в Русский Журнал общей химии - англ. Версия 70 (2000) 1371–1377 или Журнал общей химии 70 (2000) 1459–1461.
- ^ Batuew et al. в Докладах Академии Наук СССР 95 (1954) 531.
- ^ Шаблон: ZNaturforsch
- ^ а б Т. Кагия, Ю. Сумида, Т. Тачи: Инфракрасное спектроскопическое исследование взаимодействия водородных связей. Структурные исследования протонодонорных и принимающих сил в Быке. Chem. Soc. Jpn. 43 (1970), 3716–3722.

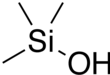

![{displaystyle mathrm {2; ClSileft (CH_ {3} ight) _ {3} {xrightarrow [{- HCl}] {+ H_ {2} O}} 2; HOSileft (CH_ {3} ight) _ {3} { xrightarrow [{- H_ {2} O}] {}} влево (CH_ {3} ight) _ {3} Si {-} O {-} Sileft (CH_ {3} ight) _ {3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/666449834b3929fc062ad1319a5e906a5b360059)