Синтез кетона Вайнреба - Weinreb ketone synthesis
| Синтез кетона Вайнреба | |
|---|---|
| Названный в честь | Стивен М. Вайнреб |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Вайнреб-кетон-синтез |
В Синтез кетонов Вайнреба-Нама это химическая реакция, используемая в органическая химия сделать углерод-углеродные связи. Он был открыт в 1981 г. Стивен М. Вайнреб и Стивен Нахм как метод синтеза кетоны.[1] Первоначальная реакция включала два последовательных нуклеофильные ацильные замещения: преобразование хлорангидрид с N, O-диметилгидроксиламин, чтобы сформировать Вайнреб-Нахм амид, и последующая обработка этого вида металлоорганический реагент, такой как Реактив Гриньяра или литийорганический реагент. Нахм и Вайнреб также сообщили о синтезе альдегиды к снижение из амид с избытком литийалюминийгидрид (увидеть восстановление амида ).

Основное преимущество этого метода перед добавлением металлоорганических реагентов к более типичным ацильным соединениям состоит в том, что он позволяет избежать общей проблемы избыточного добавления. Для этих последних реакций два эквиваленты входящей группы добавить, чтобы сформировать алкоголь а не кетон или альдегид. Это происходит даже при тщательном контроле эквивалентов нуклеофила.

С тех пор амид Вайнреба-Нама был принят в регулярное использование химиками-органиками как надежный метод синтеза кетонов. Эти функциональные группы присутствуют в большом количестве натуральные продукты и может надежно реагировать с образованием новых углерод-углеродных связей или превращаться в другие функциональные группы. Этот метод использовался в ряде синтезов, включая макросфелиды A и B,[2] Амфидинолид J,[3] и спирофунгины А и В.[4] (Видеть Объем ниже)
Механизм
Вайнреб и Нахм первоначально предложили следующее механизм реакции для объяснения селективности, проявляемой в реакциях амида Вайнреба-Нама. Их предложение заключалось в том, что тетраэдрический промежуточный (А ниже) образовались в результате нуклеофильное присоединение посредством металлоорганический реагент стабилизирован хелатирование от метокси группа, как показано.[1] Этот промежуточный продукт стабилен только при низких температурах, требуя низких температур. утолить.

Это хелатирование противоречит механизму образования продукта сверхдобавления, в котором коллапс тетраэдрического промежуточного соединения делает возможным второе добавление. Механистическая гипотеза Вайнреба была немедленно принята академическим сообществом, но только в 2006 году она была подтверждена спектроскопическим и кинетическим анализами.[5]
Подготовка
В дополнение к первоначальной процедуре, показанной выше (которая может иметь проблемы совместимости с чувствительными субстратами), амиды Вайнреба могут быть синтезированы из различных ацил соединения. В подавляющем большинстве этих процедур используется коммерчески доступная соль. N, O-диметилгидроксиламин гидрохлорид [MeO (Me) NH • HCl], с которым обычно легче обращаться, чем со свободным амином.[6]
Лечение сложный эфир или лактон с AlMe3 или AlMe2Cl дает соответствующий амид Вайнреба с хорошими выходами. Альтернативно, ненуклеофильные реагенты Гриньяра, такие как изопропилмагнийхлорид, могут использоваться для активации амина перед добавлением сложного эфира.[7]
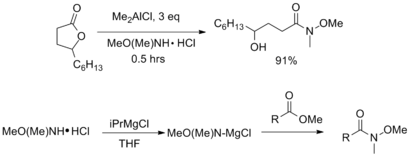
Разнообразие пептидное связывание реагенты также могут быть использованы для получения амидов Вайнреба-Нама из карбоновых кислот. Разные карбодиимид -, гидроксибензотриазол -, и трифенилфосфин специально для этой цели сообщалось о муфтах на основе.[6][7]

Наконец, реакция аминокарбонилирования, описанная Стивеном Бухвальдом, позволяет превращать арил галогениды непосредственно в арил амиды Вайнреба – Нама.[8]

Объем
Стандартные условия для синтеза кетона Вайнреба-Нама, как известно, допускают широкий спектр функциональных групп в других частях молекулы, включая замещение альфа-галогеном, N-защищенный аминокислоты, α-β ненасыщенность, силиловые эфиры, разные лактамы и лактоны, сульфонаты, сульфинаты и сложные эфиры фосфоновой кислоты.[6][7] В сочетании с амидом можно использовать самые разные нуклеофилы. Литиаты и Реактивы Гриньяра чаще всего используются; примеры с участием алифатический, винил, арил, и алкинил углерод нуклеофилы не поступало. Однако с сильноосновными или стерически затрудненными нуклеофилами отщепление метоксидной части с высвобождением формальдегида может происходить как значимая побочная реакция.[9]

Тем не менее, амид Weinreb-Nahm играет важную роль во многих синтезах, выступая в качестве важного партнера для связывания различных фрагментов. Ниже показаны ключевые этапы с участием амидов Вайнреба в синтезе нескольких природных продуктов, в том числе членов иммунодепрессант семейство Macrosphelides и антибиотик семейство спирофунгинов.[2][3][4]

Вариации
Реакция амидов Вайнреба – Нама с Реагенты Виттига был выполнен, чтобы избежать иногда жестких условий, необходимых для добавления гидридных реагентов или металлоорганических соединений. Это дает N-метил-N-метокси-енамин который превращается в соответствующий кетон или альдегид при гидролитической обработке.[10]

Кроме того, был разработан однореакторный обмен магний-галоген с последующим арилированием, демонстрирующий стабильность амида Вайнреба-Нама и обеспечивающий простой в эксплуатации метод синтеза арилкетонов.[11]
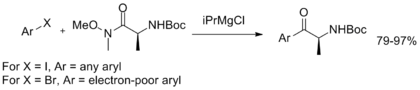
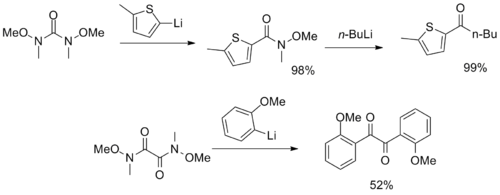
Были синтезированы более необычные реагенты с множественными функциональными группами Вайнреба-Нама, служащие в качестве CO2 и α-дикетон синтоны.[12][13]
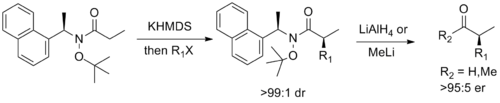
В заключение, Стивен Дж. Дэвис из Оксфорд разработал хиральный вспомогательный который сочетает в себе функциональность амида Weinreb с функциональностью Myers ’ псевдоэфедрин вспомогательный, позволяющий диастереоселективный энолировать алкилирование с последующим легким расщеплением до соответствующего энантиообогащенного альдегида или кетона.[14]
Смотрите также
Рекомендации
- ^ а б Nahm, S .; Вайнреб, С. М. (1981), «N-метокси-н-метиламиды как эффективные ацилирующие агенты», Буквы Тетраэдра, 22 (39): 3815–3818, Дои:10.1016 / s0040-4039 (01) 91316-4
- ^ а б Paek, S.-M .; Seo, S.-Y .; Kim, S.-H .; Jung, J.-W .; Lee, Y.-S .; Jung, J.-K .; Сух, Ю.-Г. (2005), «Краткий синтез (+) - макросфелидов A и B», Органические буквы, 7 (15): 3159–3162, Дои:10.1021 / ol0508429, PMID 16018610
- ^ а б Barbazanges, M .; Meyer, C .; Косси, Дж. (2008), «Полный синтез амфидинолида J», Органические буквы, 10 (20): 4489–4492, Дои:10.1021 / ol801708x, PMID 18811171
- ^ а б Shimizu, T .; Satoh, T .; Муракоши, К .; Содеока, М. (2005), «Асимметричный тотальный синтез (-) - Спирофунгина А и (+) - Спирофунгина B», Органические буквы, 7 (25): 5573–5576, Дои:10.1021 / ol052039k, PMID 16320994
- ^ Qu, B .; Коллум, Д. Б. (2006), "Механизм ацилирования фенилацетилида лития амидом Вейнреба", Журнал органической химии, 71 (18): 7117–7119, Дои:10.1021 / jo061223w, PMID 16930080
- ^ а б c Сингх, Дж .; Satyamurthi, N .; Айдхен, И. С. (2000), "Растущая синтетическая ценность амида Вайнреба", Journal für praktische Chemie, 342: 340, Дои:10.1002 / (sici) 1521-3897 (200004) 342: 4 <340 :: aid-prac340> 3.0.co; 2-1
- ^ а б c Mentzel, M .; Хоффманн, Х. М. Р. (1997), "N-метокси-N-метиламиды (амиды Вайнреба) в современном органическом синтезе", Journal für Praktische Chemie / Chemiker-Zeitung, 339: 517–524, Дои:10.1002 / prac.19973390194
- ^ Martinelli, J. R .; Freckmann, D. M. M .; Бухвальд, С. Л. (2006), "Удобный способ получения амидов Вайнреба посредством катализируемого палладием аминокарбонилирования арилбромидов при атмосферном давлении", Органические буквы, 8 (21): 4843–4846, Дои:10.1021 / ol061902t, PMID 17020317
- ^ Graham, S.L .; Шольц, Т. Х. (1990), «Новый режим реакционной способности N-метокси-N-метиламидов с сильноосновными реагентами», Буквы Тетраэдра, 31 (44): 6269–6272, Дои:10.1016 / с0040-4039 (00) 97039-4
- ^ Hisler, K .; Tripoli, R .; Мерфи, Дж. А. (2006), "Реакции амидов Вайнреба: образование альдегидов реакциями Виттига", Буквы Тетраэдра, 47 (35): 6293–6295, Дои:10.1016 / j.tetlet.2006.06.118
- ^ Конрад, К .; Hsiao, Y .; Миллер, Р. (2005), "Практический процесс синтеза α-аминоарилкетона в одной емкости", Буквы Тетраэдра, 46 (49): 8587–8589, Дои:10.1016 / j.tetlet.2005.09.183
- ^ Whipple, W. L .; Райх, Х. Дж. (1991), «Использование N, N'-диметокси-N, N'-диметилмочевины в качестве эквивалента карбонильного дикатона в реакциях металлоорганического присоединения. Синтез несимметричных кетонов», Журнал органической химии, 56 (8): 2911–2912, Дои:10.1021 / jo00008a057
- ^ Sibi, M. P .; Sharma, R .; Полсон, К. Л. (1992), «N, N'-диметокси-N, N-диметилэтандиамид: полезный α-оксо-N-метокси-N-метиламид и 1,2-дикетон синтон», Буквы Тетраэдра, 33: 1941, Дои:10.1016 / 0040-4039 (92) 88108-ч
- ^ Davies, S.G .; Goodwin, C.J .; Hepworth, D .; Робертс, П. М .; Томсон, Дж. Э. (2010), "О происхождении диастереоселективности в алкилировании енолатов, производных N-1- (1'-нафтил) этил-O-трет-бутилгидроксаматов: хиральные эквиваленты амида Вайнреба", Журнал органической химии, 75 (4): 1214–1227, Дои:10.1021 / jo902499s, PMID 20095549
