Реакция Виттига - Википедия - Wittig reaction
| Реакция Виттига | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Названный в честь | Георг Виттиг | ||||||||||
| Тип реакции | Реакция сцепления | ||||||||||
| Реакция | |||||||||||
| |||||||||||
| Условия | |||||||||||
| Типичные растворители | обычно THF или же диэтиловый эфир | ||||||||||
| Идентификаторы | |||||||||||
| марш Продвинутая органическая химия | 16–44 (6-е изд.) | ||||||||||
| Портал органической химии | реакция Виттига | ||||||||||
| RSC ID онтологии | RXNO: 0000015 | ||||||||||
| | |||||||||||
В Реакция Виттига или олефинирование по Виттигу является химическая реакция из альдегид или же кетон с трифенилом илид фосфония (часто называемый Реагент Виттига) дать алкен и оксид трифенилфосфина.

Он широко используется в органический синтез для приготовления алкенов.[1][2][3] Не следует путать с Перестановка Виттига.
Реакции Виттига чаще всего используются для связывания альдегидов и кетонов с однократно замещенным трифенилфосфонием. илиды. Для реакции с альдегидами геометрию двойной связи легко предсказать, исходя из природы илида. С нестабилизированными илидами (R3 = алкил) это приводит к (Z) -алкен продукт с селективностью от средней до высокой. Со стабилизированными илидами (R3 = сложный эфир или кетон), (E) -алкен образуется с высокой селективностью. (E)/(Z) селективность часто низка с полустабилизированными илидами (R3 = арил).[4]
Чтобы получить (E) -алкен для нестабилизированных илидов, можно использовать модификацию Шлоссера реакции Виттига. В качестве альтернативы Юлия олефинирование и его варианты также предоставляют (E) -алкен выборочно. Обычно Реакция Хорнера – Уодсворта – Эммонса предоставляет (E) -еноат (α, β-ненасыщенный эфир), как и реакция Виттига. Чтобы получить (Z) -enoate, можно использовать модификацию Стилла-Дженнари реакции Хорнера-Уодсворта-Эммонса.
Механизм реакции
Классический механизм
Стерическая масса илида 1 влияет на стереохимический исход нуклеофильное присоединение дать преобладание бетаин 3 (ср. Угол Бюрги-Дуница ). Обратите внимание, что для бетаина 3 оба R1 и R2 а также PPh3+ и O− расположены против друг друга.
Вращение углерод-углеродной связи дает бетаин 4, который затем формирует оксафосфетан 5. Удаление дает желаемый Z-алкен 7 и оксид трифенилфосфина 6. С простыми реактивами Виттига первый шаг выполняется легко с обоими альдегиды и кетоны, и разложение бетаина (с образованием 5) это этап определения ставки. Однако с стабилизированные илиды (где R1 стабилизирует отрицательный заряд) первая стадия является самой медленной, поэтому общая скорость образования алкена снижается, и большая часть алкенового продукта составляет Е-изомер. Это также объясняет, почему стабилизированные реагенты плохо реагируют с стерически затрудненные кетоны.
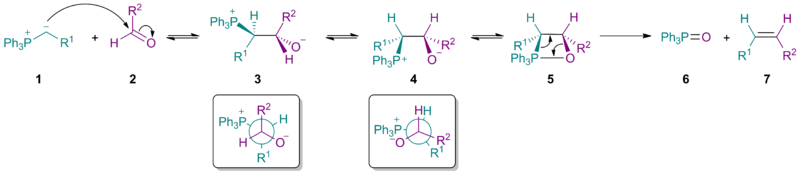
Механизм
Механистические исследования были сосредоточены на нестабилизированных илидах, поскольку за промежуточными продуктами могут следовать ЯМР-спектроскопия. Существование и взаимное превращение бетаина (3а и 3b) является предметом постоянных исследований.[5] Что касается реакций Виттига без лития, то самые последние исследования подтверждают согласованное образование оксафосфетана без вмешательства бетаина. В частности, илиды фосфония 1 реагировать с карбонильными соединениями 2 через [2 + 2] циклоприсоединение это иногда описывается как наличие [π2s+π2а] топология для прямого образования оксафосфетанов 4а и 4b. В безлитиевых условиях стереохимия продукта 5 происходит из-за кинетически контролируемого добавления илида 1 к карбонилу 2. Когда присутствует литий, может быть уравновешивание промежуточных продуктов, возможно, через бетаиновые формы 3а и 3b.[6][7][8] Брюс Э. Марьянов и А. Б. Райтц определили проблему уравновешивания промежуточных продуктов Виттига и назвал процесс «стереохимическим дрейфом». В течение многих лет предполагалось, что стереохимия реакции Виттига с точки зрения образования углерод-углеродной связи напрямую соответствует Z / E стереохимии алкеновых продуктов. Однако некоторые реагенты не следуют этой простой схеме. Литий соли также могут оказывать сильное влияние на стереохимический результат.[9]

Механизмы различаются для алифатический и ароматный альдегиды и для ароматный и алифатический илиды фосфония. Данные свидетельствуют о том, что реакция Виттига неразветвленный альдегиды в условиях отсутствия соли лития не уравновешиваются и поэтому находятся в управление кинетической реакцией.[10][11] Э. Ведейс выдвинул теорию, объясняющую стереоселективность стабилизированных и нестабилизированных реакций Виттига.[12]
Убедительные доказательства указывают на то, что в условиях отсутствия Li реакции Виттига с участием нестабилизированных (R1= алкил, H), полустабилизированный (R1 = арил) и стабилизированный (R1 = EWG) Все реагенты Виттига действуют по механизму [2 + 2] / ретро- [2 + 2] под кинетическим контролем с оксафосфетаном в качестве единственного промежуточного продукта.[13]
Реагенты Виттига

Подготовка
Простые фосфораны обычно легко гидролизуются и окисляются. Поэтому они готовятся с использованием безвоздушные методы. Фосфораны более устойчивы на воздухе, если они содержат группу, отводящую электроны, присоединенную к углероду. Некоторые примеры Ph3P = CHCO2р и Ph3P = CHPh. Эти илиды достаточно стабильны для коммерческой продажи.[14]
Реагенты Виттига обычно готовят из фосфониевая соль, который, в свою очередь, подготовлен кватернизация из трифенилфосфин с алкилгалогенид. Соль алкилфосфония депротонируется сильным основанием, таким как п-бутиллитий:
- [Ph3п+CH2R] X− + C4ЧАС9Li → Ph3P = CHR + LiX + C4ЧАС10
Помимо п-бутиллитий (пBuLi), другие сильные основания, такие как натрий и калий т-бутоксид (тБуОНа, тБуОК), литий, натрий и калий гексаметилдисилазид (LiHMDS, NaHMDS, KHDMS, где HDMS = N (SiMe3)2) или гидрид натрия (NaH). Для стабилизированных реагентов Виттига, содержащих конъюгированные электроноакцепторные группы, можно использовать даже относительно слабые основания, такие как водный гидроксид натрия или карбонат калия.
Определение подходящего основания часто является важным шагом при оптимизации реакции Виттига. Поскольку илиды фосфония выделяются редко, побочные продукты, образующиеся при депротонировании, по существу играют роль добавки в реакции Виттига. В результате выбор основания имеет сильное влияние на эффективность и, когда это применимо, стереохимический результат реакции Виттига.
Один из простейших илидов - это метилентрифенилфосфоран (Ph3P = CH2).[15] Он также является предшественником более сложных реактивов Виттига. Алкилирование Ph3P = CH2 с первичным алкилгалогенидом R − CH2−X, образует замещенные соли фосфония:
- Ph3P = CH2 + RCH2X → Ph3п+ CH2CH2R X−
Эти соли могут быть депротонированный обычным способом дать Ph3P = CH − CH2Р.
Структура илида

Реагент Виттига может быть описан в фосфоран форма (более знакомое представление) или илида форма:

Илидная форма вносит значительный вклад, а атом углерода нуклеофильный.
Объем и ограничения
Реакция Виттига - популярный метод синтеза алкен из кетонов и альдегидов. Реагент Виттига обычно переносит карбонил соединения, содержащие несколько видов функциональных групп, таких как ОЙ, ИЛИ ЖЕ, ароматный нитро и даже сложноэфирные группы[нужна цитата ]. Может быть проблема с стерически затрудненный кетоны, где реакция может быть медленной и давать низкие выходы, особенно со стабилизированными илидами, и в таких случаях Реакция Хорнера – Уодсворта – Эммонса (HWE) (с использованием сложных эфиров фосфоновой кислоты) является предпочтительным. Еще одно известное ограничение - часто лабильный характер альдегиды которые могут окисляться, полимеризоваться или разлагаться. В процессе так называемого тандемного окисления-Виттига образуется альдегид. на месте окислением соответствующего спирта.[16]
Как упоминалось выше, сам реагент Виттига обычно получают из первичного алкилгалогенид. Кватернизация трифенилфосфина большинством вторичных галогенидов неэффективна. По этой причине реактивы Виттига редко используются для получения тетразамещенных алкенов. Однако реагент Виттига допускает множество других вариантов. Он может содержать алкены и ароматические кольца, и он совместим с эфиры и даже сложноэфирные группы. Даже C = O и нитрил группы могут присутствовать, если сопряженный с илидой - это стабилизированные илиды упомянутый выше. Бис-илиды (содержащие две связи P = C) также были получены и успешно использованы.
Одно ограничение связано с стереохимия продукта. С простыми илидами продукт обычно представляет собой Z-изомер, хотя часто образуется и меньшее количество Е-изомера - это особенно верно при использовании кетонов. Если реакция проводится в диметилформамид в присутствии иодид лития или же йодид натрия, продукт почти полностью представляет собой Z-изомер.[17] Если желаемым продуктом является Е-изомер, можно использовать модификацию Шлоссера. В случае стабилизированных илидов продукт в основном представляет собой E-изомер, и этот же изомер также является обычным для реакции HWE.
Модификация Шлоссера

Основным ограничением традиционной реакции Виттига является то, что реакция протекает в основном через эритро бетаин промежуточное соединение, которое приводит к Z-алкену. Эритробетаин можно превратить в треобетаин с помощью фениллитий при низкой температуре.[18] Эта модификация дает Е-алкен.
Аллиловые спирты может быть получен реакцией бетаин-илида со вторым альдегидом.[19] Например:

Примеры
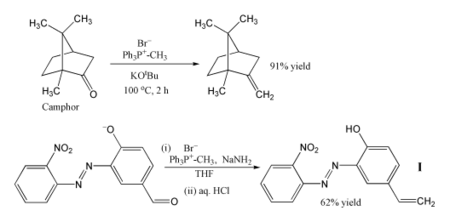
Благодаря своей надежности и широкому применению, реакция Виттига стала стандартным инструментом для химиков-синтетиков.[20]
Наиболее популярное использование реакции Виттига - введение метиленовая группа с помощью метилентрифенилфосфоран (Ph3P = CH2). Используя этот реагент, даже стерически затрудненный кетон, такой как камфора может быть преобразован в его метиленовое производное. В этом случае реагент Виттига готовится на месте путем депротонирования бромид метилтрифенилфосфония с трет-бутоксид калия.[21] В другом примере фосфоран получают с использованием амид натрия в качестве основы, и этот реагент превращает альдегид показан в алкене я с доходностью 62%.[22] Реакция проводится на холоде. THF, а чувствительные нитро, азо и феноксид группы терпимы. Продукт можно использовать для включения фотостабилизатора в полимер, чтобы защитить полимер от повреждений ультрафиолетовая радиация.
Другой пример его использования - синтез лейкотриен А метиловый эфир.[23][24] На первом этапе используется стабилизированный илид, где карбонильная группа сопряжена с илидом, предотвращая самоконденсацию, хотя неожиданно это дает в основном СНГ товар. Во второй реакции Виттига используется нестабилизированный реагент Виттига, и, как и ожидалось, это дает в основном СНГ товар. Обратите внимание, что эпоксид и сложноэфирные функциональные группы сохраняются.

Метоксиметилентрифенилфосфин представляет собой реагент Виттига для омологации альдегидов и кетонов. После реакции Виттига гидролиз метоксиалкена дает энол, который таутомеризуется к альдегиду.
История
О реакции Виттига сообщил в 1954 г. Георг Виттиг и его коллега Ульрих Шёллькопф. Частично за этот вклад Виттиг был удостоен награды Нобелевская премия по химии в 1979 г.[25][26]
Смотрите также
- Кори – Чайковский реактив
- Реакция Хорнера – Уодсворта – Эммонса
- Юлия олефинирование
- Олефинирование Петерсона
- Реактив Теббе
- Фосфорорганическая химия
- Реакция омологации
- Олефинирование Кауфмана
- Метиленирование титана и цинка
Рекомендации
- ^ Меркер, А. Орг. Реагировать. 1965, 14, 270–490. (Рассмотрение)
- ^ В. Каррутерс, Некоторые современные методы органического синтеза, Cambridge University Press, Кембридж, Великобритания, 1971, 81–90. (ISBN 0-521-31117-9)
- ^ Р. В. Хоффманн (2001). «Виттиг и его достижения: все еще актуально после его 100-летия». Angewandte Chemie International Edition. 40 (8): 1411–1416. Дои:10.1002 / 1521-3773 (20010417) 40: 8 <1411 :: AID-ANIE1411> 3.0.CO; 2-U. PMID 11317288.
- ^ Робьетт, Рафаэль; Ричардсон, Джеффри; Aggarwal, Varinder K .; Харви, Джереми Н. (1 февраля 2006 г.). «Реакционная способность и селективность в реакции Виттига: вычислительное исследование». Журнал Американского химического общества. 128 (7): 2394–2409. Дои:10.1021 / ja056650q. ISSN 0002-7863. PMID 16478195.
- ^ Э. Ведейс и К. Ф. Март (1990). «Механизм реакции Виттига: доказательства против промежуточных продуктов бетаина». Варенье. Chem. Soc. 112 (10): 3905–3909. Дои:10.1021 / ja00166a026.
- ^ Брюс Э. Марьянов, А. Б. Рейц, М. С. Муттер, Р. Р. Иннерс и Х. Р. Алмонд, младший, "Подробные исследования скорости реакции Виттига нестабилизированных фосфор-илидов через 31П, 1Рука 13Спектроскопия ЯМР 13С. Понимание кинетического и термодинамического контроля стереохимии », J. Am. Chem. Soc., 107, 1068–1070 (1985)
- ^ Брюс Э. Марьянов, А. Б. Рейц, Д. В. Граден и Х. Р. Алмонд, младший, "Исследование скорости ЯМР реакции Виттига 2,2-диметилпропаналя и трибутилбутилиден-фосфорана", Tetrahedron Lett., 30, 1361–1364 (1989)
- ^ Брюс Э. Марьянофф, А. Б. Рейц, М. С. Муттер, Р. Р. Иннерс, Р. Р. Алмонд, мл., Р. Р. Уиттл, Р. А. Олофсон, "Стереохимия и механизм реакции Виттига. Промежуточные продукты диастереомерной реакции и анализ хода реакции", J. Am . Chem. Soc., 108, 7664–7678 (1986)
- ^ А. Б. Рейц, С. О. Норти, А. Д. Джордан, мл., М. С. Муттер и Брюс Э. Марьянов, "Резкая концентрационная зависимость стереохимии в реакции Виттига. Исследование эффекта соли лития", J. Org. Chem., 51, 3302–3308 (1986)
- ^ Э. Ведейс, К. Ф. Март и Р. Руджери (1988). «Заместительные эффекты и механизм Виттига: случай стереоспецифического разложения оксафосфетана». Варенье. Chem. Soc. 110 (12): 3940–48. Дои:10.1021 / ja00220a036.
- ^ Э. Ведейс и К. Ф. Март (1988). «Механизм реакции Виттига: роль заместителей при фосфоре». Варенье. Chem. Soc. 110 (12): 3948–3958. Дои:10.1021 / ja00220a037.
- ^ Ведейс, Э .; Петерсон, М. Дж. Вершина. Стереохим. 1994, 21, 1.
- ^ Бирн, Питер А .; Гилхиани, Деклан Г. (2013). «Современная интерпретация механизма реакции Виттига». Обзоры химического общества. 42 (16): 6670–96. Дои:10.1039 / c3cs60105f. HDL:10197/4939. ISSN 0306-0012. PMID 23673458.
- ^ «(Карбэтоксиметилен) трифенилфосфоран». Сигма-Олдрич. Получено 27 июн 2019.
- ^ Виттиг; Шёллькопф, У. (1960). «Метиленциклогексан (описывает Ph3PCH2". 40: 66. Дои:10.15227 / orgsyn.040.0066. Цитировать журнал требует
| журнал =(помощь) - ^ Ричард Дж. К. Тейлор, Леони Кэмпбелл и Грэм Д. Макаллистер (2008). "(±) транс-3,3 '- (1,2-Циклопропандиил) бис-2- (E) -пропеновая кислота, диэтиловый эфир: процедура тандемного окисления (TOP) с использованием MnO2 Улавливание стабилизированного окислением фосфорана " (PDF). Органический синтез. 85: 15–26.CS1 maint: несколько имен: список авторов (связь)
- ^ Л. Д. Бергельсон и М. М. Шемякин (1964). «Синтез природных ненасыщенных жирных кислот с помощью стерически контролируемого карбонильного олефинирования». Энгью. Chem. 3 (4): 250–260. Дои:10.1002 / anie.196402501.
- ^ М. Шлоссер и К. Ф. Кристманн (1966). «Транс-селективный синтез олефинов». Angewandte Chemie International Edition на английском языке. 5 (1): 126. Дои:10.1002 / anie.196601261.
- ^ Э. Дж. Кори и Х. Ямамото (1970). «Модификация реакции Виттига, позволяющая стереоспецифический синтез некоторых тризамещенных олефинов. Стереоспецифический синтез α-санталола». Варенье. Chem. Soc. 92 (1): 226–228. Дои:10.1021 / ja00704a052.
- ^ Б. Э. Марьянов и А. Б. Рейц (1989). «Реакция олефинирования Виттига и модификации с участием карбанионов, стабилизированных фосфорилом. Стереохимия, механизм и отдельные аспекты синтеза». Chem. Ред. 89 (4): 863–927. Дои:10.1021 / cr00094a007.
- ^ Fitjer, L .; Куабек, У. Синтетические коммуникации 1985, 15(10), 855–864.
- ^ Ф. А. Боттино, Г. Ди Паскуале, А. Полличино, А. Рекка и Д. Т. Кларк (1990). «Синтез мономеров 2- (2-гидроксифенил) -2H-бензотриазола и исследования фотостабилизации поверхности родственных сополимеров». Макромолекулы. 23 (10): 2662–2666. Bibcode:1990MaMol..23.2662B. Дои:10.1021 / ma00212a011.CS1 maint: несколько имен: список авторов (связь)
- ^ И. Эрнест, А. Дж. Майн и Р. Менассе (1982). «Синтез 7-цис-изомера природного лейкотриена d4". Буквы Тетраэдра. 23 (2): 167–170. Дои:10.1016 / S0040-4039 (00) 86776-3.
- ^ Э. Дж. Кори, Д. А. Кларк, Г. Гото, А. Марфат, К. Миосковски, Б. Самуэльссон и С. Хаммарстрём (1980). «Стереоспецифический тотальный синтез« медленно реагирующего вещества »анафилаксии, лейкотриена С-1». Варенье. Chem. Soc. 102 (4): 1436–1439. Дои:10.1021 / ja00524a045.CS1 maint: несколько имен: список авторов (связь)
- ^ Георг Виттиг, Ульрих Шёллькопф (1954). "Убер-трифенил-фосфин-метилен и олефинбилденде Reagenzien I". Chemische Berichte. 87 (9): 1318. Дои:10.1002 / cber.19540870919.
- ^ Георг Виттиг; Вернер Хааг (1955). "Убер-трифенил-фосфин-метилен и олефинбилденде Reagenzien II". Chemische Berichte. 88 (11): 1654–1666. Дои:10.1002 / cber.19550881110.
внешняя ссылка
- Реакция Виттига в Органический синтез, Сб. Vol. 10, стр. 703 (2004 г.); Vol. 75, стр. 153 (1998). (Статья )
- Реакция Виттига в Органический синтез, Сб. Vol. 5, стр. 361 (1973); Vol. 45, стр. 33 (1965). (Статья )
