Семейство альдегиддегидрогеназ 18, член A1 - Aldehyde dehydrogenase 18 family, member A1
Дельта-1-пирролин-5-карбоксилат синтетаза (P5CS) является фермент что у людей кодируется ALDH18A1 ген.[5][6]Этот ген является членом альдегиддегидрогеназа семья и кодирует бифункциональный АТФ - и НАДФН -зависимый митохондриальный фермент с гамма-глутамилом киназа и гамма-глутамил фосфат редуктаза виды деятельности. Закодированный белок катализирует сокращение глутамат в дельта-1-пирролин-5-карбоксилат, критический шаг в биосинтез de novo из пролин, орнитин и аргинин. Мутации в этом гене приводят к гипераммониемия, гипоорнитинемия, гипоцитруллинемия, гипоаргининемия и гипопролинемия и могут быть связаны с нейродегенерация, катаракта и заболевания соединительной ткани. Альтернативно сращивание стенограмма варианты, кодирующие разные изоформы, были описаны для этого гена.[6]
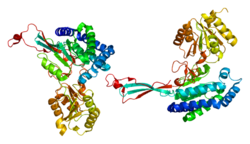
Структура
P5CS состоит из двух доменов: гамма-глутамилкиназы и гамма-глутамилфосфатредуктазы, каждый из которых используется для завершения двух этапов создания орнитина и пролина. В домен гамма-глутамилкиназы используется 367-остаток цепь, которая складывается в N-концевой аминокислотный киназный домен, ответственный за катализ и ингибирование пролина, и C-терминал PUA РНК связывающий домен. Этот фермент также является тетрамер сформированный двумя димеры, а мономеры и димеры собраны таким образом, чтобы позволить активным карманам аминокислотной киназы быть альтернативно ориентированы в тетрамере.[7] Короткая версия (P5CS.short) и длинная версия (P5CS.long) PC5S представляют собой две изоформы этого фермента, которые отличаются добавлением двух аминокислот в длинной форме и дополнительной вставкой из 6 п.н. после + 711 п.н. . Эта небольшая разница создает резкую разницу в том, как на них влияет торможение орнитина.[8] В ALDH18A1 ген охватывает 15 kb, отображается на 10q24.3 и имеет экзон количество 18.[6][9]
Функция
P5CS катализирует фосфорилирование - и снижение -превращение глутамата в дельта-1-пирролин-5-карбоксилат (P5C). Это происходит посредством процесса, в котором глутамат превращается в гамма-глутамилфосфат в домене гамма-глутамилкиназы, а затем гамма-глутамилфосфат превращается в гамма-глутамил полуальдегид в домене гамма-глутамилфосфатредуктазы. Гамма-глутаминовый полуальдегид находится в таутомерный равновесие с P5C, и это обязательно средний во взаимном превращении пролина, орнитина и глутамата.[9] Две изоформы (PC5S.short и PC5S.long) также участвуют в различных действиях. Короткая версия имеет высокую активность кишечника и является основным участником биосинтез аргинина. Длинная версия PC5S экспрессируется в различных тканях и важна из-за ее способности синтезировать пролин из глутамата. Кроме того, короткая версия ингибируется орнитином, тогда как длинная версия нечувствительна к аминокислоте.[10]
Клиническое значение
Орнитин и / или аргинин являются ключевыми промежуточными соединениями для синтеза мочевина, креатин, оксид азота, полиамины, и белок; в то время как пролин является основным компонентом белков соединительной ткани, коллаген и эластин. Поскольку все три из этих аминокислот являются частью очень важных процессов, присутствие P5CS становится важным регулятором, который гарантирует, что ни одна из этих трех не станет дефицитной.[11] Следовательно, отсутствие P5CS из-за мутаций в ALDH18A1 ген, часто приводит к нейродегенерации, слабость суставов, кожа гиперэластичность двусторонняя субкапсулярная катаракта и множество других осложнений, связанных с нарушением синтеза пролина и орнитина.[10]
Взаимодействия
Было замечено, что P5CS взаимодействует с:[требуется разъяснение ]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000059573 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000025007 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Лю Дж., Маунори К., Камун П., Арал Б. (октябрь 1996 г.). «Отнесение гена человека, кодирующего дельта-1-пирролин-5-карбоксилатсинтетазу (P5CS), к 10q24.3 путем гибридизации in situ». Геномика. 37 (1): 145–6. Дои:10.1006 / geno.1996.0535. PMID 8921385.
- ^ а б c «Ген Entrez: семейство альдегиддегидрогеназы 18 ALDH18A1, член A1».
- ^ Перес-Арельяно I, Кармона-Альварес Ф, Гальего Дж., Сервера Дж. (Декабрь 2010 г.). «Молекулярные механизмы, модулирующие активность глутаматкиназы. Идентификация сайта связывания ингибитора обратной связи пролина». Журнал молекулярной биологии. 404 (5): 890–901. Дои:10.1016 / j.jmb.2010.10.019. PMID 20970428.
- ^ Ху Калифорния, Лин У.В., Оби К., Валле Д. (март 1999 г.). «Молекулярная энзимология дельта-1-пирролин-5-карбоксилатсинтазы млекопитающих. Альтернативное использование донора сплайсинга генерирует изоформы с различной чувствительностью к ингибированию орнитина». Журнал биологической химии. 274 (10): 6754–62. Дои:10.1074 / jbc.274.10.6754. PMID 10037775.
- ^ а б Ху CA, Халил С., Жаоригету С., Лю З., Тайлер М., Ван Дж., Валле Д. (ноябрь 2008 г.). «Дельта1-пирролин-5-карбоксилатсинтаза человека: функция и регуляция». Аминокислоты. 35 (4): 665–72. Дои:10.1007 / s00726-008-0075-0. ЧВК 2707934. PMID 18401542.
- ^ а б Baumgartner MR, Hu CA, Almashanu S, Steel G, Obie C, Aral B, Rabier D, Kamoun P, Saudubray JM, Valle D (ноябрь 2000 г.). «Гипераммонемия с пониженным содержанием орнитина, цитруллина, аргинина и пролина: новая врожденная ошибка, вызванная мутацией в гене, кодирующем дельта (1) -пирролин-5-карбоксилатсинтазу». Молекулярная генетика человека. 9 (19): 2853–8. Дои:10.1093 / hmg / 9.19.2853. PMID 11092761.
- ^ Martinelli D, Häberle J, Rubio V, Giunta C, Hausser I, Carrozzo R, Gougeard N, Marco-Marín C, Goffredo BM, Meschini MC, Bevivino E, Boenzi S, Colafati GS, Brancati F, Baumgartner MR, Dionisi-Vici C (сентябрь 2012 г.). «Понимание недостаточности пирролин-5-карбоксилатсинтетазы: клинические, молекулярные, функциональные и экспрессионные исследования, структурный анализ и новая терапия аргинином». Журнал наследственных метаболических заболеваний. 35 (5): 761–76. Дои:10.1007 / s10545-011-9411-8. PMID 22170564. S2CID 6881255.
внешняя ссылка
- Человек ALDH18A1 расположение генома и ALDH18A1 страница сведений о генах в Браузер генома UCSC.
дальнейшее чтение
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Арал Б., Шленциг Дж. С., Лю Дж., Камун П. (март 1996 г.). «База данных клонирования кДНК дельта-1-пирролин-5-карбоксилатсинтетазы человека (P5CS): бифункциональный фермент, катализирующий первые 2 стадии биосинтеза пролина». Comptes Rendus de l'Académie des Sciences, Série III. 319 (3): 171–8. PMID 8761662.
- Судзуки Ю., Ёситомо-Накагава К., Маруяма К., Суяма А., Сугано С. (октябрь 1997 г.). «Конструирование и характеристика полноразмерной библиотеки кДНК с обогащением по 5'-концу». Ген. 200 (1–2): 149–56. Дои:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Ху Калифорния, Лин У.В., Оби К., Валле Д. (март 1999 г.). «Молекулярная энзимология дельта-1-пирролин-5-карбоксилатсинтазы млекопитающих. Альтернативное использование донора сплайсинга генерирует изоформы с различной чувствительностью к ингибированию орнитина». Журнал биологической химии. 274 (10): 6754–62. Дои:10.1074 / jbc.274.10.6754. PMID 10037775.
- Baumgartner MR, Hu CA, Almashanu S, Steel G, Obie C, Aral B, Rabier D, Kamoun P, Saudubray JM, Valle D (ноябрь 2000 г.). «Гипераммонемия с пониженным содержанием орнитина, цитруллина, аргинина и пролина: новая врожденная ошибка, вызванная мутацией в гене, кодирующем дельта (1) -пирролин-5-карбоксилатсинтазу». Молекулярная генетика человека. 9 (19): 2853–8. Дои:10.1093 / hmg / 9.19.2853. PMID 11092761.
- Baumgartner MR, Rabier D, Nassogne MC, Dufier JL, Padovani JP, Kamoun P, Valle D, Saudubray JM (январь 2005 г.). «Дефицит дельта-1-пирролин-5-карбоксилатсинтазы: нейродегенерация, катаракта и проявления соединительной ткани в сочетании с гипераммонемией и пониженным содержанием орнитина, цитруллина, аргинина и пролина». Европейский журнал педиатрии. 164 (1): 31–6. Дои:10.1007 / s00431-004-1545-3. PMID 15517380. S2CID 10423867.