Реакции карбонильного альфа-замещения - Carbonyl alpha-substitution reactions
Реакции альфа-замещения происходят в положении, следующем за карбонильной группой, в α-положении, и включают замена α водород атом по электрофил, E, через либо энол или же енолят-ион средний.[1]
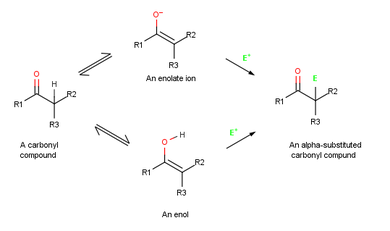
Механизм реакции
Потому что их двойник облигации богаты электронами, енолы ведут себя как нуклеофилы и реагирует с электрофилами примерно так же, как алкены делать. Но из-за резонанса электрон пожертвование одиночной пары электронов на соседний кислород, енолы более богаты электронами и, соответственно, более реакционноспособны, чем алкены. Обратите внимание на следующую карту электростатического потенциала этенола (H2C = CHOH), как на α-углероде присутствует значительная электронная плотность.
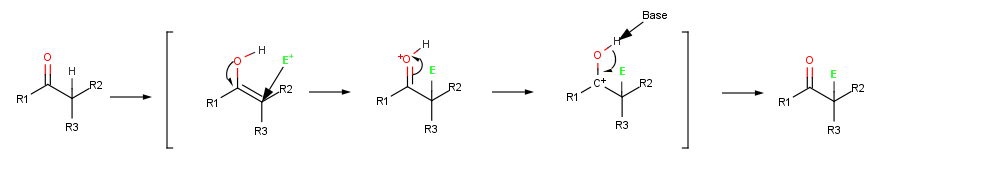
Когда алкен реагирует с электрофилом, например HCl, исходный добавление из H+ дает промежуточный катион и последующая реакция с Cl− дает дополнение товар. Однако, когда енол реагирует с электрофилом, остается только начальная стадия добавления. Вместо реакции с CI− с образованием продукта присоединения промежуточный катион теряет ОН− протон с образованием α-замещенного карбонильное соединение.[1]:845
Альфа-галогенирование альдегидов и кетонов
Особенно распространенная реакция α-замещения в лаборатория это галогенирование из альдегиды и кетоны в их α-положениях по реакции Cl2, Br2 или я2 в кислом растворе. Бром в уксусная кислота часто используется растворитель.
Примечательно, что галогенирование кетонов также происходит в биологические системы, особенно в морских водорослях, где дибромацетальдегид, бромацетон, 1,1,1-трибромацетон и другие родственные соединения.
Галогенирование представляет собой типичную реакцию α-замещения, которая протекает путем катализируемого кислотой образования промежуточного енола.[1]:846
Кислотность альфа-атомов водорода: образование енолят-иона
Водород в α-положении карбонильного соединения слабо кислый и может быть удален сильным основание с образованием енолят-иона. При сравнении ацетон (pKа= 19,3) с этан (pKа= 60), например, наличие соседней карбонильной группы увеличивает кислотность кетона по сравнению с алканом в 10 раз.40.
Абстракция протон от карбонильного соединения происходит, когда связь C-H ориентирована примерно параллельно р орбитали карбонильной группы. Атом углерода енолят-иона sp2-гибридизованный и имеет p-орбиталь, которая перекрывает соседние карбонильные p-орбитали. Таким образом, отрицательный обвинять разделяет электроотрицательный атом кислорода, а енолят-ион стабилизируется резонанс.
Карбонильные соединения более кислые, чем алканы, по той же причине, что карбоновые кислоты более кислые, чем спирты. В обоих случаях анионы стабилизируются резонансом. Enolate ионы Однако они отличаются от карбоксилат-ионов тем, что их две резонансные формы не эквивалентны - форма с отрицательным зарядом на кислороде имеет меньшую энергию, чем форма с зарядом на углероде. Тем не менее, принцип стабилизации резонанса в обоих случаях один и тот же.
Поскольку карбонильные соединения имеют только слабую кислотность, для образования енолят-иона необходимо сильное основание. Если в качестве основания используется алкоксид, такой как этоксид натрия, депротонирование происходит только в пределах примерно 0,1%, поскольку ацетон является более слабой кислотой, чем этанол (pKа= 16). Если, однако, более мощная база, такая как гидрид натрия (NaH) или диизопропиламид лития (LDA ) карбонильное соединение может полностью превратиться в его енолят-ион. Диизопропиламид лития (LDA), который легко получается путем реакции сильного основания. бутиллитий с диизопропиламин, широко используется в лаборатории как основа для получения енолят-ионов из карбонильных соединений.
Многие типы карбонильных соединений, в том числе альдегиды, кетоны, сложные эфиры, тиоэфиры, кислоты, и амиды, может быть преобразован в енолят-ионы реакцией с LDA. Обратите внимание, что нитрилы также являются кислыми и могут превращаться в енолятоподобные анионы (называемые нитрильные анионы Когда атом водорода фланкирован двумя карбонильными группами, его кислотность увеличивается еще больше. Эта повышенная кислотность β-дикарбонильных соединений обусловлена стабилизацией образующихся енолят-ионов путем делокализации отрицательного заряда по обеим карбонильным группам.[1]:850
Реакционная способность енолят-ионов
Енолят-ионы более полезны, чем енолы, по двум причинам. Во-первых, чистые енолы обычно не могут быть выделены; вместо этого они образуются только в виде короткоживущих промежуточных продуктов с низким концентрация. Напротив, стабильные растворы чистых енолят-ионов легко приготовить из большинства карбонильных соединений реакцией с сильным основанием. Во-вторых, енолят-ионы более реакционноспособны, чем енолы, и вступают во многие реакции, в отличие от енолов. В то время как енолы нейтральны, енолят-ионы заряжены отрицательно, что делает их намного лучше нуклеофилов. В результате енолят-ионы более распространены, чем енолы, как в лабораторной, так и в биологической химии.
Поскольку они представляют собой резонансные гибриды двух неэквивалентных форм, енолят-ионы можно рассматривать как виниловые. алкоксиды (C = C- O−) или в виде α-кетокарбанионов (−C-C = O). Таким образом, енолят-ионы могут реагировать с электрофилами либо на кислороде, либо на углероде. Реакция на кислород дает производное енола, тогда как реакция на углерод дает α-замещенное карбонильное соединение. Оба типа реакционной способности известны, но чаще встречается реакция на углерод.[1]:853
Алкилирование енолят-ионов
Возможно, наиболее важной реакцией енолят-ионов является их алкилирование обработкой алкилгалогенид или же тозилат, таким образом формируя новую связь C-C и соединяя две меньшие части в одну большую молекула. Алкилирование происходит, когда нуклеофильный енолят-ион реагирует с электрофильным алкилгалогенидом в SN2 реакция и вытесняет уходящая группа атакой сзади.
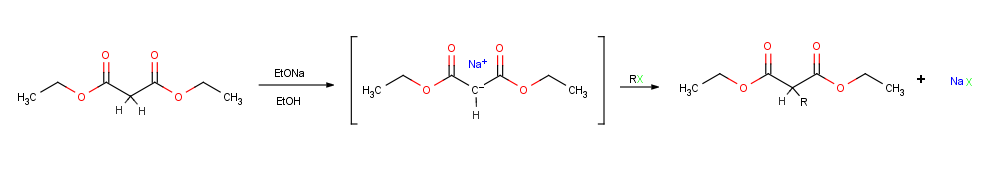
Реакции алкилирования подчиняются тем же ограничениям, которые влияют на все SN.2 реакции. Таким образом, уходящая группа X в алкилирующем агенте R-X может быть хлористый, бромид, йодид, или же тозилат . Алкильная группа R должна быть первичной или метильной, и предпочтительно должна быть аллильный или же бензиловый. Вторичные галогениды реагируют плохо, а третичные галогениды вообще не реагируют, потому что конкурирующий E2 устранение вместо HX. Виниловые и арилгалогениды также не реагируют, потому что обратный доступ стерически предотвращен.[1]:855
