Открытие и разработка бисфосфонатов - Википедия - Discovery and development of bisphosphonates

Бисфосфонаты - важный класс лекарств, впервые представленных около полувека назад. Они используются для лечения остеопороз и другие заболевания костей, которые вызывают хрупкость костей и заболевания, при которых резорбция кости чрезмерно. Остеопороз часто встречается у постменопаузальный женщины и пациенты в кортикостероид лечение, при котором бифосфонаты оказались ценным лечением, а также успешно используются против Болезнь Педжета, миелома, кость метастазы и гиперкальциемия. Бисфосфонаты уменьшают разрушение костей, ингибируя остеокласты, они имеют долгую историю использования, и сегодня на рынке по всему миру представлено несколько различных типов бисфосфонатных препаратов.
Открытие
Бисфосфонаты были первоначально синтезированы в 19 веке и использовались в промышленности для их защита от накипи и антикоррозионные свойства. В конце 1960-х годов стал очевиден их потенциал для лечения заболеваний, связанных с метаболизмом костей. Бисфосфонаты первого поколения включали этидроновая кислота и клодроновая кислота которые были введены в 1970-х и 1980-х годах. Это были первые препараты на основе бисфосфонатов, успешно использованные в клинике.[1] С тех пор они были усовершенствованы с целью сделать их более эффективными, улучшить их распределение внутри кости и увеличить продолжительность действия. Это позволило дать золедронат, самый последний бисфосфонатный препарат, который будет размещен на рынке, в разовой годовой дозе путем внутривенной инфузии.[2]
Развитие
Исходные бисфосфонаты (первое поколение) были простыми молекулами с небольшими группами одиночных атомов или алкил цепи в позиции R1 и R2. Они имели лишь довольно слабый ингибирующий эффект на резорбцию кости. Включение аминогруппы положило начало второму поколению бисфосфонатов с более высокой эффективностью. Первый был памидронат и последовали аналогичные аналоги, в которых положение азота в боковой цепи было ключом к более сильному лекарству. Позже стало очевидно, что азот необязательно должен быть связан с алкильной цепью, но вместо этого нужно использовать гетероциклический группа. Было разработано и выпущено на рынок несколько таких лекарств, среди которых золедронат является наиболее заметным. Минодроновая кислота еще более мощный и был размещен на рынке в Японии. Их эффективность такова, что он эффективен даже в пикомолярной концентрации.[3]
Дальнейшее развитие не привело к выпуску на рынок соединений с одинаковой эффективностью. Арилалкильные заместители памидроната являются одними из самых последних бисфосфонатов, которые будут использоваться в клинической практике, где гидроксильная группа в положении R2 был опущен для обеспечения стабильности.[1]
Недавние исследования в этой области открыли возможность для разработки новых лекарственных препаратов на основе бисфосфонатов.
Бисфосфонаты с более липофильный были разработаны и показали потенциал в качестве противоопухолевого средства. Они действуют по несколько иному механизму, в котором они не только ингибируют ключевой фермент фарнезилпирофосфатсинтазу (FPPS) мевалонатный путь но также геранилгеранилпирофосфатсинтаза (GGPS), фермент, также расположенный в мевалонатном пути. У них нет такой же тяги к костные минералы.[4]
С тех пор GGPS успешно подавляется новым бисфосфонатным соединением с триазол группа внутри R2 и метильная группа в R1. Это может быть полезно при лечении злокачественные новообразования как множественная миелома.[5]
В 2018 г. дендритный был введен бисфосфонат, содержащий три бисфосфонатных звена. Он продемонстрировал потенциал для специфической доставки больших терапевтических молекул в кости за счет использования высокого сродства бисфосфонатов к минералам кости. [6]
Механизм действия

В механизм действия бисфосфонатов (БФ) эволюционировала по мере разработки новых поколений лекарств. Функция бисфосфонатов первого поколения отличается от более современных азот содержащие БП, но оба очевидно интернализированы эндоцитоз мембраносвязанной везикулы, где лекарство, скорее всего, находится в сложный с участием Ca2+ ионы. Это не касается других клеток кости, так как происходит за счет избирательного поглощения остеокластов.[3]
Общая функция, которая применяется ко всем бисфосфонатным препаратам, - это физико-химическое взаимодействие с минералами кости для предотвращения физической резорбции кости костными тканями. остеокласты. Это особенно актуально на сайтах, где ремоделирование костей наиболее активен.[7][8] Бисфосфонаты обладают внутренним сродством к ионам кальция (гидроксиапатит ) костного минерала так же, как эндогенного пирофосфаты. Разница заключается в негидролизуемой углерод-фосфорной связи бисфосфонатов, которая предотвращает их метаболизм и в то же время обеспечивает эффективную поглощение от желудочно-кишечный тракт.[9]
Основное ингибирующее действие первого поколения бисфосфонатов на остеокласты заключается в индукции апоптоз. Механизм действия, по-видимому, заключается в образовании аналога АТФ или метаболита бисфосфонатов, таких как этидроновая кислота и клодроновая кислота. Аналог АТФ накапливается в цитозоль остеокласта с цитотоксическим действием.[10]
Однако основным механизмом действия более развитых азотсодержащих бисфосфонатов является клеточное воздействие на остеокласты за счет ингибирования мевалонатного пути и, в частности, последующего образования изопреноид липиды. Ингибирование происходит в ключевой точке разветвления пути, катализируемого фарнезилпирофосфатсинтазой (FPPS).[11] Изопреноидные липиды необходимы для посттрансляционные модификации малых GTP-связывающих регуляторных белков, таких как Rac, Rho и Ras Рас надсемейство. От них зависит функция остеокластов в различных клеточных процессах, таких как апоптоз.[12]
Структура отношения деятельности
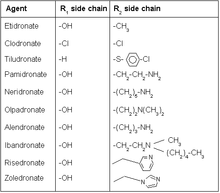
Фармакофор
Бисфосфонаты имитируют эндогенный неорганический пирофосфат где кислород позвоночник заменен на углерод (P-C-P для P-O-P). Две дополнительные группы или боковые цепи на углеродной основе обычно обозначаются как R1 и R2. р1 обычно гидроксил группа, которая усиливает сродство к кальций путем формирования тридентатный лиганд вместе с фосфатными группами. Состав можно сделать более сильнодействующим, оптимизировав структура R2 группа для лучшего подавления резорбция кости.[13]
Фосфонат
Фосфонат группы в химической структуре важны для связывания лекарства с целевым ферментом. Исследования показали, что удаление или замена фосфонатной группы на карбоновая кислота вызывает резкую потерю активности препарата и ингибитор фермента больше не входит в изомеризованное состояние.[14]
Гидроксильная группа (R1 боковая цепь)
Модификация R1 боковая цепь на бисфосфонатах сегодня очень незначительна, единственная гидроксильная группа в этом положении, по-видимому, дает лучшие результаты с точки зрения активности. Гидроксильная группа играет роль в образовании индуцированной водой связи с глутамин (Gln240) на целевой фермент. Лекарства, которые не имеют гидроксильной группы, изначально вызывают лучшее ингибирование, чем исходные соединения, без гидроксильной группы лекарство, кажется, легче вписывается в открытый доступ активный сайт. Однако отсутствие гидроксильной группы снижает способность удерживать целевой ферментный комплекс в изомеризованном состоянии. Биологическая активность бисфосфонатов с гидроксильной группой, следовательно, появляется в течение более длительного времени.[14]
Азот (R2 боковая цепь)
Азот содержащие бисфосфонаты являются наиболее часто используемыми препаратами в этом классе из-за их потенция.[15] Исследования показали, что азот в бисфосфонатах образует водородная связь с участием треонин (Thr201) и карбонил часть Лизин (Lys200) на целевой фермент, тем самым усиливая связывание комплекса. Изменение положения азота может значительно изменить возможность образования водородной связи азота.[14]
| Бисфосфонат | потенция (относительная) |
|---|---|
| Алендронат | 1-5 |
| Ризедронат | 10 |
| Золедронат (IV) | 50 |
Модификация азотсодержащей боковой цепи (R2 боковая цепь)
Увеличенная длина углерода азота R2 боковая цепь изменяет активность. Боковая цепь, состоящая из трех угли Доказано, что это наиболее идеальная длина с точки зрения активности, увеличение или уменьшение длины цепи оттуда отрицательно влияет на биологическую активность. Алендронат, обычное бисфосфонатное лекарство, например, имеет боковую цепь из трех атомов углерода.[17] Ризедронат имеет гетероциклическую структуру, содержащую азот. Гетероциклический азотсодержащие бисфосфонаты показали лучшие результаты с точки зрения активности по сравнению с более ранними бисфосфонатами с азотом, связанным с углеродной цепью. Исследования аналогичного ризедроната с другим размещением азота на кольце не показали заметной разницы в биологической активности. Увеличение длины углеродной цепи, соединенной с кольцом, дало отрицательные результаты.[18] Золедронат является наиболее мощным бисфосфонатным препаратом, доступным сегодня только в виде внутривенная инъекция. Это единственный бисфосфонатный препарат, который имеет две группы азота в боковой цепи, отсюда его эффективность и путь введения отличается от других препаратов того же класса.[16]
использованная литература
- ^ а б Видлер, Лео; Jaeggi, Knut A .; Глатт, Маркус; Мюллер, Клаус; Бахманн, Рольф; Биспинг, Майкл; Родилась Анн-Рут; Кортеси, Рето; Гуилья, Габриэла; Джекер, Хайди; Кляйн, Реми (2002-08-01). «Высокоэффективные геминальные бисфосфонаты. От динатрия памидроната (Aredia) до золедроновой кислоты (Zometa)». Журнал медицинской химии. 45 (17): 3721–3738. Дои:10.1021 / jm020819i. ISSN 0022-2623. PMID 12166945.
- ^ Рид, Ян Р .; Браун, Жак П .; Буркхардт, Питер; Горовиц, Завулон; Ричардсон, Питер; Trechsel, Ulrich; Видмер, Альберт; Девогелар, Жан-Пьер; Кауфман, Жан-Марк; Джагер, Филипп; Тело, Жан-Жак (2002-02-28). «Внутривенное введение золедроновой кислоты у женщин в постменопаузе с низкой минеральной плотностью костей». Медицинский журнал Новой Англии. 346 (9): 653–661. Дои:10.1056 / NEJMoa011807. ISSN 0028-4793.
- ^ а б Томпсон, Кейт; Роджерс, Майкл Дж. (01.09.2007). «Молекулярные механизмы действия бисфосфонатов». Клинические обзоры костного и минерального метаболизма. 5 (3): 130–144. Дои:10.1007 / s12018-007-9004-0. ISSN 1559-0119.
- ^ [1], «Бисфосфонатные соединения и методы с повышенной эффективностью для нескольких целей, включая FPPS, GGPPS и DPPS», выпущенный 11 апреля 2008 г.
- ^ Matthiesen, Robert A .; Варни, Мишель Л .; Сюй, Полина С .; Rier, Alex S .; Вимер, Дэвид Ф .; Гольштейн, Сара А. (январь 2018 г.). «α-Метилирование усиливает действие изопреноидтриазолбисфосфонатов в качестве ингибиторов геранилгеранилдифосфатсинтазы». Биоорганическая и медицинская химия. 26 (2): 376–385. Дои:10.1016 / j.bmc.2017.10.023. ЧВК 5752576. PMID 29248353.
- ^ Шимода, Казума; Мицуока, Такахиро; Уэда, Кента; Суэмунэ, Хироши; Хираи, иди; Асо, Марико (19.12.2018). «Синтез дендритных бисфосфонатов в качестве лигандов нацеливания на кости». Буквы Тетраэдра. 59 (51): 4528–4531. Дои:10.1016 / j.tetlet.2018.11.028. ISSN 0040-4039.
- ^ Masarachia, P .; Weinreb, M .; Balena, R .; Родан, Г. А. (1996-09-01). «Сравнение распределения 3H-алендроната и 3H-этидроната в костях крыс и мышей». Кость. 19 (3): 281–290. Дои:10.1016/8756-3282(96)00182-2. ISSN 8756-3282. PMID 8873969.
- ^ Сато, М; Грассер, Вт; Заканчивается в; Акинс, Р; Simmons, H; Томпсон, Д. Д.; Голуб, Э; Родан, Г. А (1991-12-01). «Действие бисфосфонатов. Локализация алендроната в кости крысы и влияние на ультраструктуру остеокластов». Журнал клинических исследований. 88 (6): 2095–2105. Дои:10.1172 / JCI115539. ISSN 0021-9738. ЧВК 295810. PMID 1661297.
- ^ Benford, Helena L .; Фрит, Джули С .; Ауриола, Сеппо; Мёнкконен, Юкка; Роджерс, Майкл Дж. (1999-07-01). «Фарнезол и геранилгераниол предотвращают активацию каспаз аминобисфосфонатами: биохимические данные для двух различных фармакологических классов бисфосфонатных препаратов». Молекулярная фармакология. 56 (1): 131–140. Дои:10.1124 / моль 56.1.131. ISSN 0026-895X. PMID 10385693.
- ^ Селандер, К. С .; Mönkkönen, J .; Karhukorpi, E.K .; Härkönen, P .; Hannuniemi, R .; Вяэнянен, Х. К. (1996-11-01). «Характеристики апоптоза, вызванного клодронатом в остеокластах и макрофагах». Молекулярная фармакология. 50 (5): 1127–1138. ISSN 0026-895X. PMID 8913344.
- ^ Ebetino, Frank H .; Hogan, Anne-Marie L .; Вс, шутинг; Цумпра, Мария К .; Дуань, Сюйчэнь; Триффитт, Джеймс Т .; Kwaasi, Aaron A .; Данфорд, Джеймс Э .; Барнетт, Бобби Л .; Опперманн, Удо; Ланди, Марк В. (01.07.2011). «Взаимосвязь между химией и биологической активностью бисфосфонатов». Кость. Бисфосфонаты. 49 (1): 20–33. Дои:10.1016 / j.bone.2011.03.774. ISSN 8756-3282. PMID 21497677.
- ^ Coxon, F.P .; Роджерс, М.Дж. (01.01.2003). «Роль пренилированных малых GTP-связывающих белков в регуляции функции остеокластов». Calcified Tissue International. 72 (1): 80–84. Дои:10.1007 / s00223-002-2017-2. ISSN 0171-967X. PMID 12370802.
- ^ Видлер, Лео; Jaeggi, Knut A .; Глатт, Маркус; Мюллер, Клаус; Бахманн, Рольф; Биспинг, Майкл; Родилась Анн-Рут; Кортеси, Рето; Гуилья, Габриэла; Джекер, Хайди; Кляйн, Реми (август 2002 г.). «Высокоэффективные геминальные бисфосфонаты. От динатрия памидроната (Aredia) до золедроновой кислоты (Zometa)». Журнал медицинской химии. 45 (17): 3721–3738. Дои:10.1021 / jm020819i. ISSN 0022-2623.
- ^ а б c Данфорд, Джеймс Э .; Kwaasi, Aaron A .; Роджерс, Майкл Дж .; Барнетт, Бобби Л .; Ebetino, Frank H .; Russell, R. Graham G .; Опперманн, Удо; Кавана, Кэтрин Л. (апрель 2008 г.). «Взаимосвязь между структурой и активностью азотсодержащих бисфосфонатов в клиническом применении и других аналогов: зависимое от времени ингибирование фарнезилпирофосфатсинтазы человека». Журнал медицинской химии. 51 (7): 2187–2195. Дои:10.1021 / jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ Данфорд, Джеймс Э .; Kwaasi, Aaron A .; Роджерс, Майкл Дж .; Барнетт, Бобби Л .; Ebetino, Frank H .; Russell, R. Graham G .; Опперманн, Удо; Кавана, Кэтрин Л. (1 апреля 2008 г.). «Взаимосвязь структуры и активности между азотсодержащими бисфосфонатами в клиническом применении и другими аналогами: зависимое от времени ингибирование фарнезилпирофосфатсинтазы человека». Журнал медицинской химии. 51 (7): 2187–2195. Дои:10.1021 / jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ а б Трипати, К.Д. (2013), «Адренергическая система и лекарства, глава 09», Основы медицинской фармакологии, Jaypee Brothers Medical Publishers (P) Ltd., стр. 124–139, Дои:10.5005 / jp / books / 12021_10, ISBN 9789350259375
- ^ Флейш, Герберт (2002). «Разработка бисфосфонатов». Исследование рака груди. 4 (1): 30–34. Дои:10.1186 / bcr414. ISSN 1465-5411. ЧВК 138713. PMID 11879557.
- ^ van Beek, E. R .; Löwik, C. W. G. M .; Ebetino, F.H .; Папапулос, С. Э. (1998-11-01). «Связывающие и антирезорбтивные свойства гетероциклсодержащих аналогов бисфосфонатов: взаимосвязь структура-активность». Кость. 23 (5): 437–442. Дои:10.1016 / S8756-3282 (98) 00120-3. ISSN 8756-3282. PMID 9823450.
