H2TH домен - H2TH domain
| H2TH | |||||||||
|---|---|---|---|---|---|---|---|---|---|
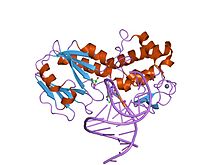 комплекс кристаллической структуры между lactococcus lactis fpg (mutm) и fapy-dg, содержащим ДНК | |||||||||
| Идентификаторы | |||||||||
| Символ | H2TH | ||||||||
| Pfam | PF06831 | ||||||||
| Pfam клан | CL0303 | ||||||||
| ИнтерПро | IPR015886 | ||||||||
| PROSITE | PDOC00956 | ||||||||
| SCOP2 | 1к82 / Объем / СУПФАМ | ||||||||
| |||||||||
В молекулярной биологии H2TH домен (домен helix-2turn-helix) является ДНК переплет домен нашел в ДНК гликозилаза /AP-лиаза ферменты, которые участвуют в базовая эксцизионная пластика ДНК повреждена окисление или по мутагенный агенты. Наибольший ущерб базы в ДНК отремонтирован базовым путем эксцизионного восстановления.[1] Эти ферменты происходят преимущественно из бактерий и обладают как ДНК-гликозилазной активностью EC 3.2.2.- и AP-лиазная активность EC 4.2.99.18. Примеры включают формамидопиримидин-ДНК-гликозилазы (Fpg; MutM) и эндонуклеаза VIII (Nei).
Формамидопиримидин-ДНК-гликозилазы (Fpg, MutM) - это трифункциональный фермент эксцизионной репарации оснований ДНК, который удаляет широкий спектр поврежденных окислением базы (Активность N-гликозилазы; EC 3.2.2.23 ) и раскалывает и 3'- и 5'-фосфодиэфирные связи полученного апуринового / апиримидинового сайта (активность AP-лиазы;EC 4.2.99.18 ). Fpg отдает предпочтение окисленным пурины, исключая окисленные пуриновые основания, такие как 7,8-дигидро-8-оксогуанин (8-oxoG). Его активность AP (апуриновой / апиримидиновой) лиазы вводит разрывы в цепь ДНК, расщепляя основную цепь ДНК за счет удаления бета-дельта, чтобы генерировать однонитевой разрыв в месте удаленного основания с 3'- и 5'-фосфаты. Fpg - это мономер состоит из 2 домены соединены гибким шарниром.[2] Две ДНК-связывающие мотивы (а цинковый палец и мотивы H2TH (спираль-два витка-спираль)) предполагают, что окисленное основание перевернуто из двухцепочечная ДНК в режиме связывания и вырезается каталитический механизм аналогично бифункциональной эксцизионной пластике основания ферменты.[2] Fpg связывает один ион из цинк на конце C, который содержит четыре консервированный и существенный цистеины.[3][4]
Эндонуклеаза VIII (Nei) имеет ту же ферментативную активность, что и указанный выше Fpg (EC 3.2.2.-,EC 4.2.99.18 ), но с предпочтением окисленных пиримидины, например тимингликоль, 5,6-дигидроурацил и 5,6-дигидротимин.[5] Эти белки содержать три структурный домены: N-терминал каталитический core домен, модуль центральной спирали с двумя витками спирали (H2TH) и C-концевой цинковый палец (см. PDB: 1K82).[6] N-терминал каталитический домен и C-концевой цинковый палец охватывают ДНК с длинной осью белка, ориентированной примерно ортогонально к спиральный ось ДНК. Остатки что контактная ДНК расположена в каталитический домен и в бета-шпильке петля образованный цинковым пальцем.[7]
Рекомендации
- ^ Fromme JC, Вердин GL (2004). «Базовая эксцизионная пластика». Adv. Protein Chem. Успехи в химии белков. 69: 1–41. Дои:10.1016 / S0065-3233 (04) 69001-2. ISBN 9780120342693. PMID 15588838.
- ^ а б Сугахара М., Микава Т., Кумасака Т., Ямамото М., Като Р., Фукуяма К., Иноуэ И., Курамицу С. (август 2000 г.). «Кристаллическая структура фермента репарации окислительно поврежденной ДНК, MutM (Fpg), от экстремального термофила, Thermus thermophilus HB8». EMBO J. 19 (15): 3857–69. Дои:10.1093 / emboj / 19.15.3857. ЧВК 306600. PMID 10921868.
- ^ О'Коннор Т.Р., Грейвс Р.Дж., де Мурсия Дж., Кастен Б., Лаваль Дж. (Апрель 1993 г.). «Белок Fpg Escherichia coli представляет собой белок цинкового пальца, остатки цистеина которого играют структурную и / или функциональную роль». J. Biol. Chem. 268 (12): 9063–70. PMID 8473347.
- ^ Duwat P, de Oliveira R, Ehrlich SD, Boiteux S (февраль 1995 г.). «Ремонт окислительного повреждения ДНК у грамположительных бактерий: белок Lactococcus lactis Fpg». Микробиология. 141 (2): 411–7. Дои:10.1099/13500872-141-2-411. PMID 7704272.
- ^ Дубли С., Бандару В., Бонд Дж. П., Уоллес СС (июль 2004 г.). «Кристаллическая структура человеческой эндонуклеазы VIII-подобного 1 (NEIL1) выявляет мотив пальца без цинка, необходимый для активности гликозилазы». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 101 (28): 10284–9. Дои:10.1073 / pnas.0402051101. ЧВК 478564. PMID 15232006.
- ^ Гильбоа Р., Жарков Д.О., Голан Г., Фернандес А.С., Герхман С.Е., Мац Э., Кисия Дж. Х., Гроллман А. П., Шохам Дж. (Май 2002 г.). «Структура формамидопиримидин-ДНК-гликозилазы, ковалентно связанной с ДНК». J. Biol. Chem. 277 (22): 19811–6. Дои:10.1074 / jbc.M202058200. PMID 11912217.
- ^ Fromme JC, Verdine GL (июль 2002 г.). «Структурные сведения о распознавании и восстановлении повреждений бактериальной 8-оксогуанин-ДНК-гликозилазой MutM». Nat. Struct. Биол. 9 (7): 544–52. Дои:10.1038 / nsb809. PMID 12055620. S2CID 38600519.
