Биокатализ - Biocatalysis

Биокатализ относится к использованию жизнь (биологические) системы или их части для ускорения (катализировать ) химические реакции. В биокаталитических процессах природные катализаторы, такие как ферменты, провести химические превращения на органические соединения. Оба фермента, которые были более или менее изолированные и ферменты все еще находятся внутри живых клетки используются для этой задачи.[1][2][3] Современные биотехнологии, в частности направленная эволюция, сделал возможным производство модифицированных или ненатуральных ферментов. Это позволило разработать ферменты, которые могут катализировать новые превращения малых молекул, которые могут быть трудными или невозможными при использовании классической синтетической органической химии. Использование природных или модифицированных ферментов для выполнения органический синтез Называется хемоферментный синтез; реакции, выполняемые ферментом, классифицируются как химиоферментные реакции.
История
Биокатализ поддерживает некоторые из старейших химических превращений, известных человеку, для пивоварение предшествует записанной истории. Самые старые записи о пивоварении насчитывают около 6000 лет и относятся к Шумеры.
Использование ферментов и целых клеток веками было важным для многих отраслей промышленности. Наиболее очевидное применение было в производстве продуктов питания и напитков, где производство вина, пива, сыра и т. Д. Зависит от воздействия микроорганизмы.
Более ста лет назад биокатализ применялся для химических превращений неприродных искусственных материалов. органические соединения, за последние 30 лет наблюдается значительный рост применения биокатализа для получения тонкие химикаты, особенно для фармацевтическая индустрия.[4]
Поскольку биокатализ имеет дело с ферментами и микроорганизмами, его исторически классифицируют отдельно от «гомогенного катализа» и «гетерогенного катализа». Однако, говоря механически, биокатализ - это просто частный случай гетерогенного катализа.[5]
Преимущества хемоферментного синтеза
-Ферменты экологически безвредны, полностью разлагаются в окружающей среде.
-Большинство ферментов обычно функционируют в мягких или биологических условиях, что сводит к минимуму проблемы нежелательных побочных реакций, таких как разложение, изомеризация, рацемизация и перестановка, которые часто мешают традиционной методологии.
-Ферменты, выбранные для химико-ферментативного синтеза, можно иммобилизовать на твердой подложке. Эти иммобилизованные ферменты демонстрируют очень высокую стабильность и возможность повторного использования и могут использоваться для проведения реакций в непрерывном режиме в микрореакторах.[6][7]
-Путем развития белковая инженерия, конкретно сайт-направленный мутагенез и направленная эволюция, ферменты можно модифицировать, чтобы обеспечить неприродную реактивность. Модификации также могут позволить расширить диапазон субстратов, повысить скорость реакции или оборачиваемость катализатора.
-Ферменты проявляют чрезвычайную селективность по отношению к своим субстратам. Обычно ферменты проявляют три основных типа селективности:
- Хемоселективность: Поскольку цель фермента - воздействовать на один тип функциональная группа, другие чувствительные функции, которые обычно реагируют до определенной степени при химическом катализе, выживают. В результате биокаталитические реакции имеют тенденцию быть «более чистыми», и трудоемкая очистка продукта (ов) от примесей, появляющихся в результате побочных реакций, в значительной степени может быть исключена.
- Региоселективность и диастереоселективность: Благодаря своей сложной трехмерной структуре ферменты могут различать функциональные группы, которые химически расположены в разных областях молекулы субстрата.
- Энантиоселективность: Поскольку почти все ферменты состоят из L-аминокислоты, ферменты хиральный катализаторы. Как следствие, любой тип хиральности, присутствующий в молекуле субстрата, «распознается» при образовании комплекса фермент-субстрат. Таким образом прохиральный субстрат может быть преобразован в оптически активный продукт, и оба энантиомера рацемического субстрата могут реагировать с разными скоростями.
Эти причины, и особенно последние, являются основными причинами, по которым химики-синтетики заинтересовались биокатализом. Этот интерес, в свою очередь, в основном связан с необходимостью синтезировать энантиочистка соединения в качестве хиральных строительных блоков для Фармацевтические препараты и агрохимикаты.
Асимметричный биокатализ
Использование биокатализа для получения энантиочистых соединений можно разделить на два разных метода:
- Кинетическое разрешение рацемической смеси
- Биокатализируемый асимметричный синтез
В кинетическое разрешение рацемической смеси, присутствие хирального объекта (фермента) превращает один из стереоизомеров реагента в его продукт с большей скорость реакции чем для другого стереоизомера реагента. Стереохимическая смесь теперь преобразована в смесь двух различных соединений, что делает их разделяемыми по обычной методике.
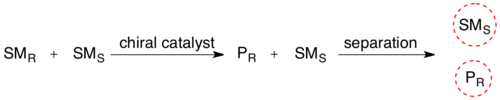
Биокатализируемое кинетическое разрешение широко используется при очистке рацемических смесей синтетических аминокислот. Многие популярные пути синтеза аминокислот, такие как Синтез Стрекера, в результате получается смесь энантиомеров R и S. Эта смесь может быть очищена (I) ацилированием амина с использованием ангидрида и затем (II) селективным деацилированием только L-энантиомера с использованием ацилазы почки свиньи.[8] Эти ферменты обычно чрезвычайно селективны в отношении одного энантиомера, что приводит к очень большим различиям в скорости, что позволяет проводить селективное деацилирование.[9] Наконец, два продукта теперь можно разделить классическими методами, такими как хроматография.

Максимальный выход при таком кинетическом разрешении составляет 50%, поскольку выход более 50% означает, что некоторая часть неправильного изомера также прореагировала, давая более низкую энантиомерный избыток. Следовательно, такие реакции должны быть прекращены до достижения равновесия. Если возможно выполнить такое разделение в условиях, когда два субстрата-энантиомера рацемизируются непрерывно, весь субстрат теоретически может быть преобразован в энантиомерный продукт. Это называется динамическое разрешение.
В биокатализируемый асимметричный синтез, нехиральное звено становится хиральным таким образом, что различные возможные стереоизомеры образуются в разных количествах. Хиральность вносится в субстрат под действием хирального фермента. Дрожжи биокатализатор энантиоселективного снижение из кетоны.

В Окисление Байера-Виллигера еще один пример биокаталитической реакции. В одном исследовании специально разработанный мутант Candida antarctica оказался эффективным катализатором Майкл дополнение из акролеин с ацетилацетон при 20 ° C в отсутствие дополнительного растворителя.[10]
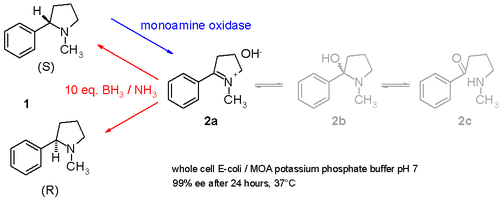
Другое исследование демонстрирует, как рацемический никотин (смесь S- и R-энантиомеров 1 в схема 3) может быть дерацемизирован в один горшок процедура с участием моноаминоксидазы, выделенной из Aspergillus niger который способен окислять только амин S-энантиомер к я добываю 2 и с участием аммиак –боран сокращение пара, которая может уменьшить имин 2 обратно к амину 1.[11] Таким образом, S-энантиомер будет непрерывно потребляться ферментом, в то время как R-энантиомер накапливается. Можно даже стереоинвертировать от чистого S до чистого R.
Биокатализ с включенным фоторедоксом
Недавно, фоторедокс-катализ был применен к биокатализу, что позволило осуществить уникальные, ранее недоступные преобразования. Химия фотоокисления полагается на свет для генерации свободный радикал промежуточные звенья.[12] Эти промежуточные радикалы являются ахиральными, поэтому рацемические смеси продуктов получаются, когда не обеспечивается внешняя хиральная среда. Ферменты могут обеспечить эту хиральную среду внутри активный сайт и стабилизируют конкретную конформацию и способствуют образованию одного энантиочистого продукта.[13] Реакции биокатализа, активируемые фоторедоксом, делятся на две категории:
- Внутренний кофермент /кофактор фотокатализатор
- Внешний фотокатализатор
Определенный общий перенос атома водорода (ШЛЯПА ) кофакторы (НАДФН и Флавин ) может работать как перенос одного электрона (НАБОР ) реагенты.[13][14][15] Хотя эти виды способны к HAT без облучения, их окислительно-восстановительный потенциал увеличивается почти на 2,0 В при облучении видимым светом.[16] В сочетании с соответствующими ферментами (обычно енредуктазы ) Это явление было использовано химиками для разработки методик энантиоселективного восстановления. Например среднего размера лактамы может быть синтезирован в хиральном окружении енредуктазы посредством восстановительного, Болдуин одобрил, радикальная циклизация завершается энатиоселективной HAT от NADPH.[17]
Вторая категория фотореактивных биокаталитических реакций с использованием внешнего фотокатализатора (ПК). Можно использовать многие типы ПК с большим диапазоном окислительно-восстановительных потенциалов, что обеспечивает большую настраиваемость реактивной мощности по сравнению с использованием кофактора. Роза бенгальская, и внешний ПК, использовали в тандеме с оксиоредуктазой для энантиоселективного деацилирования альфа-ацил-кетоны.[18]
Использование внешнего ПК имеет некоторые недостатки. Например, внешние ПК обычно усложняют дизайн реакции, поскольку ПК может реагировать как со связанным, так и с несвязанным субстратом. Если между несвязанным субстратом и ПК происходит реакция, энантиоселективность теряется, и могут возникнуть другие побочные реакции.
дальнейшее чтение
- Mortison, JD; Шерман, Д.Х. (2010). «Границы и возможности химико-ферментативного синтеза». J Org Chem. 75 (21): 7041–51. Дои:10.1021 / jo101124n. ЧВК 2966535. PMID 20882949.
Смотрите также
Рекомендации
- ^ Антонсен, Торлиф (2000). «Реакции, катализируемые ферментами». В Адлеркрейце, Патрик; Straathof, Адри Дж. Дж. (Ред.). Прикладной биокатализ (2-е изд.). Тейлор и Фрэнсис. С. 18–59. ISBN 978-9058230249.
- ^ Фабер, Курт (2011). Биотрансформации в органической химии (6-е изд.). Springer. ISBN 9783642173936.[страница нужна ]
- ^ Jayasinghe, Леонард Y .; Смоллридж, Эндрю Дж .; Тревелла, Мори А. (1993). «Восстановление этилацетоацетата в петролейном эфире, опосредованное дрожжами». Буквы Тетраэдра. 34 (24): 3949–3950. Дои:10.1016 / S0040-4039 (00) 79272-0.
- ^ Лизе, Андреас; Зилбах, Карстен; Wandrey, Christian, eds. (2006). Промышленные биотрансформации (2-е изд.). Джон Вили и сыновья. п. 556. ISBN 978-3527310012.
- ^ Ротенберг, Гади (2008). Катализ: концепции и зеленые приложения. Вайли. ISBN 9783527318247.[страница нужна ]
- ^ Бхангале, Атул; Кэтрин Л. Бирс; Ричард А. Гросс (2012). «Катализируемая ферментами полимеризация полимеров с концевыми функциональными группами в микрореакторе». Макромолекулы. 45 (17): 7000–7008. Bibcode:2012MaMol..45.7000B. Дои:10.1021 / ma301178k.
- ^ Бхангале, Атул; Сантану Кунду; Уильям Э. Уоллес; Кэтлин М. Флинн; Чарльз М. Гуттман; Ричард А. Гросс; Кэтрин Л. Бирс (2010). "Катализируемая ферментами полимеризация в непрерывном потоке в микрореакторе". JACS. 133 (15): 6006–6011. Дои:10.1021 / ja111346c. PMID 21438577.
- ^ Уэйд, Л. Г., 1947- (2013). Органическая химия (8-е изд.). Бостон: Пирсон. ISBN 978-0-321-76841-4. OCLC 752068109.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Швиадас В. Ю; Галаев И.Ю; Galstian, N.A .; Березин И. В. (август 1980 г.). «[Субстратная специфичность ацилазы I из почек свиньи]». Биохимия (Москва, Россия). 45 (8): 1361–1364. ISSN 0320-9725. PMID 7236787.
- ^ Сведендаль, Мария; Халт, Карл; Берглунд, Пер (декабрь 2005 г.). «Формирование быстрой углерод-углеродной связи беспорядочной липазой». Журнал Американского химического общества. 127 (51): 17988–17989. Дои:10.1021 / ja056660r. PMID 16366534.
- ^ Дансмор, Колин Дж .; Карр, Рувим; Флеминг, Тони; Тернер, Николас Дж. (2006). «Химио-ферментативный путь к энантиомерно чистым циклическим третичным аминам». Журнал Американского химического общества. 128 (7): 2224–2225. Дои:10.1021 / ja058536d. PMID 16478171.
- ^ Prier, Christopher K .; Ранкич, Даника А .; Макмиллан, Дэвид В. К. (10 июля 2013 г.). «Фоторедокс-катализ в видимом свете с комплексами переходных металлов: применение в органическом синтезе». Химические обзоры. 113 (7): 5322–5363. Дои:10.1021 / cr300503r. ISSN 0009-2665. ЧВК 4028850. PMID 23509883.
- ^ а б Накано, Юджи; Бегасевич, Кайл Ф; Хистер, Тодд К. (апрель 2019 г.). «Биокаталитический перенос атома водорода: бодрящий подход к свободнорадикальным реакциям». Современное мнение в области химической биологии. 49: 16–24. Дои:10.1016 / j.cbpa.2018.09.001. ЧВК 6437003. PMID 30269010.
- ^ Сандовал, Брэддок А .; Meichan, Andrew J .; Хистер, Тодд К. (23.08.2017). "Энантиоселективный перенос атома водорода: открытие каталитической неразборчивости во флавин-зависимых 'энэ'-редуктазах". Журнал Американского химического общества. 139 (33): 11313–11316. Дои:10.1021 / jacs.7b05468. ISSN 0002-7863. PMID 28780870.
- ^ Ли, Чжинин; Ван, Зексу; Meng, Ge; Лу, Хун; Хуанг, Зеду; Чен, Фенер (апрель 2018 г.). «Идентификация энэредуктазы дрожжей Kluyveromyces Marxianus и применение в асимметричном синтезе эфиров (R) -Профена». Азиатский журнал органической химии. 7 (4): 763–769. Дои:10.1002 / ajoc.201800059.
- ^ Эммануэль, Меган А .; Greenberg, Norman R .; Облинский, Даниил Г .; Хистер, Тодд К. (14 декабря 2016 г.). «Доступ к неприродной реакционной способности путем облучения никотинамид-зависимых ферментов светом». Природа. 540 (7633): 414–417. Bibcode:2016Натура.540..414E. Дои:10.1038 / природа20569. ISSN 1476-4687. PMID 27974767.
- ^ Biegasiewicz, Kyle F .; Купер, Саймон Дж .; Гао, Синь; Облинский, Даниил Г .; Ким, Джи Хе; Garfinkle, Samuel E .; Джойс, Лео А .; Сандовал, Брэддок А .; Скоулз, Грегори Д.; Хистер, Тодд К. (21.06.2019). «Фотовозбуждение флавоферментов делает возможной стереоселективную радикальную циклизацию». Наука. 364 (6446): 1166–1169. Bibcode:2019Научный ... 364.1166B. Дои:10.1126 / science.aaw1143. ISSN 0036-8075. ЧВК 7028431. PMID 31221855.
- ^ Biegasiewicz, Kyle F .; Купер, Саймон Дж .; Эммануэль, Меган А .; Миллер, Дэвид С .; Хистер, Тодд К. (июль 2018 г.). «Каталитическая неразборчивость, обеспечиваемая фоторедокс-катализом в никотинамид-зависимых оксидоредуктазах». Химия природы. 10 (7): 770–775. Bibcode:2018НатЧ..10..770Б. Дои:10.1038 / с41557-018-0059-у. ISSN 1755-4330. PMID 29892028.
внешняя ссылка
- Австрийский центр промышленной биотехнологии - acib
- Центр передового опыта в области биокатализа - CoEBio3
- Университет Эксетера - Центр биокатализа
- Центр биокатализа и биопроцессинга - Университет Айовы
- TU Delft - Биокатализ и органическая химия (BOC)
- KTH Stockholm - Исследовательская группа биокатализа
- Институт технического биокатализа Гамбургского технологического университета (TUHH)
- Биокаскадный проект
