Гексамминкобальта (III) хлорид - Hexamminecobalt(III) chloride
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексаамминкобальта (III) хлорид | |
| Другие имена Гексамминхлорид кобальта, хлорид гексаамминкобальта (III) | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.991 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| ЧАС18N6Cl3Co | |
| Молярная масса | 267,48 г / моль |
| Внешность | желтые или оранжевые кристаллы |
| Плотность | 1,71 г / см3, |
| Температура плавления | разлагается |
| 0,26 М (20 ° С) трибромид: 0,04 M (18 ° C) | |
| Растворимость | растворим в NH3 |
| Структура | |
| восьмигранный | |
| 0 D | |
| Опасности | |
| Главный опасности | яд |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| Родственные соединения | |
Другой анионы | [Co (NH3)6] Br3 [Co (NH3)6] (OAc)3 |
Другой катионы | [Cr (NH3)6] Cl3 [Ni (NH3)6] Cl2 |
Родственные соединения | [Co (H2NCH2CH2NH2)3] Cl3 [Co (NH3)5(ЧАС2O)] Cl3 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
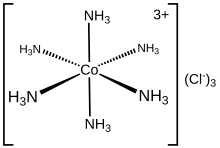
Гексаамминкобальта (III) хлорид представляет собой химическое соединение формулы [Co (NH3)6] Cl3. Это хлоридная соль координационный комплекс [Co (NH3)6]3+, который считается архетипическим «комплексом Вернера», названным в честь пионера координационной химии, Альфред Вернер. Сам катион является металлоамминный комплекс с шестью аммиак лиганды прикреплен к кобальт (III) ион.
Первоначально соли [Co (NH3)6]3+ были описаны как лютео (Латинский: желтый) комплекс кобальта. Это название было отброшено, поскольку современная химия считает цвет менее важным, чем молекулярная структура. Другие подобные комплексы также имели названия цветов, например Purpureo (Латиница: пурпурный) для комплекс пентаммина кобальта, и празео (Греческий: зеленый) и Violeo (Латиница: фиолетовый) на двоих изомерный тетрамминовые комплексы.[1]
Свойства и структура
[Co (NH3)6]3+ диамагнитен, с низкоскоростной 3D6 восьмигранный Со (III) центр. Катион подчиняется Правило 18 электронов и считается классическим примером обменного комплекса инертного металла. Как проявление его инертности [Co (NH3)6] Cl3 перекристаллизовывается без изменений из концентрированных соляная кислота: NH3 настолько прочно связан с центрами Co (III), что не диссоциирует, позволяя его протонировать. Напротив, лабильные металлоамминные комплексы, такие как [Ni (NH3)6] Cl2, быстро реагируют с кислотами, отражая лабильность Ni (II) –NH3 облигации. При нагревании гексамминкобальт (III) начинает терять часть своих амминных лигандов, в конечном итоге образуя более сильный окислитель.
Ионы хлорида в [Co (NH3)6] Cl3 можно обменять на множество других анионы Такие как нитрат, бромид, йодид, сульфамат чтобы предоставить соответствующий [Co (NH3)6]ИКС3 производная. Такие соли имеют оранжевый или ярко-желтый цвет и обладают различной растворимостью в воде. Ион хлорида можно также обменять на более сложные анионы, такие как гексатиоцианатохромат (III), с получением соединения розового цвета с формулой [Co (NH3)6] [Cr (SCN)6], или феррицианид ион.
Подготовка
[Co (NH3)6] Cl3 готовится путем обработки хлорид кобальта (II) с аммиак и хлорид аммония с последующим окислением. Окислители включают пероксид водорода или же кислород в присутствии угольного катализатора.[2] Об этой соли, по-видимому, впервые сообщил Фреми.[3]
Ацетатную соль можно получить аэробным окислением ацетат кобальта (II), ацетат аммония, и аммиак в метаноле.[4] Ацетатная соль хорошо растворима в воде до уровня 1,9 M (20 ° C) по сравнению с 0,26 M для трихлорида.
Использует
[Co (NH3)6]3+ является составной частью некоторых структурная биология методы (особенно для ДНК или же РНК, где положительные ионы стабилизируют третичную структуру фосфатного остова), чтобы помочь решить их структуры путем Рентгеновская кристаллография[5] или по ядерный магнитный резонанс.[6] В биологической системе противоионами, скорее всего, будет Mg2+, но тяжелые атомы кобальта (а иногда и иридий, как в PDB: 2ГИС) Предоставить аномальное рассеяние решить фазовая проблема и составить карту электронной плотности структуры.[7]
[Co (NH3)6]3+ представляет собой необычный пример водорастворимого комплекса трехвалентного металла и полезен для приложений защиты заряда, таких как стабилизация сильно отрицательно заряженных комплексов, таких как взаимодействия с и между ними. нуклеиновые кислоты.
Рекомендации
- ^ Хухи, Джеймс Э. (1983). Неорганическая химия (3-е изд.). п. 360.
- ^ Bjerrum, J .; Макрейнольдс, Дж. П. (1946). Соли гексамминкобальта (III). Неорг. Synth. Неорганические синтезы. 2. С. 216–221. Дои:10.1002 / 9780470132333.ch69. ISBN 9780470132333.
- ^ Фреми, М. Э. (1852). "Исследования сюр ле кобальт". Анна. Чим. Phys. 35: 257–312.
- ^ Lindholm, R.D .; Бауза, Дэниел Э. (1978). Комплексы кобальт, содержащие аммиак или этилендиамин: соли гексаамминкобальта (III). Неорг. Synth. Неорганические синтезы. 18. С. 67–69. Дои:10.1002 / 9780470132494.ch14. ISBN 9780470132494.
- ^ Рамакришнан, Б .; Сехаруду, Ц .; Пан, В .; Сундаралингам, М. (2003). «Кристаллическая структура с близким к атомному разрешению декамером A-ДНК d (CCCGATCGGG): взаимодействие гексаммина кобальта с A-ДНК». Acta Crystallogr. D59 (Pt 1): 67–72. Дои:10.1107 / s0907444902018917. PMID 12499541.
- ^ Rudisser, S .; Тиноко, И., младший (2000). «Структура раствора гексаммина кобальта (III) в комплексе с тетрапетлей GAAA и связывание ионов металла с несоответствиями G.A». J. Mol. Биол. 295 (5): 1211–1232. Дои:10.1006 / jmbi.1999.3421. PMID 10653698.
- ^ Макферсон, Александр (2002). Введение в кристаллографию макромолекул. Джон Вили и сыновья. ISBN 0-471-25122-4.
