Ниваленол - Википедия - Nivalenol
 | |
| Имена | |
|---|---|
| Другие имена (3α, 4β, 7α) -12,13-эпокси-3,4,7,15-тетрагидрокситрихотек-9-ен-8-он[1] | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.150.573 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C15ЧАС20О7 | |
| Молярная масса | 312.318 г · моль−1 |
| Внешность | твердый |
| Плотность | 1,6 ± 0,1 г / см³ |
| Температура плавления | 222–223 ° С |
| Точка кипения | 585,1 ± 50 ° С |
| 3,54 * 10 ^ 5 мг / л при 25 ° C | |
| Растворимость | растворим в полярных органических растворителях |
| Кислотность (пKа) | 11.78 |
| Опасности | |
| Пиктограммы GHS |    [2][3] [2][3] |
| Сигнальное слово GHS | Опасность[2] |
| H225, H300, H302, H312, H332, H310, H319, H330 [2][3] | |
| P210, P241, P260, P262, P264, P270, P271, P280, P284, P301 + 310, P302 + 350, P304 + 340, P310, P320, P321, P322, P330, P361, P363, P403 + 233, P405, P501[2][3] | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 5 ° С (41 ° F, 278 К)[3] |
| 525 ° С (977 ° F, 798 К)[3] | |
| 20 частей на миллион (34 мг / м3) Кожа [3] | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 19,5 мг / кг (крысы, перорально), 38,9 мг / кг (мышь, перорально) |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | 40 частей на миллион (70 мг / м3) [3] |
REL (Рекомендуемые) | 20 частей на миллион (34 мг / м3) [3] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ниваленол (NIV) - это микотоксин из трихотецен группа. В природе он в основном встречается в грибах Фузариум разновидность. В Фузариум вид относится к наиболее распространенным микотоксин производят грибы в регионах с умеренным климатом северного полушария, что делает их значительным риском для индустрии производства пищевых культур.[4]
Грибки распространены в различных сельскохозяйственных продуктах (зерновые культуры) и в продуктах их дальнейшей переработки (солод, пиво и хлеб). "The Фузариум виды вторгаются и растут на сельскохозяйственных культурах и могут производить ниваленол во влажных и прохладных условиях ».[4]
Симптомы, наблюдаемые после воздействия ниваленола: отказ от корма, рвота, желудочно-кишечный и кожное раздражение или некроз и иммунологическая дисфункция »,[5] а также гематотоксичность, что приводит к снижению количества лейкоцитов.[5]
История
В период 1946-1963 гг. Несколько случаев интоксикации в результате приема внутрь Фузариум инфицированные зерна (болезнь зерна почесуха) были зарегистрированы в Японии, Корее и Индии. Не было сообщений о смертельных случаях, только легкие симптомы, такие как тошнота, рвота, понос и брюшной боль. В этих инцидентах F.graminaerum могут быть выделены, что указывает на ниваленол или дезоксиниваленол загрязнение.
За тот же период две вспышки, охватившие более 100 случаев, были зарегистрированы в Индии и Китае. Эти вспышки также не были летальными.
Хорошо задокументированная острая вспышка заболевания в Индии в 1987 году затронула около 50 000 тысяч человек. Несколько Фузариум токсины, в которых присутствует ниваленол (0,03–0,1 мг / кг в 2 из 24 проб), дезоксиниваленол (0,34–8,4 мг / кг в 11 из 24 образцов) и ацетилдезоксиниваленол (0,6–2,4 мг / кг в 4 из 24 образцов) были обнаружены в поврежденной дождем пшенице, используемой для производства хлеба. Снова не было смертельных случаев, и зарегистрированные симптомы были брюшной боль, понос кровавый стул и рвота. Эти случаи показывают, что основная опасность ниваленола исходит от Фузариум инфицированные злаки, и в основном происходит через неконтролируемый путь переваривания пшеницы или других зерновых, которые затем обрабатываются или попадают в пищевую цепь другим путем.[6]
Вепонизация и другие случаи отравления ниваленолом
Ниваленол, а также дезоксиниваленол и Т-2 токсин использовались в качестве боевых биологических агентов в Лаосе и Камбодже, а также в Афганистане. Советский Союз якобы предоставил микотоксины и сами использовали их в Афганистане. Все три соединения можно было идентифицировать в растительности на пораженных участках, тогда как Т-2 токсин также могут быть обнаружены в образцах мочи и крови жертв.[7]
Лучше всего задокументированное использование трихотеценов в войне - это спор о желтом дожде, в котором описывается ряд атак в Юго-Восточной Азии, а также в Лаосе и Афганистане, в которых использовался «желтый дождь »По описанию свидетелей. Токсины были доставлены в виде облака желтой пыли или капель. Статья Л. Р. Эмбера, опубликованная в 1984 г. в журнале «Новости химической инженерии», описывает использование трихотецен микотоксины в качестве биологического оружия в Юго-Восточной Азии очень подробно.[8] В нем можно найти отчеты выживших и очевидцев, а также военнопленных и советских информаторов, а также информацию о присутствии советских техников и лабораторий. Это привело к выводу, что эти токсины использовались в Юго-Восточной Азии и Афганистане. Однако российское правительство отказывается давать заявления по этим доказательствам. Кроме того, было показано, что образцы, взятые на месте атак, содержат эти токсины, в то время как сайты, которые не были атакованы, не показывают никаких признаков токсинов в них.
Несмотря на то, что остается сомнительным, являются ли все отчеты свидетелей надежными источниками доказательств, зарегистрированные симптомы типичны для интоксикации трихотецены.
Было несколько способов, которыми трихотецены использовались в качестве оружия, такие как распыление в виде аэрозоля, дыма, капель или пыли от самолетов, ракет, портативных устройств или артиллерии.[9]
Правила безопасности в пищевой промышленности
В 2000 г. научное заключение о ниваленоле было опубликовано Научный комитет по пищевым продуктам (SCF). Временный допустимая суточная доза (t-TDI) 0–0,7 мкг / кг массы тела в день было назначено после оценки общей токсичности, а также гематоксичность и иммунотоксичность. Этот т-TDI был подтвержден Совкомфлотом в 2002 г.
В 2010 году Комиссия по безопасности пищевых продуктов Японии (FSCJ) выпустила т-TDI 0,4 мкг / кг массы тела в сутки.
С 2001 по 2011 гг. Европейское агентство по безопасности пищевых продуктов (EFSA) собраны данные о 15774 случаях появления ниваленола в 18 европейских странах для оценки. Это привело к установлению TDI на уровне 1,2 мкг / кг массы тела в день. Ниваленол в этих исследованиях не был обнаружен как генотоксичный, но хорошо гематотоксичный и иммунотоксичный.[4]
Структура и реакционная способность
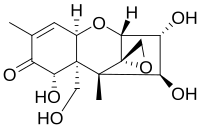
Ниваленол в составе семейства микотоксины имеет общую структуру, присущую всем членам этого семейства токсинов. Это включает в себя базовую структуру циклогексен и тетрагидропиран кольцо, подключенное к C6 и C11. Кроме того, этильная группа соединяет тетрагидропиран в C2 и C5 и кето группа прикреплена к циклогексен в C8. В эпоксид группа, отвечающая за реактивность большинства деталей, прикреплена к C12 и C13 в тетрагидропиран. Только остальные группы в положениях C3, C4, C7, C15 различаются для разных микотоксины. В случае ниваленола каждая из четырех оставшихся групп представляет собой замещенную гидроксильную группу, которая увеличивает реакционную способность в присутствии гидрофильных соединений или подгрупп соответственно благодаря их полярным характеристикам. В кислой среде кето группа способна реагировать с протоном, способствующим полярности и реакционной способности. Но в целом эпоксид группа имеет решающее значение для реакционной способности молекулы.[10]
Доступные формы
Ниваленол, дезоксиниваленол и Т2-токсин три структурных и подобных синтезированных микотоксины естественно появляется в грибах (например, Фузариум ).[10]
Синтез
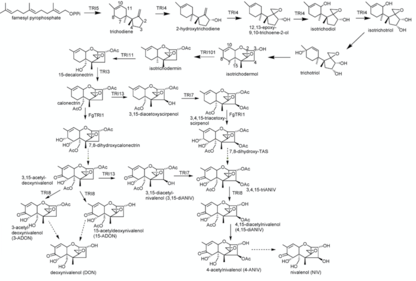
Синтез ниваленола представляет собой 16-ступенчатый процесс. Он может отличаться на шагах с 11 по 14 в зависимости от порядка, в котором триходиенсинтазы TRI1, TRI13 и TRI7 являются катализирующими. Famesyl пирофосфат используется в качестве исходного соединения для синтеза ниваленола. Его реакция циклизации до триходиена катализируется терпен циклаза триходиен-синтаза (Tri5). За этой реакцией следуют несколько реакций окисления, катализируемых цитохром P450 монооксигеназа (закодировано TRI4). Таким образом, гидроксильные группы были замещены атомами углерода C2, C3 и C11, и один кислород был добавлен к C12 и C13, способствуя образованию эпоксид группа. Это приводит к промежуточному изотрихотриолу.
В следующей реакции трихотриол был получен за счет сдвига гидроксильной группы C11 изотрихотриола к C9, аналогично сдвигу двойной связи с C9 = C10 на C10 = C11. Трихотриол реагирует неферментативной реакцией циклизации на свой изомер изотриходермол. В реакции гидроксильная группа на C2 циклопентан связывается с C11 циклогексен формирование тетрагидропиран звенеть. Сдвинутая OH-группа у C9 теряется во время реакции. An ацетилтрансфераза (кодируемый TRI101) катализирует ацетилирование C3 OH-группы изотриходермола, образуя изотрихдермин.
Изотриходермин превращается в 15-декалонецитрин из-за замены (кодируемого TRI11) одного водорода на один гидроксил у C15, который затем ацетилируется с помощью TRI3. Такое же замещение и последующие реакции ацетилирования снова происходят у C4 под контролем TRI13 и TRI7. TRI1 в F. споротриходиес дополнительно катализирует добавление четвертой ОН-группы у С8 и пятой ОН-группы у С7, в которой затем удаляется водород и образуется кетогруппа.
На последнем этапе эстераза, контролируемая TRI8, катализирует деацетилирование у C3, C4 и C15, что приводит к конечному продукту - ниваленолу. Частично альтернативный синтез может происходить, когда катализаторы TRI1 и TRI13, TRI7 используются в противоположном порядке. Затем происходит добавление гидроксильных групп в C7 и C8, контролируемое TRI1, с калонектрином в качестве реагента. В этой реакции образуется 7,8-дигидроксикалонектрин. Кроме того, он самопроизвольно реагирует на 3,15-ацетил-дезоксиниваленол посредством отщепления водорода и образования кето- группа в C8. Присоединение гидроксильной группы к C4, контролируемое TRI13, происходит и ацетилируется с помощью TRI7. Это дает 3,4,15-триацетилниваленол (3,4,15-триАНИВ), из которого снова получают такой же синтез, как описано выше.[9]
Механизм действия
Ниваленол вызывает изменение ряда различных биологических путей. Самым известным и, вероятно, важным является NF-κB путь. NF-κB это фактор транскрипции который может быть обнаружен почти во всех клетках человека и регулирует экспрессию своих генов-мишеней путем связывания со специфическими мотивами геномной ДНК на регуляторных элементах. В пробирке тесты показали, что ниваленол может изменять экспрессию цитокины, которые являются важными молекулами-регуляторами иммунной системы. Ниваленол индуцировал секрецию ИЛ-8, медиатора воспаление. При лечении NF-κB ингибитор, секреция ИЛ-8 была снижена. Еще один важный фактор, на который влияет ниваленол, - это МКП-1 /CCL2, этот цитокин играет роль в регуляции подвижности мононуклеарных лейкоцитарных клеток. Ниваленол причины CCL2 секреция должна быть снижена и, следовательно, уменьшена подвижность моноцитов. Это частично объясняет иммуносупрессивную природу ниваленола. Опять же, этот эффект уменьшается на NF-κB ингибирование, которое показывает, что ниваленол и NF-κB взаимодействуют, чтобы влиять на клетку.[11][12]
Было показано, что пока дезоксиниваленол вызывает секрецию хемокины, которые также являются иммуно-релевантными молекулами-посредниками, ниваленол действительно подавляет их секрецию.[13][14] Ниваленол также усиливает экспрессию провоспалительных генов в макрофагах, оказывая смешанное действие на разные типы клеток. Это происходит даже на цитотоксическом уровне.[15]
Другой механизм цитотоксичности ниваленола - это цитотоксичность апоптоза, показывающая, что ниваленол более токсичен, чем его часто встречающиеся одновременно. микотоксин партнер дезоксиниваленол, и делает это, вызывая повреждение ДНК и апоптоз.[16] Также известно, что ниваленол влияет на пролиферацию лейкоцитов человека. Было показано, что ниваленол может изменять скорость пролиферации лейкоцитов человека в зависимости от дозы. Известно, что более низкие концентрации усиливают пролиферацию лейкоцитов, в то время как более высокие концентрации уменьшают пролиферацию дозозависимым образом.[17]
Метаболизм

Ниваленол у мышей метаболизируется не только через печень, но также, в меньшей степени, за счет микробной детоксикации в кишечнике. Тем самым особенно эпоксид группа как наиболее токсичная часть молекулы распадается. Это происходит за счет удаления кислорода из эпоксид группа, приводящая к двойной углерод-углеродной связи между C12 и C13. Эта двойная связь неполярна и очень устойчива, что приводит к менее реакционной форме ниваленола, называемой деэпоксиниваленолом. Таким образом, полученный деэпоксинированный ниваленол намного менее токсичен, как и любой деэпоксинированный триходиен, и может выделяться с мочой, не оказывая больше токсических эффектов (почти не токсичен).
В моче подопытных мышей и свиней было обнаружено 80% деэпоксидированного соединения и только 7% фактического ниваленола, показывающих высокую скорость метаболизма триходиены.[5] Таким образом, наблюдалась низкая концентрация азота в белках с низким содержанием мочевины, тогда как концентрация холестерина была выше нормы. Это говорит о том, что ниваленол присутствует и позже распадается в печени, поскольку печень отвечает за сегрегацию холестерина в кровоток. Более высокое количество холестерина в крови приводит к большему количеству отфильтрованного почками холестерина и, в конечном итоге, к повышенной концентрации мочевины.[10][18]
Предполагается, что пониженная концентрация амидов вызвана процессом разложения реактивного эпоксид группа. Следовательно эпоксиды часто обнаруживают, что они реагируют с амидами или амидными группами, добавляя гидроксильную группу к первичному или вторичному амину. Как следствие, эпоксидная группа разлагается, и для синтеза белков или мочевины присутствует меньше азота.
Побочные эффекты
Ниваленол еще не нашел применения в медицине, и поэтому у него нет известных побочных эффектов, кроме описанных токсических эффектов. Однако стоит отметить, что он может быть интересен для исследования из-за его иммуносупрессивного действия.
Воздействие на животных и эффективность
Поскольку ниваленол является микотоксическим продуктом определенных Фузариум вид часто встречается в зараженной пшенице и зерне. Поскольку необработанная пшеница и зерновые продукты часто используются в качестве корма для сельскохозяйственных животных, они подвержены более высокому риску потребления ниваленола.
Исследования токсичности у свиней, получавших ниваленол в дозе 0,05 мг / кг массы тела два раза в день, не показали летальных эффектов. Большая часть ниваленола секретировалась с фекалиями и не попадала в кровоток, несмотря на тот факт, что ниваленол все еще оставался за пределами кишечника после 16 часов кормления. Кроме того, в течение первых трех дней метаболиты ниваленола в кале или моче не обнаруживались.[19] После недели воздействия 2,5 или 5 мг ниваленола на кг массы тела два раза в день наблюдалась микробиологическая адаптация, поскольку метаболиты ниваленола (деэпоксидированный ниваленол) можно было обнаружить в кале и моче.
У крыс и мышей было показано, что ниваленол токсичен с побочными эффектами задержка роста лейкопения уже отмечалась при самых низких дозах 0,7 мг / кг массы тела в день. Смертельные дозы зависели от пути введения / приема ниваленола. Поскольку ниваленол обычно попадает в корм, LD50 перорального введения, которое составляет 38,9 мг / кг веса тела в день у мышей и 19,5 мг / кг веса тела в день у крыс, можно использовать в качестве стандарта. В LD50 внутривенного, внутрибрюшинный и подкожный (SC) составляет от 7 до 7,5 мг / кг массы тела в день.[20]
Токсичность, показания и побочные эффекты
Токсичность ниваленола для человека по большей части еще неизвестна, но его исследовали на клетках мышей, крыс и хомяков. Таким образом, токсичность была разделена на следующие темы: острая / подострая, субхроническая, хроническая и канцерогенная, генотоксичность, исследования токсичности для развития и исследования репродуктивной системы, иммунотоксичность / гематотоксичность и влияние на нервную систему.
Острая / подострая токсичность
Устный LD50 ниваленола у мышей составило 38,9 мг / кг м.т., тогда как внутрибрюшинный, подкожный и внутривенный пути воздействия дали LD50 значения 5–10 мг / кг мт. У мышей уже в течение 3 дней большинство смертей произошло после перорального воздействия из-за заметного скопления и кровотечение в кишечнике, при острой токсичности также включаются лимфоидные органы. Ниваленол, вводимый в течение 24 дней в более низких дозах (около 3,5 мг / кг массы тела), показал значительную эритропения и небольшой лейкопения.[20]
Субхроническая токсичность
Субхроническую токсичность тестировали путем кормления мышей суточной дозой от 0 до 3,5 мг ниваленола / кг массы тела в течение 4 или 12 недель. По наблюдениям через 4 недели наблюдалось снижение массы тела и потребления пищи. Снижение массы тела можно объяснить статистическим уменьшением массы органов тимуса, селезенки и почек. В то время как время потребления было меньше для самок мышей по сравнению с самцами. Через 12 недель потребление токсина привело к снижению относительной массы органов как у мужчин, так и у женщин. При этом пострадала только печень и нет гистопатологический изменений не наблюдалось.[20]
Хроническая токсичность и канцерогенность
Самок мышей кормили различными дозами ниваленола (0, 0,7, 1,4 или 3,5 мг ниваленола / кг массы тела) в течение одного или двух лет, чтобы выяснить, является ли ниваленол хроническим токсичным и / или канцерогенным. Также во время этого исследования наблюдалось снижение живой массы и потребления корма. Абсолютный вес как печени, так и почек был уменьшен за счет двух самых высоких доз. У мышей, получавших в течение года ниваленол (также в более низких дозах), наблюдалась тяжелая лейкопения, тогда как у мышей, получавших в течение двух лет, не было различий в количестве лейкоцитов. Также «не было обнаружено гистопатологических изменений, включая опухоли в печени, тимусе, селезенке, почках, желудке, надпочечниках, гипофизе, яичниках, костном мозге, лимфатическом узле, головном мозге и тонком кишечнике с или без Патч Пейера ".[20] Самые низкие дозы (0,7 мг ниваленола / кг массы тела) подавляли рост и вызывали лейкопению. «Уровень незаметных побочных эффектов (NOAEL ) не могли быть получены из этих исследований. МАИР (1993) пришел к выводу, что данных о канцерогенности ниваленола у экспериментальных животных недостаточно. Данных о людях не было. Общий вывод заключался в том, что канцерогенность не поддается классификации (группа 3) ».[20]
Генотоксичность
Было обнаружено, что ниваленол влияет на гены клеток китайского хомячка V79 (CHO) за счет незначительного увеличения частоты хромосомных аберраций и обмена сестринских хроматид. ДНК была повреждена в клетках СНО, а также у мышей. У мышей (получивших 20 мг ниваленола / кг массы тела перорально или 3,7 мг / кг массы тела внутрибрюшинно) ДНК почек, костного мозга, желудка, тощая кишка и толстая кишка была повреждена. На ДНК тимуса и печени не повлияло. В органах с повреждением ДНК нет некротический изменения были обнаружены при гистопатологическом исследовании. Можно сделать вывод, что адекватная оценка генотоксичности не допускается на основании имеющихся данных.[20]
Токсичность для развития и исследования репродукции
Для исследований развития и репродукции беременным мышам вводили различные количества очищенного ниваленола на 7-15 дни беременности, а для одного дополнительного исследования - с плесневым рисом, содержащим ниваленол. Исследования показали, что токсин эмбриотоксичен для мышей. Нет доказательств тератогенность был дан. "The LOAEL в исследованиях репродукции с ниваленолом, вводимым перорально, было установлено, что 1,4 мг / кг м.т. с кормом на протяжении всей беременности и 5 мг / кг м.т. при введении через желудочный зонд на 7-15 дни ».[20] Данные по другим видам и о репродуктивных эффектах у взрослых самцов и самок пока не предоставлены.[20]
Иммунотоксичность / гематотоксичность
Острая токсичность ниваленола вызывает токсичность для костного мозга и лимфоидных органов. Длительное воздействие может привести к эритропения и / или лейкопения. У мышей также наблюдалось, что ниваленол увеличивает присутствие сыворотки крови. IgA, "сопровождающиеся иммунопатологическими изменениями в почках, аналогичными человеческим IgA-нефропатия ".[20] В бластогенез в культивируемых лимфоцитах человека пролиферация мужских и женских лимфоцитов человека стимулируется фитогеамагглютин и марихуана и продукция иммуноглобулинов, индуцированная луковичным семеном, ингибируется ниваленолом. Эффекты ниваленола находятся в том же диапазоне, что и те же дозы дезоксиниваленол, тогда как Т-2 токсин в 100 раз токсичнее. Аддитивный эффект дает сочетание ниваленола с Т-2 токсин, 4,15-диацетоксисцирпенол или дезоксиниваленол.[20]
Воздействие на нервную систему
О нервной системе данных пока нет.[20]
Рекомендации
- ^ а б «Ниваленол». Cayman Chemical. Получено 28 марта 2018.
- ^ а б c d «Ниваленол». PubChem. Получено 28 марта 2018.
- ^ а б c d е ж грамм час «Ниваленол» (PDF). Паспорт безопасности. Получено 28 марта 2018.
- ^ а б c «Научное заключение о рисках для здоровья животных и населения, связанных с присутствием ниваленола в пищевых продуктах и кормах». Журнал Европейского агентства по безопасности пищевых продуктов (EFSA). 11 (6): 1–5. 2013.
- ^ а б c Hedman, R .; Pettersson, H .; Линдберг, Дж. Э. (2009). «Абсорбция и метаболизм ниваленола у свиней». Archiv für Tierernaehrung. 50–1 (1): 13–24. Дои:10.1080/17450399709386115. PMID 9205733.
- ^ Панель EFSA CONTAM (Панель EFSA по загрязнителям в пищевой цепи) (2013). «Научное заключение о рисках для здоровья животных и населения, связанных с присутствием ниваленола в пищевых продуктах и кормах». Журнал EFSA. 11 (6): 3262–119. Дои:10.2903 / j.efsa.2013.3262.
- ^ Гупта, Р. К., изд. (2015). Справочник по токсикологии боевых отравляющих веществ. Академическая пресса. С. 353–369. ISBN 9780128001592.
- ^ Венкатарамана, М .; Chandranayaka, S .; Пракаш, Х. С .; Ниранджа, Р. (2014). "na, S. (2014). Микотоксины, относящиеся к биологической войне и их обнаружение". Биологические токсины и биотерроризм: 22. Дои:10.1007/978-94-007-6645-7_32-1.
- ^ а б c McCormick, S.P .; Стэнли, А. М .; Stover, N.A .; Александр, Н. Дж. (2011). «Трихотецены: от простых микотоксинов к сложным». Токсины. 3 (7): 802–814. Дои:10.3390 / токсины 3070802. ЧВК 3202860. PMID 22069741.
- ^ а б c d Sidell, F. R .; Takafuji, E.T .; Франц, Д. Р. (1997). Медицинские аспекты химической и биологической войны. Правительственная печать США. С. 662–664. ISBN 978-9997320919.
- ^ Национальная медицинская библиотека США. "HSDB: Банк данных по опасным веществам". Получено 2018-03-23.
- ^ Deshmaneand, S.L .; Кремлев, С .; Amini, S .; Савая, Б. Э. (2009). «Моноцитарный хемоаттрактантный белок-1 (МСР-1): обзор». Журнал исследований интерферона и цитокинов. 29 (6): 313–326. Дои:10.1089 / июл.2008.0027. ЧВК 2755091. PMID 19441883.
- ^ Nagashima, H .; и другие. (2012). «Environ Toxicol Pharmacol». Экологическая токсикология и фармакология. 34 (3): 1014–7. Дои:10.1016 / j.etap.2012.07.008. PMID 22964157.
- ^ Deshmane, S.L .; и другие. (2009). «Моноцитарный хемоаттрактантный белок-1 (МСР-1): обзор». Журнал исследований интерферона и цитокинов. 29 (6): 313–326. Дои:10.1089 / июл.2008.0027. ЧВК 2755091. PMID 19441883.
- ^ Sugita-Konishi, Y .; Пестка, Дж. Дж. (2001). «Дифференциальная регуляция продукции TNF-альфа, IL-6 и IL-8 дезоксиниваленолом (вомитоксином) и другими 8-кетотрихотеценами в модели макрофагов человека». Toxicol Environ Health A. 64 (8): 619–36. Дои:10.1080/152873901753246223. PMID 11766169.
- ^ Минервини, Ф .; и другие. (2004). «Токсичность и апоптоз, вызванные микотоксинами ниваленолом, дезоксиниваленолом и фумонизином B1 в линии клеток эритролейкемии человека». Токсикол in vitro. 18 (1): 21–8. Дои:10.1016 / S0887-2333 (03) 00130-9. PMID 14630058.
- ^ Тарану, I .; и другие. (2010). «Сравнительные аспекты пролиферации in vitro лимфоцитов человека и свиньи, подвергнутых воздействию микотоксинов». Arch Anim Nutr. 64 (5): 383–93. Дои:10.1080 / 1745039X.2010.492140. PMID 21114234. S2CID 20521758.
- ^ Sundstøl Eriksen, G .; Pettersson, H .; Лунд, Т. (2004). «Сравнительная цитотоксичность дезоксиниваленола, ниваленола, их ацетилированных производных и деэпоксиметаболитов». Пищевая и химическая токсикология. 42 (4): 619–624. Дои:10.1016 / j.fct.2003.11.006. PMID 15019186.
- ^ Pettersson, H .; Хедман, Р. (1997). «Токсичность и метаболизм ниваленола у сельскохозяйственных животных». Коммуникации по исследованию зерновых. Akadémiai Kiadó. 25–3 (3): 423–427. Дои:10.1007 / BF03543746.
- ^ а б c d е ж грамм час я j k "Заключение Научного комитета по пищевым продуктам относительно токсинов фузариоза, часть 41: Ниваленол" (PDF). Научный комитет по пищевым продуктам: 2–6. 2000.

