Нуклеозид фосфорамидит - Nucleoside phosphoramidite

Нуклеозидные фосфорамидиты являются производными натурального или синтетического нуклеозиды. Они привыкли синтезировать олигонуклеотиды, относительно короткие фрагменты нуклеиновая кислота и их аналоги. Нуклеозидные фосфорамидиты были впервые введены в 1981 г. Бокажем и Карутерсом.[1] Чтобы избежать нежелательных побочных реакций, реактивные гидрокси- и экзоциклические аминогруппы, присутствующие в природных или синтетических нуклеозидах, должным образом защищены. Пока нуклеозидный аналог содержит по меньшей мере одну гидроксигруппу, использование соответствующей стратегии защиты позволяет преобразовать ее в соответствующий фосфорамидит и включить последний в синтетические нуклеиновые кислоты. Чтобы быть включенным в середину олигонуклеотидной цепи с использованием стратегии фосфорамидита, аналог нуклеозида должен иметь две гидроксигруппы или, реже, гидроксигруппу и другую нуклеофильную группу (амино или меркапто). Примеры включают, но не ограничиваются, альтернативные нуклеотиды, LNA, морфолино, нуклеозиды, модифицированные в 2'-положении (OMe, защищенный NH2, F), нуклеозиды, содержащие неканонические основания (гипоксантин и ксантин содержится в природных нуклеозидах инозин и ксантозин соответственно, трициклические основания типа G-струбцины,[2] и т.д.) или оснований, дериватизированных флуоресцентной группой или линкерным плечом.
Подготовка
Существует три основных метода получения нуклеозид-фосфорамидитов.
- Обычный метод включает обработку защищенного нуклеозида, несущего одну свободную гидроксигруппу, фосфородиамидитом под каталитическим действием слабой кислоты.[3][4] Хотя о некоторых бисамидитах сообщалось как о термически нестабильных соединениях,[5] 2-цианоэтил N, N, N ', N'-тетраизопропилфосфородиамидит, амидит, используемый для получения коммерческих нуклеозидфосфорамидитов, относительно стабилен. Его можно синтезировать с использованием двухэтапной процедуры в одном реакторе и очистить с помощью вакуум дистилляция.[6] В прекрасном обзоре очень подробно описывается использование последнего реагента для получения нуклеозидных и ненуклеозидных фосфорамидитов.[7]
 DMT = 4,4'-диметокситритил; B = необязательно защищенное нуклеиновое основание; R = фосфатная защитная группа
DMT = 4,4'-диметокситритил; B = необязательно защищенное нуклеиновое основание; R = фосфатная защитная группа
- Во втором методе защищенный нуклеозид обрабатывают фосфорохлоридитом в присутствии органического основания, чаще всего N-этил-N, N-диизопропиламин (База Хунига).[8]

- В третьем методе[9] защищенный нуклеозид сначала обрабатывают хлор-N, N, N ', N'-тетраизопропилфосфородиамидитом в присутствии органического основания, чаще всего N-этил-N, N-диизопропиламина (основание Хунига), с образованием защищенного нуклеозиддиамидита. Последний обрабатывают спиртом, соответствующим желаемой защитной группе фосфита, например 2-цианоэтанолом, в присутствии слабой кислоты.

Нуклеозидные фосфорамидиты очищаются колоночная хроматография на силикагель. Чтобы гарантировать стабильность фосфорамидитного фрагмента, рекомендуется уравновесить колонку элюентом, содержащим от 3 до 5% триэтиламина, и поддерживать эту концентрацию в элюенте на протяжении всего процесса разделения. Чистоту фосфорамидита можно оценить по 31п ЯМР-спектроскопия. Поскольку атом P (III) в нуклеозид-фосфорамидите является хиральным, он показывает два пика примерно при 149 м.д., соответствующих двум диастереомерам соединения. Потенциально присутствующая примесь триэфира фосфита демонстрирует пик при 138–140 ppm. Примеси H-фосфоната имеют пики при 8 и 10 ppm.
Химические свойства фосфорамидитного фрагмента
Нуклеозидные фосфорамидиты представляют собой относительно стабильные соединения с длительным сроком хранения при хранении в виде порошков в безводных условиях в отсутствие воздуха при температуре ниже 4 ° C. Амидиты выдерживают умеренные основные условия. Напротив, в присутствии даже слабых кислот фосфорамидиты гибнут почти мгновенно. Фосфорамидиты относительно устойчивы к гидролизу в нейтральных условиях. Например, период полураспада 2-цианоэтил 5'-О- (4,4'-диметокситритил)тимидин -3'-О- (N, N-диизопропиламино) фосфит в 95% водном ацетонитрил при 25 ° C - 200 ч.[10]
- Наиболее важной особенностью фосфорамидитов является их способность вступать в реакцию сочетания фосфорамидита, то есть реагировать с нуклеофильными группами в присутствии кислого азол катализатор 1ЧАС-тетразол, 2-этилтиотетразол,[11] 2-бензилтиотетразол,[12][13] 4,5-дицианоимидазол,[14] или ряд подобных соединений. Реакция идет чрезвычайно быстро. Именно эта особенность делает нуклеозид фосфорамидиты полезными промежуточными продуктами в синтез олигонуклеотидов. Стереохимически соединение фосфорамидита приводит к эпимеризация (формирование диастереомеры ) в хиральном центре P (III).
 Х = О, S, NH.
Х = О, S, NH.
Когда вода используется в качестве нуклеофила, продукт представляет собой сложный диэфир H-фосфоновой кислоты, как показано на схеме выше. Из-за присутствия остаточной воды в растворителях и реагентах образование последнего соединения является наиболее частым осложнением при препаративном использовании фосфорамидитов, особенно при синтезе олигонуклеотидов.
- Фосфорамидиты легко окисляются слабыми окислителями, например водным йодом в присутствии слабых оснований или пероксид водорода[15] с образованием соответствующих фосфорамидатов.
 X = S, Se.
X = S, Se.
Точно так же фосфорамидиты реагируют с другими халькогены. При контакте с раствором серы[15][16] или ряд соединений, вместе называемых сульфуризирующие агенты,[17][18] фосфорамидиты количественно образуют фосфоротиоамидаты. Реакция с селеном[15][16] или производные селена[19] производит фосфороселеноамидаты. Во всех реакциях этого типа конфигурация атома фосфора сохраняется.
- Нуклеозидные фосфорамидиты подвергаются Реакция Михаэлиса-Арбузова с образованием соответствующих фосфонамидатов. В одном примере описывается получение фосфонамидатов в присутствии акрилонитрила.[20] Сообщается, что при комнатной температуре реакция является стереоселективной с сохранением конфигурации в фосфорном центре. Напротив, при проведении при 55 ° C реакция приводит к рацемизированный товары.
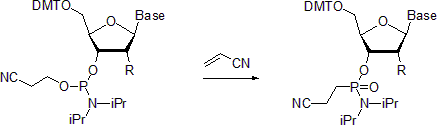
- Как и фосфины и третичные фосфиты, фосфорамидиты легко подвергаются Реакция Штаудингера.
(РО)2П-Н (R1)2 + R2-N3 + H2О ---- (РО)2P (= O) -N (R1)2 + R2-NH2 + N2;
Стратегия защиты
Встречающиеся в природе нуклеотиды (нуклеозид-3'- или 5'-фосфаты) и их фосфодиэфирные аналоги недостаточно реакционноспособны, чтобы обеспечить быстрое синтетическое получение олигонуклеотидов с высокими выходами. Селективность и скорость образования межнуклеозидных связей резко улучшаются при использовании 3'-О-(N,N-диизопропилфосфорамидит) производные нуклеозидов (нуклеозид-фосфорамидиты), которые служат строительными блоками в методологии фосфит-триэфира. Чтобы предотвратить нежелательные побочные реакции, все другие функциональные группы, присутствующие в нуклеозидах, должны быть неактивными (защищены) путем присоединения защитные группы. По завершении сборки олигонуклеотидной цепи все защитные группы удаляются с получением желаемых олигонуклеотидов. Ниже приведены защитные группы, используемые в настоящее время в коммерчески доступных[21][22][23][24][25] и наиболее распространенные структурные элементы нуклеозид-фосфорамидита кратко рассмотрены:
- 5'-гидроксильная группа защищена неустойчивым к кислотам ДМТ (4,4'-диметокситритил) группа.
- Тимин и урацил, нуклеиновые основания тимидин и уридин соответственно, не имеют экзоциклических аминогрупп и, следовательно, не требуют защиты. Напротив, нуклеиновые основания аденин, цитозин, и гуанин несут экзоциклические аминогруппы, которые реагируют с активированными фосфорамидитами в условиях реакции сочетания. Хотя за счет дополнительных стадий в синтетическом цикле сборка олигонуклеотидной цепи может быть проведена с использованием фосфорамидитов с незащищенными аминогруппами,[26] чаще всего они постоянно защищены по всей длине сборки олигонуклеотидной цепи. Защита экзоциклических аминогрупп должна быть ортогональной защите 5'-гидроксигруппы, поскольку последняя удаляется в конце каждого цикла синтеза. Самой простой в реализации и, следовательно, наиболее широко принятой является стратегия, при которой экзоциклические аминогруппы несут лабильную по основанию защиту. Чаще всего используются две схемы защиты.
- В первом - стандартная и более надежная схема (рисунок), Bz (бензоильная) защита используется для A, dA, C, dC, G и dG, защищенных изобутирильной группой. В последнее время, Ac (ацетильная) группа часто используется для защиты C и dC, как показано на рисунке.[27]
- Во второй, умеренной схеме защиты, A и dA защищены изобутирилом.[28] или феноксиацетильные группы (PAC).[29] C и dC несут ацетильную защиту,[27] а G и dG защищены 4-изопропилфеноксиацетилом (i-Pr-PAC)[30] или диметилформамидино (dmf)[31] группы. Мягкие защитные группы удаляются легче, чем стандартные защитные группы. Однако фосфорамидиты, несущие эти группы, менее стабильны при хранении в растворе.
- Фосфитная группа защищена лабильным основанием 2-цианоэтил группа.[32] После того, как фосфорамидит был связан с олигонуклеотидом, связанным с твердой подложкой, и фосфитные фрагменты были преобразованы в частицы P (V), присутствие фосфатной защиты не является обязательным для успешного проведения дальнейших реакций сочетания.[33]

- В синтезе РНК 2'-гидроксильная группа защищена TBDMS (т-бутилдиметилсилил) группа.[34][35][36][37] или с ТОМ (три-iso-пропилсилилоксиметил) группа,[38][39] оба удаляются обработкой фторид-ионом.
- Фосфитный фрагмент также содержит диизопропиламино (яPr2N) группа, реактивная в кислых условиях. При активации диизопропиламиногруппа уходит и замещается 5'-гидроксигруппой связанного с носителем олигонуклеотида.
Смотрите также
Рекомендации
- ^ Beaucage, S.L .; Карутерс М. (1981). «Дезоксинуклеозид фосфорамидиты - новый класс ключевых промежуточных продуктов для синтеза дезоксиполинуклеотидов». Буквы Тетраэдра. 22 (20): 1859–1862. Дои:10.1016 / S0040-4039 (01) 90461-7.
- ^ Лин, К.-Й., Маттеуччи, М. Д. (1998). «Аналог цитозина, способный зажимать гуанин в спиральных нуклеиновых кислотах». Варенье. Chem. Soc. 120 (33): 8531–8532. Дои:10.1021 / ja981286z.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Nielsen, J .; Marugg, J. E .; Taagaard, M .; Van Boom, J. H .; Даль, О. (1986). «Синтез дезоксиолигонуклеотидов на полимерной основе с использованием дезоксинуклеозид-2-цианоэтилфосфорамидитов, полученных in situ». Рек. Trav. Чим. Pays-Bas. 105 (1): 33–34. Дои:10.1002 / recl.19861050106.
- ^ Nielsen, J .; Taagaard, M .; Marugg, J. E .; Van Boom, J. H .; Даль, О. (1986). «Применение 2-цианоэтил N, N, N ', N'-тетраизопропилфосфородиамидита для получения in situ дезоксирибонуклеозид фосфорамидитов и их использование в синтезе олигодезоксирибонуклеотидов на полимерной основе». Нуклеиновые кислоты Res. 14 (18): 7391–7403. Дои:10.1093 / nar / 14.18.7391. ЧВК 311758. PMID 3763407.
- ^ Nielsen, J .; Marugg, J. E .; Van Boom, J. H .; Honnens, J .; Taagaard, M .; Даль, О. (1986). «Термическая нестабильность некоторых алкилфосфородиамидитов». J. Chem Res. Краткое содержание (1): 26–27.
- ^ Nielsen, J .; Даль, О. (1987). «Улучшенный синтез 2-цианоэтил N, N, N ', N'-тетраизопропилфосфородиамидита (iPr2N) 2POCH2CH2CN)». Нуклеиновые кислоты Res. 15 (8): 3626. Дои:10.1093 / nar / 15.8.3626. ЧВК 340760. PMID 3575107.
- ^ Бокаж, С. Л. (2001). «2-Цианоэтилтетраизопропилфосфородиамидит». Энциклопедия реагентов для органического синтеза E-EROS. Дои:10.1002 / 047084289X.rn00312. ISBN 0471936235.
- ^ Sinha, N.D .; Biernat, J .; Кестер, Х. (1983). «β-Цианоэтил N, N-диалкиламино / N-морфолиномонохлорфосфоамидиты, новые фосфитилирующие агенты, облегчающие снятие защиты и переработку синтезированных олигонуклеотидов». Tetrahedron Lett. 24 (52): 5843–5846. Дои:10.1016 / S0040-4039 (00) 94216-3.
- ^ Marugg, J. E .; Бурик, А .; Тромп, М .; Ван дер Марель, Г. А. и Ван Бум, Дж. Х. (1986). «Новый и универсальный подход к получению ценных дезоксинуклеозидных 3'-фосфитных интермедиатов». Tetrahedron Lett. 24 (20): 2271–22274. Дои:10.1016 / S0040-4039 (00) 84506-2.
- ^ Гузаев, А.П .; Манохаран, М. (2001). «2-Бензамидоэтильная группа - новый тип фосфатной защитной группы для синтеза олигонуклеотидов». Варенье. Chem. Soc. 123 (5): 783–793. Дои:10.1021 / ja0016396. PMID 11456611.
- ^ Sproat, B .; Colonna, F .; Мулла, Б .; Tsou, D .; Андрус, А .; Hampel, A .; Винаяк, Р. (февраль 1995 г.). «Эффективный метод выделения и очистки олигорибонуклеотидов». Нуклеозиды и нуклеотиды. 14 (1&2): 255–273. Дои:10.1080/15257779508014668. ISSN 0261-3166.
- ^ Stutz, A .; Hobartner, C .; Питч, С. (сентябрь 2000 г.). «Новые фторид-лабильные защитные группы азотистых оснований для синтеза 3 '(2') - O-аминоацилированных последовательностей РНК». Helv. Чим. Acta. 83 (9): 2477–2503. Дои:10.1002 / 1522-2675 (20000906) 83: 9 <2477 :: aid-hlca2477> 3.0.co; 2-9. ISSN 0018-019X.
- ^ Welz, R .; Мюллер, С. (январь 2002 г.). «5- (Бензилмеркапто) -1H-тетразол в качестве активатора для 2'-O-TBDMS фосфорамидитных строительных блоков в синтезе РНК». Буквы Тетраэдра. 43 (5): 795–797. Дои:10.1016 / S0040-4039 (01) 02274-2. ISSN 0040-4039.
- ^ Vargeese, C .; Картер, Дж .; Yegge, J .; Кривянский, С .; Settle, A .; Kropp, E .; Петерсон, К .; Пикен, В. (1998). «Эффективная активация нуклеозидфосфорамидитов 4,5-дицианоимидазолом при синтезе олигонуклеотидов». Нуклеиновые кислоты Res. 26 (4): 1046–1050. Дои:10.1093 / nar / 26.4.1046. ISSN 0305-1048. ЧВК 147346. PMID 9461466.
- ^ а б c Gacs-Baitz, E .; Sipos, F .; Egypt, O .; Саги, Г. (2009). «Синтез и структурное исследование различных окисленных диастереомерных производных 5'-диметокситритил-тимидин-3'-O- [O- (2-цианоэтил) -N, N-диизопропил] -фосфорамидитовых производных. Сравнение эффектов P = O, P = S и P = Se зависят от спектральных и хроматографических свойств ЯМР ". Хиральность. 21 (7): 663–673. Дои:10.1002 / chir.20653. PMID 18937288.
- ^ а б Nemer, M. J .; Огилви, К. К. (1980). «Фосфорамидатные аналоги дирибонуклеозидмонофосфатов». Tetrahedron Lett. 21 (43): 4153–4154. Дои:10.1016 / с0040-4039 (00) 93675-х.
- ^ Wilk, A .; Узнанский, Б .; Стек, В. Дж. (1991). «Присвоение абсолютной конфигурации фосфора в дитимидилил (3 ', 5') фосформорфолидатах и -фосформорфолидотиоатов». Нуклеозиды и нуклеотиды. 10 (1–3): 319–322. Дои:10.1080/07328319108046469.
- ^ Гузаев, А. П. (2011). «Реакционная способность 3H-1,2,4-дитиазол-3-тионов и 3H-1,2-дитиол-3-тионов в качестве сульфуризующих агентов для синтеза олигонуклеотидов». Буквы Тетраэдра. 52 (3): 434–437. Дои:10.1016 / j.tetlet.2010.11.086.
- ^ Холлоуэй, Г. А .; Павот, С .; Scaringe, S.A .; Lu, Y .; Раухфус, Т. Б. (2002). «Металлоорганический путь к олигонуклеотидам, содержащим фосфороселеноат». ChemBioChem. 3 (11): 1061–1065. Дои:10.1002 / 1439-7633 (20021104) 3:11 <1061 :: help-cbic1061> 3.0.co; 2-9. PMID 12404630.
- ^ Равикумар, В. Т .; Кумар, Р. К. (2004). «Стереоселективный синтез алкилфосфонатов: легкая перегруппировка цианоэтил-защищенных нуклеозидных фосфорамидитов». Орг. Процесс Res. Dev. 8 (4): 603–608. Дои:10.1021 / op030035u.
- ^ «Бета-цианоэтилфосфорамидиты». Products.appliedbiosystems.com. Получено 2009-05-12.
- ^ «Биопоисковые Технологии». Biosearchtech.com. Получено 2009-05-12.
- ^ "ChemGenes Corporation, биотехнологическая компания". Chemgenes.com. Получено 2009-05-12.
- ^ М. Пауэлл (17 января 2008 г.). «Инструменты прикладных биосистем». Glenresearch.com. Получено 2009-05-12.
- ^ «Синтез нуклеиновых кислот и маркировка». Thermo.com. 2008-08-16. Архивировано из оригинал 28 февраля 2009 г.. Получено 2009-05-12.
- ^ Грязнов, С. М .; Летцингер, Р. Л. (1991). «Синтез олигонуклеотидов через мономеры с незащищенными основаниями». Варенье. Chem. Soc. 113 (15): 5876–5877. Дои:10.1021 / ja00015a059.
- ^ а б Редди, М. П .; Hanna, N.B .; Фаруки, Ф. (1997). «Сверхбыстрое расщепление и снятие защиты с синтеза олигонуклеотидов и использование CAc Деривативы ». Нуклеозиды и нуклеотиды. 16 (7–9): 1589–1598. Дои:10.1080/07328319708006236.
- ^ Макминн, Д. (1997). «Синтез олигонуклеотидов, содержащих 3'-алкиламины, с использованием N-изобутирил-защищенного дезоксиаденозинфосфорамидита». Tetrahedron Lett. 38 (18): 3123. Дои:10.1016 / S0040-4039 (97) 00568-6.
- ^ Schulhof, J.C .; Молко, Д .; Теуль, Р. (1987). «Конечная стадия снятия защиты в синтезе олигонуклеотидов сводится к легкой и быстрой обработке аммиаком с использованием лабильных групп, защищающих основание». Нуклеиновые кислоты Res. 15 (2): 397–416. Дои:10.1093 / nar / 15.2.397. ЧВК 340442. PMID 3822812.
- ^ Чжу, К. (2001). «Наблюдение и устранение N-ацетилирования олигонуклеотидов, полученных с использованием фосфорамидитов быстрого снятия защиты и сверхмягкого снятия защиты». Биоорг. Med. Chem. Латыш. 11 (9): 1105–7. Дои:10.1016 / S0960-894X (01) 00161-5. PMID 11354354.
- ^ McBride, L.J .; Kierzek, R .; Beaucage, S.L .; Карутерс, М. Х. (1986). «Химия нуклеотидов. 16. Защитные группы амидина для синтеза олигонуклеотидов». Варенье. Chem. Soc. 108 (8): 2040. Дои:10.1021 / ja00268a052.
- ^ Sinha, N.D .; Biernat, J .; McManus, J .; Кестер, Х. (1984). «Полимерный поддерживающий синтез олигонуклеотидов. XVIII: использование β-цианоэтил-N, N-диалкиламино- / N-морфолинофосфорамидита дезоксинуклеозидов для синтеза фрагментов ДНК, упрощающих снятие защиты и выделение конечного продукта». Нуклеиновые кислоты Res. 12 (11): 4539–4557. Дои:10.1093 / nar / 12.11.4539. ЧВК 318857. PMID 6547529.
- ^ Гузаев, А.П .; Манохаран, М. (2001). «Сочетание фосфорамидита с олигонуклеотидами, несущими незащищенные межнуклеозидные фосфатные фрагменты». J. Org. Chem. 66 (5): 1798–1804. Дои:10.1021 / jo001591e. PMID 11262130.
- ^ Огилви, К. К .; Theriault, N .; Садана, К. Л. (1977). «Синтез олигорибонуклеотидов». Варенье. Chem. Soc. 99 (23): 7741–7743. Дои:10.1021 / ja00465a073. PMID 915168.
- ^ Усман, Н .; Огилви, К. К .; Jiang, M. Y .; Седергрен, Р. Дж. (1987). «Автоматизированный химический синтез длинных олигорибунклеотидов с использованием 2'-O-силилированных рибонуклеозид 3'-O-фосфорамидитов на стеклянной подложке с контролируемыми порами: синтез 43-нуклеотидной последовательности, подобной 3'-половинной молекуле формилметионина Escherichia coli тРНК ». Варенье. Chem. Soc. 109 (25): 7845–7854. Дои:10.1021 / ja00259a037.
- ^ Усман, Н .; Pon, R.T .; Огилви, К. К. (1985). «Получение рибонуклеозид-3'-O-фосфорамидитов и их применение в автоматизированном твердофазном синтезе олигонуклеотидов». Tetrahedron Lett. 26 (38): 4567–4570. Дои:10.1016 / S0040-4039 (00) 98753-7.
- ^ Scaringe, S.A .; Francklyn, C .; Усман, Н. (1990). «Химический синтез биологически активных олигорибонуклеотидов с использованием β-цианоэтил-защищенных рибонуклеозидфосфорамидитов». Нуклеиновые кислоты Res. 18 (18): 5433–5441. Дои:10.1093 / nar / 18.18.5433. ЧВК 332221. PMID 2216717.
- ^ Pitsch, S .; Weiss, P. A .; Wu, X .; Ackermann, D .; Онеггер, Т. (1999). «Быстрый и надежный автоматизированный синтез РНК и частично 2'-O-защищенных предшественников (« закрытая РНК ») на основе двух новых ортогональных 2'-O-защитных групп». Helv. Чим. Acta. 82 (10): 1753–1761. Дои:10.1002 / (SICI) 1522-2675 (19991006) 82:10 <1753 :: AID-HLCA1753> 3.0.CO; 2-Y.
- ^ Pitsch, S .; Weiss, P. A .; Jenny, L .; Stutz, A .; Ву, X. (2001). «Надежный химический синтез олигорибонуклеотидов (РНК) с 2'-O - [(триизопропилсилил) окси] метил (2'-O-том) -защищенными фосфорамидитами». Helv. Чим. Acta. 84 (12): 3773–3795. Дои:10.1002 / 1522-2675 (20011219) 84:12 <3773 :: AID-HLCA3773> 3.0.CO; 2-E.
дальнейшее чтение
- Комплексная химия натуральных продуктов, Том 7: ДНК и аспекты молекулярной биологии. Kool, Эрик Т .; Редактор. Нет. (1999), 733 стр. Издательство: (Elsevier, Amsterdam, Neth.)
- Бокаж С. Л., Айер Р. П. (1992). «Достижения в синтезе олигонуклеотидов с помощью фосфорамидитного подхода». Тетраэдр. 48 (12): 2223–2311. Дои:10.1016 / s0040-4020 (01) 88752-4.
- Бокаж С. Л., Айер Р. П. (1993). «Функционализация олигонуклеотидов через производные фосфорамидита». Тетраэдр. 49 (10): 1925–1963. Дои:10.1016 / s0040-4020 (01) 86295-5.
- Бокаж С. Л., Айер Р. П. (1993). «Синтез модифицированных олигонуклеотидов с помощью фосфорамидитного подхода и их применения». Тетраэдр. 49 (28): 6123–6194. Дои:10.1016 / s0040-4020 (01) 87958-8.
- Бокаж, С. Л. «Синтез олигодезоксирибонуклеотидов. Фосфорамидитный подход. Методы в молекулярной биологии (Тотова, Нью-Джерси, США) (1993), 20 (Протоколы для олигонуклеотидов и аналогов), 33–61.
- Риз К. Б. (2002). «Химический синтез олиго- и полинуклеотидов: личный комментарий». Тетраэдр. 58 (44): 8893–8920. Дои:10.1016 / с0040-4020 (02) 01084-0.
- Браун Т., Браун Д. Дж. С. 1991. В олигонуклеотидах и аналогах. Практический подход, под ред. Ф. Экштейн, стр. 1-24. Оксфорд: IRL.






