Фазовая диаграмма - Phase diagram
- Об использовании этого термина в математике и физике см. фазовый портрет и фазовое пространство.

А фазовая диаграмма в физическая химия, инженерное дело, минералогия, и материаловедение это тип диаграмма используется для отображения условий (давление, температура, объем и т. д.), при которых термодинамически различны фазы (например, твердое, жидкое или газообразное состояние) возникают и сосуществуют при равновесие.
Обзор
Общие компоненты фазовой диаграммы: линии равновесия или границы фаз, которые относятся к линиям, обозначающим условия, при которых несколько фаз могут сосуществовать в состоянии равновесия. Фазовые переходы происходят по линиям равновесия. Метастабильный фазы не показаны на фазовых диаграммах, поскольку, несмотря на их обычное появление, они не являются равновесными фазами.
Тройные точки точки на фазовых диаграммах, где линии равновесия пересекаются. Тройные точки обозначают условия, при которых могут сосуществовать три разные фазы. Например, фазовая диаграмма воды имеет тройную точку, соответствующую одной температуре и давлению, при которых твердая, жидкая и газообразная вода могут сосуществовать в устойчивом равновесии (273.16 K и парциальное давление пара 611.657 Па).
В солидус - температура, ниже которой вещество устойчиво в твердом состоянии. В ликвидус - температура, выше которой вещество устойчиво в жидком состоянии. Может быть разрыв между солидусом и ликвидусом; внутри зазора вещество состоит из смеси кристаллов и жидкости (как "суспензия ").[1]
Рабочие жидкости часто классифицируются на основе формы их фазовой диаграммы.
Типы
2-мерные диаграммы
Давление в зависимости от температуры

Простейшие фазовые диаграммы - это диаграммы давление – температура одного простого вещества, например воды. В топоры соответствуют давление и температура. Фазовая диаграмма показывает в пространстве давление – температура линии равновесия или фазовых границ между тремя фазами твердый, жидкость, и газ.
Кривые на фазовой диаграмме показывают точки, в которых свободная энергия (и другие производные свойства) становятся неаналитическими: их производные по координатам (температура и давление в этом примере) изменяются скачкообразно (скачкообразно). Например, теплоемкость контейнера, заполненного льдом, резко изменится, когда контейнер нагреется до температуры выше точки плавления. Просторы, где свободная энергия является аналитический, соответствуют однофазным областям. Однофазные области разделены линиями неаналитического поведения, где фазовые переходы происходят, которые называются границы фаз.
На диаграмме справа фазовая граница между жидкостью и газом не продолжается бесконечно. Вместо этого он заканчивается в точке на фазовой диаграмме, называемой критическая точка. Это отражает тот факт, что при чрезвычайно высоких температурах и давлениях жидкая и газовая фазы становятся неразличимыми,[2] в так называемом сверхкритическая жидкость. В воде критическая точка находится примерно на Тc = 647,096 К (373,946 ° С), пc = 22,064 МПа (217,75 атм) и ρc = 356 кг / м3.[3]
Наличие критической точки жидкость – газ обнаруживает небольшую неоднозначность в маркировке однофазных областей. Переходя от жидкой фазы к газовой, обычно пересекают фазовую границу, но можно выбрать путь, который никогда не пересекает границу, двигаясь вправо от критической точки. Таким образом, жидкая и газовая фазы могут непрерывно смешиваться друг с другом. Граница твердой и жидкой фаз может заканчиваться в критической точке только в том случае, если твердая и жидкая фазы имеют одинаковые группа симметрии.[нужна цитата ]
Для большинства веществ фазовая граница твердое тело – жидкость (или кривая плавления) на фазовой диаграмме имеет положительный наклон так что температура плавления увеличивается с давлением. Это верно, когда твердая фаза плотнее чем жидкая фаза.[4] Чем больше давление на данное вещество, тем ближе друг к другу молекулы вещества, что увеличивает эффект воздействия вещества. межмолекулярные силы. Таким образом, веществу требуется более высокая температура, чтобы его молекулы имели достаточно энергии, чтобы вырваться из фиксированной структуры твердой фазы и войти в жидкую фазу. Аналогичная концепция применима к фазовым переходам жидкость-газ.[5]
Исключением является вода, имеющая границу твердое тело-жидкость с отрицательным наклоном, поэтому температура плавления снижается с давлением. Это происходит потому, что лед (твердая вода) менее плотен, чем жидкая вода, о чем свидетельствует тот факт, что лед плавает по воде. На молекулярном уровне лед менее плотный, потому что он имеет более обширную сеть водородная связь что требует большего разделения молекул воды.[4] Другие исключения включают сурьма и висмут.[6][7]
Величина наклона dп/ дТ дается Уравнение Клаузиуса-Клапейрона для плавки (плавки)[8]
где ΔЧАСсуетиться - теплота плавления, которая всегда положительна, а ΔVсуетиться изменение объема для плавления. Для большинства веществ ΔVсуетиться положительный, так что наклон положительный. Однако для воды и других исключений ΔVсуетиться отрицательный, поэтому наклон отрицательный.
Другие термодинамические свойства
Помимо температуры и давления, на диаграммах состояния могут быть изображены другие термодинамические свойства. Примеры таких термодинамических свойств включают: удельный объем, удельная энтальпия, или конкретный энтропия. Например, однокомпонентные графики зависимости температуры от удельной энтропии (Т vs. s) для воды /пар или для хладагент обычно используются для иллюстрации термодинамические циклы например, Цикл Карно, Цикл Ренкина, или парокомпрессионное охлаждение цикл.
Любые две термодинамические величины могут быть показаны на горизонтальной и вертикальной осях двумерной диаграммы. Каждая из дополнительных термодинамических величин может быть проиллюстрирована с приращением в виде ряда линий - изогнутых, прямых или комбинации изогнутых и прямых. Каждый из них изо-линии представляют термодинамическую величину при некотором постоянном значении.

 |  |  |
| энтальпия – энтропия (час–s) диаграмма для пара | давление – энтальпия (п–час) диаграмма для пара | температура – энтропия (Т–s) диаграмма для пара |
3-х мерные диаграммы
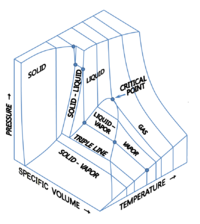
Можно представить себе трехмерные (3D) графики, показывающие три термодинамические величины.[9][10] Например, для отдельного компонента диаграмма с декартовыми координатами в 3D может отображать температуру (Т) на одной оси давление (п) на второй оси, а удельный объем (v) на третьем. Такой трехмерный граф иногда называют п–v–Т диаграмма. Условия равновесия показаны в виде кривых на изогнутой поверхности в 3D с областями для твердой, жидкой и паровой фаз и областями, где твердое и жидкое, твердое и парообразное или жидкость и пар сосуществуют в равновесии. Линия на поверхности называется тройная линия здесь твердое тело, жидкость и пар могут сосуществовать в равновесии. Критическая точка остается точкой на поверхности даже на трехмерной фазовой диаграмме.
Для воды 3D п–v–Т диаграмма видна здесь:[11]

Трехмерная фазовая диаграмма водных жидкостей и отдельных льдов
An орфографическая проекция 3D п–v–Т График, показывающий давление и температуру по вертикальной и горизонтальной осям, сворачивает трехмерный график в стандартную двухмерную диаграмму давления и температуры. Когда это сделано, поверхности твердое тело-пар, твердое тело-жидкость и жидкость-пар схлопываются в три соответствующие изогнутые линии, пересекающиеся в тройной точке, которая является свернутой ортографической проекцией тройной линии.
Бинарные смеси
Могут быть построены другие, гораздо более сложные типы фазовых диаграмм, особенно когда присутствует более одного чистого компонента. В этом случае, концентрация становится важной переменной. Могут быть построены фазовые диаграммы с более чем двумя измерениями, которые показывают влияние более чем двух переменных на фазу вещества. Фазовые диаграммы могут использовать другие переменные в дополнение к температуре, давлению и составу или вместо них, например, силу приложенного электрического или магнитного поля, а также могут включать вещества, которые принимают более трех состояний материи.


Один тип фазовой диаграммы отображает температуру в зависимости от относительных концентраций двух веществ в двоичный смесь называется двоичная фазовая диаграмма, как показано справа. Такая смесь может быть как Твердый раствор, эвтектика или перитектический, среди прочего. Эти два типа смесей дают очень разные графики. Другой тип бинарной фазовой диаграммы - это диаграмма точки кипения для смеси двух компонентов, т.е. е. химические соединения. По двум конкретным летучий компоненты под определенным давлением, такие как атмосферное давление, диаграмма точки кипения показывает, что пар (газ) составы находятся в равновесие с заданными жидкими составами в зависимости от температуры. На типичной бинарной диаграмме точки кипения температура отложена по вертикальной оси, а состав смеси - по горизонтальной оси.

Простой пример диаграммы с гипотетическими компонентами 1 и 2 в не-азеотропный смесь показана справа. Тот факт, что есть две отдельные изогнутые линии, соединяющие точки кипения чистых компонентов, означает, что состав пара обычно не такой же, как состав жидкости, с которой пар находится в равновесии. Увидеть Парожидкостное равновесие за дополнительной информацией.
Помимо вышеупомянутых типов фазовых диаграмм существуют тысячи других возможных комбинаций. Некоторые из основных особенностей фазовых диаграмм включают точки конгруэнтности, в которых твердая фаза непосредственно превращается в жидкость. Также есть перитектоид, точка, в которой две твердые фазы объединяются в одну твердую фазу во время охлаждения. Обратный процесс, когда одна твердая фаза превращается в две твердые фазы во время охлаждения, называется эвтектоидом.
Сложная фазовая диаграмма имеет большое технологическое значение. утюг –углерод система с содержанием углерода менее 7% (см. сталь ).
Ось абсцисс такой диаграммы представляет переменную концентрации смеси. Поскольку смеси обычно далеки от разбавленных и их плотность как функция температуры обычно неизвестна, предпочтительной мерой концентрации является мольная доля. Измерение на основе объема, например молярность было бы нецелесообразно.
Кристаллы
Полиморфный и полиаморфный вещества имеют несколько кристалл или аморфный фазы, которые можно изобразить аналогично твердой, жидкой и газовой фазам.

Мезофазы
Некоторые органические материалы проходят через промежуточные состояния между твердым телом и жидкостью; эти состояния называются мезофазы. Внимание было направлено на мезофазы, потому что они позволяют устройства отображения и стали коммерчески важными благодаря так называемым жидкокристаллический технологии. Фазовые диаграммы используются для описания возникновения мезофаз.[13]
Смотрите также
- КАЛЬФАД (метод)
- Конгруэнтное плавление и неконгруэнтное плавление
- Правило фаз Гиббса
- Стеклянные базы данных
- Гамильтонова механика
- Разделение фаз
- Анализ Шрейнемейкера
- Вычислительная термодинамика
- Тернарный сюжет
- Рабочие жидкости
использованная литература
- ^ Предель, Бруно; Hoch, Michael J. R .; Пул, Монте (2004). Фазовые диаграммы и гетерогенные равновесия: практическое введение. Springer. ISBN 978-3-540-14011-5.
- ^ Papon, P .; Leblond, J .; Мейер, П. Х. Э. (2002). Физика фазового перехода: концепции и приложения. Берлин: Springer. ISBN 978-3-540-43236-4.
- ^ Международная ассоциация свойств воды и пара «Руководство по использованию фундаментальных физических констант и основных констант воды», 2001, с. 5
- ^ а б Whitten, Kenneth W .; Галлей, Кеннет Д.; Дэвис, Раймонд Э. (1992). Общая химия (4-е изд.). Издательство колледжа Сондерс. п.477.
- ^ Дорин, Генри; Деммин, Питер Э .; Габель, Дороти Л. (1992). Химия: изучение материи Прентис (Четвертое изд.). Prentice Hall. стр.266–273. ISBN 978-0-13-127333-7.
- ^ Аверилл, Брюс А .; Элдридж, Патрисия (2012). «11.7 Фазовые диаграммы». Основы общей химии. Creative Commons.
- ^ Petrucci, Ralph H .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия. Принципы и современные приложения (8-е изд.). Прентис Холл. п. 477.
- ^ Laidler, Keith J .; Мейзер, Джон Х. (1982). Физическая химия. Бенджамин / Каммингс. С. 173–74.
- ^ Земанский, Марк В .; Диттман, Ричард Х. (1981). Тепло и термодинамика (6-е изд.). Макгроу-Хилл. Рис. 2-3, 2-4, 2-5, 10-10, P10-1. ISBN 978-0-07-072808-0.
- ^ Веб-апплет: Трехмерные фазовые диаграммы для воды, диоксида углерода и аммиака. Описано в Глассер, Лесли; Эрраэс, Ангел; Хэнсон, Роберт М. (2009). «Интерактивные трехмерные фазовые диаграммы с использованием Jmol». Журнал химического образования. 86 (5): 566. Bibcode:2009JChEd..86..566G. Дои:10.1021 / ed086p566.
- ^ Дэвид, Карл (2016-08-08). 3-D "Фазовая диаграмма льда" Вервибе переработана.. Учебные материалы по химии.
- ^ Аналогичную схему можно найти на сайте Структура воды и наука. Структура воды и наука Сайт Мартина Чаплина, по состоянию на 2 июля 2015 г.
- ^ Чандрасекхар, Шиварамакришна (1992). Жидкие кристаллы (2-е изд.). Издательство Кембриджского университета. С. 27–29, 356. ISBN 978-0-521-41747-1.
внешние ссылки
- Пример фазовой диаграммы карбида железа-железа
- Как построить фазовую диаграмму
- Фазовые изменения: Фазовые диаграммы: Часть 1
- Фазовая диаграмма равновесия Fe-C
- Фазовые диаграммы для бессвинцовых припоев
- Библиотека фазовых диаграмм DoITPoMS
- Пакет преподавания и обучения DoITPoMS - «Фазовые диаграммы и затвердевание»
- Фазовые диаграммы: начало мудрости - статья в журнале открытого доступа
- Бинодальные кривые, связующие линии, правило рычага и инвариантные точки - Как читать фазовые диаграммы (Видео SciFox на TIB AV-Portal)


