Тетралин - Tetralin
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1,2,3,4-тетрагидронафталин | |
| Другие имена 1,2,3,4-Тетрагидронафталин, Бензоциклогексан, NSC 77451, Тетрагидронафталин, Тетранап | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.003.946 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C10ЧАС12 | |
| Молярная масса | 132.206 г · моль−1 |
| Внешность | бесцветная жидкость с запахом, похожим на нафталин |
| Плотность | 0,970 г / см3 |
| Температура плавления | -35,8 ° С (-32,4 ° F, 237,3 К) |
| Точка кипения | От 206 до 208 ° C (от 403 до 406 ° F, от 479 до 481 K) |
| Нерастворимый | |
| Вязкость | 2.02 cP при 25 ° C[1] |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности данных JT Baker |
| точка возгорания | 77 ° С (171 ° F, 350 К) |
| 385 ° С (725 ° F, 658 К) | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетралин (1,2,3,4-тетрагидронафталин) это углеводород имея химическая формула C10ЧАС12. Это частично гидрогенизированный производная от нафталин. Это бесцветная жидкость, которая используется в качестве водорододонорный растворитель.[2]
Производство
Тетралин получают каталитическим гидрированием нафталина.[2]
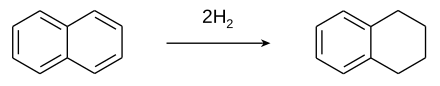
Хотя традиционно используются никелевые катализаторы, было изучено множество вариантов.[3] Чрезмерное гидрирование превращает тетралин в октагидронафталин (декалин ). Редко встречается дигидронафталин (Ввести номер ).
Лабораторные методы
В классике названная реакция называется Синтез тетралина Дарценса, названный в честь Огюст Жорж Дарзенс (1926), производные может быть подготовлен внутримолекулярный электрофильное ароматическое замещение реакция 1-арил-4-пентена с использованием концентрированный серная кислота,[4]

Использует
Тетралин используется как водорододонорный растворитель, например в разжижение угля. Он функционирует как источник H2, который переходит в уголь. Частично гидрогенизированный уголь более растворим.[5][2]
Он был использован в быстрые реакторы с натриевым теплоносителем в качестве вторичной охлаждающей жидкости для сохранения затвердевания натриевых уплотнений вокруг рабочих колес насоса.
Он также используется для лабораторного синтеза HBr:
- C10ЧАС12 + 4 руб.2 → С10ЧАС8Br4 + 4 HBr
Легкость этой реакции частично является следствием умеренной силы бензиловый Связи C-H.
Безопасность
LD50 (крысы, перорально) - 2,68 г / кг. Тетралин вызывает метгемоглобинемия.[2]
Рекомендации
- ^ Gonçalves, F.A .; Хамано, К .; Сенгерс, Дж. В. (1989). «Плотность и вязкость тетралина и транс-декалина». Международный журнал теплофизики. 10 (4): 845. Bibcode:1989IJT .... 10..845G. Дои:10.1007 / BF00514480.
- ^ а б c d Коллин, Герд; Хёке, Хартмут; Грейм, Гельмут (2003). «Нафталин и гидронафталины». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a17_001.pub2.
- ^ Кричко, А. А .; Скворцов, Д. В .; Титова, Т. А .; Филиппов, Б. С .; Догадкина, Н. Э. (1969). «Производство тетралина гидрированием нафталинсодержащих фракций». Химия и технология топлив и масел. 5: 18. Дои:10.1007 / BF00727949.
- ^ Майкл Б. Смит (2011). Органический синтез (третье изд.). Академическая пресса. С. 1209–1210. ISBN 9780124158849.
- ^ Isa, Khairuddin Md .; Абдулла Туан Амран Туан; Мэриленд Али, Уми Фазара (2018). «Растворители-доноры водорода в ожижении биомассы: обзор». Обзоры возобновляемой и устойчивой энергетики. 81 (Часть_1): 1259-1268. Дои:10.1016 / j.rser.2017.04.006.CS1 maint: несколько имен: список авторов (связь)
