Теория переходного состояния - Transition state theory
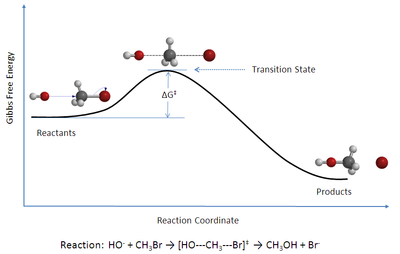
Теория переходного состояния (TST) объясняет скорость реакции элементарного химические реакции. Теория предполагает особый тип химическое равновесие (квазиравновесие) между реагенты и активирован переходное состояние комплексы.[1]
TST используется в первую очередь для качественного понимания того, как протекают химические реакции. TST оказался менее успешным в своей первоначальной цели расчета абсолютных констант скорости реакции, потому что расчет абсолютных скоростей реакции требует точного знания поверхностей потенциальной энергии,[2] но он успешно рассчитал стандарт энтальпия активации (ΔЧАС‡, также пишется Δ‡ЧАСɵ), стандарт энтропия активации (ΔS‡ или Δ‡Sɵ), а стандарт Энергия Гиббса активации (Δграмм‡ или Δ‡граммɵ) для конкретной реакции, если ее константа скорости была определена экспериментально. (The ‡ обозначение относится к стоимости интереса в переходном состоянии; ΔЧАС‡ представляет собой разницу между энтальпией переходного состояния и энтальпией реагентов.)
Эта теория была разработана одновременно в 1935 г. Генри Айринг, затем на Университет Принстона, и по Мередит Гвинн Эванс и Майкл Поланьи из Манчестерский университет.[3][4] TST также называют «теорией активированного комплекса», «теорией абсолютной скорости» и «теорией абсолютной скорости реакции».[5]
До развития TST закон скорости Аррениуса широко использовался для определения энергии реакционного барьера. В Уравнение Аррениуса выводится из эмпирических наблюдений и игнорирует любые механистические соображения, например, участвуют ли один или несколько реактивных промежуточных продуктов в превращении реагента в продукт.[6] Следовательно, необходимо дальнейшее развитие, чтобы понять два параметра, связанных с этим законом, предэкспоненциальный множитель (А) и энергии активации (Eа). TST, что привело к Уравнение Эйринга, успешно решает эти две проблемы; однако прошло 46 лет между публикацией закона ставок Аррениуса в 1889 году и уравнения Эйринга, выведенного из TST, в 1935 году. В течение этого периода многие ученые и исследователи внесли значительный вклад в развитие теории.
Теория
Основные идеи теории переходного состояния заключаются в следующем:
- Скорость реакции можно изучить, исследуя активированные комплексы вблизи точка перевала из поверхность потенциальной энергии. Детали того, как эти комплексы образуются, не важны. Сама седловая точка называется переходным состоянием.
- Активированные комплексы находятся в особом равновесии (квазиравновесии) с молекулами реагентов.
- Активированные комплексы могут превращаться в продукты, и кинетическая теория может использоваться для расчета скорости этого превращения.
Разработка
При разработке TST использовались три подхода, кратко изложенные ниже.
Термодинамическая обработка
В 1884 г. Якобус Ван'т Хофф предложил Уравнение Ван 'т Гоффа описывающая температурную зависимость константы равновесия обратимой реакции:
где ΔU изменение внутренней энергии, K это константа равновесия реакции, р это универсальная газовая постоянная, и Т является термодинамическая температура. На основании экспериментальных работ 1889 г. Сванте Аррениус предложил аналогичное выражение для константы скорости реакции:
Интеграция этого выражения приводит к Уравнение Аррениуса
куда k - константа скорости. А назывался частотным фактором (теперь называется предэкспоненциальным коэффициентом), и Eа рассматривается как энергия активации. К началу 20 века многие приняли уравнение Аррениуса, но физическая интерпретация А и Eа осталось неясным. Это привело к тому, что многие исследователи химической кинетики предложили разные теории протекания химических реакций в попытке связать А и Eа к молекулярной динамике, непосредственно ответственной за химические реакции.[нужна цитата ]
В 1910 г. французский химик Рене Марселин ввел понятие стандартной энергии активации Гиббса. Его отношение можно записать как
Примерно в то же время, когда Марселин работал над своей формулой, голландские химики Филип Абрахам Констамм, Франс Эппо Корнелис Шеффер и Видольд Франс Брандсма ввели стандартную энтропию активации и стандартную энтальпию активации. Они предложили следующее уравнение константы скорости
Однако природа константы все еще оставалась неясной.
Кинетическая теория лечения
В начале 1900 г. Макс Траутц и Уильям Льюис изучили скорость реакции, используя теория столкновений, на основе кинетическая теория газов. Теория столкновений рассматривает реагирующие молекулы как сталкивающиеся друг с другом твердые сферы; эта теория не учитывает изменения энтропии, так как предполагает, что столкновения между молекулами полностью упругие.
Льюис применил свое лечение к следующей реакции и получил хорошее согласие с экспериментальным результатом.
2HI → H2 + Я2
Однако позже, когда то же самое лечение было применено к другим реакциям, между теоретическими и экспериментальными результатами возникли большие расхождения.
Статистико-механическая обработка
Статистическая механика сыграл значительную роль в развитии TST. Однако применение статистической механики к TST развивалось очень медленно, учитывая тот факт, что в середине XIX века Джеймс Клерк Максвелл, Людвиг Больцманн, и Леопольд Пфаундлер опубликовал несколько статей, в которых обсуждаются равновесие и скорости реакции с точки зрения молекулярных движений и статистического распределения молекулярных скоростей.
Только в 1912 г. французский химик А. Берту использовал Распределение Максвелла – Больцмана закон, чтобы получить выражение для константы скорости.
куда а и б - константы, связанные с энергетическими членами.
Два года спустя, Рене Марселин внесли существенный вклад, рассматривая ход химической реакции как движение точки в фазовое пространство. Затем он применил статистико-механические процедуры Гиббса и получил выражение, подобное тому, которое он получил ранее из термодинамических соображений.
В 1915 году еще один важный вклад внес британский физик Джеймс Райс. Основываясь на своем статистическом анализе, он пришел к выводу, что константа скорости пропорциональна «критическому приращению». Его идеи получили дальнейшее развитие Ричард Чейс Толман. В 1919 г. австрийский физик Карл Фердинанд Херцфельд применяемый статистическая механика к константа равновесия и кинетической теории к константе скорости обратной реакции, k−1, для обратимой диссоциации двухатомной молекулы.[7]
Он получил следующее уравнение для константы скорости прямой реакции[8]
куда - энергия диссоциации при абсолютном нуле, kB это Постоянная Больцмана, час это Постоянная Планка, Т термодинамическая температура, является частота колебаний Это выражение очень важно, так как фактор kBТ/час, который является критическим компонентом TST, появился в уравнении скорости.
В 1920 году американский химик Ричард Чейс Толман далее развил идею Райс о критическом приращении. Он пришел к выводу, что критическое приращение (теперь называемое энергией активации) реакции равно средней энергии всех молекул, вступающих в реакцию, за вычетом средней энергии всех молекул реагентов.
Поверхности потенциальной энергии
Концепция поверхности потенциальной энергии сыграла очень важную роль в развитии TST. Основы этой концепции были заложены Рене Марселин в 1913 году. Он предположил, что развитие химической реакции можно описать как точку на поверхности потенциальной энергии с координатами в атомных импульсах и расстояниях.
В 1931 г. Генри Айринг и Майкл Поланьи построил поверхность потенциальной энергии для реакции ниже. Эта поверхность представляет собой трехмерную диаграмму, основанную на принципах квантовой механики, а также экспериментальных данных о частотах колебаний и энергиях диссоциации.
H + H2 → H2 + H
Через год после строительства Эйринга и Поланьи Ханс Пельцер и Юджин Вигнер внесли важный вклад, наблюдая за развитием реакции на поверхности потенциальной энергии. Важность этой работы заключалась в том, что впервые обсуждалась концепция перевала или седловой точки на поверхности потенциальной энергии. Они пришли к выводу, что скорость реакции определяется движением системы через этот перевал.
Обычно предполагалось, что ограничивающая скорость или самая нижняя седловая точка расположена на той же энергетической поверхности, что и начальное основное состояние. Однако недавно было обнаружено, что это может быть неверно для процессов, происходящих в полупроводниках и изоляторах, где начальное возбужденное состояние может проходить через седловую точку ниже, чем на поверхности исходного основного состояния.[9]
Обоснование уравнения Эйринга.
Одна из самых важных функций, представленных Айринг, Поланьи и Эванс было представление, что активированные комплексы находятся в квазиравновесии с реагентами. Тогда скорость прямо пропорциональна концентрации этих комплексов, умноженной на частоту (kBТ/час), с помощью которых они превращаются в продукты. Ниже приводится нестрогий аргумент правдоподобия функциональной формы уравнения Эйринга. Однако ключевой статистический механический фактор kBТ/час не будет оправдан, и приведенный ниже аргумент не является истинным «выводом» уравнения Эйринга.[10]
Квазиравновесное предположение
Квазиравновесие отличается от классического химического равновесия, но может быть описано с помощью аналогичной термодинамической обработки.[5] [11] Рассмотрим реакцию ниже
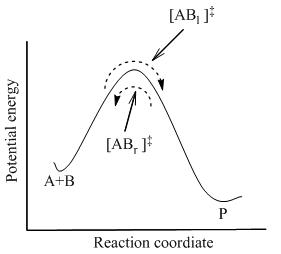
где полное равновесие достигается между всеми видами в системе, включая активированные комплексы, [AB]‡ . Используя статистическую механику, концентрация [AB]‡ можно рассчитать по концентрации A и B.
TST предполагает, что даже когда реагенты и продукты не находятся в равновесии друг с другом, активированные комплексы находятся в квазиравновесии с реагентами. Как показано на рисунке 2, в любой момент времени существует несколько активированных комплексов, а некоторые из них в недавнем прошлом были молекулами реагентов, которые обозначены [ABл]‡ (поскольку они движутся слева направо). Остальные из них были молекулами продуктов в недавнем прошлом ([ABр]‡).
В TST предполагается, что потоки активированных комплексов в двух направлениях не зависят друг от друга. То есть, если все молекулы продукта были внезапно удалены из реакционной системы, поток [ABр]‡ останавливается, но поток слева направо все равно идет. Следовательно, чтобы быть технически правильным, реагенты находятся в равновесии только с [ABл]‡, активированные комплексы, которые были реагентами в недавнем прошлом.
Аргумент правдоподобия
Активированные комплексы не следуют распределению энергии Больцмана, но «константа равновесия» все же может быть получена из распределения, которому они действительно следуют. В константа равновесия K‡ для квазиравновесия можно записать как
- .
Итак, концентрация переходного состояния AB‡ является
- .
Следовательно, уравнение скорости производства продукта имеет вид
- ,
где константа скорости k дан кем-то
- .
Здесь, k‡ прямо пропорциональна частоте колебательной моды, ответственной за превращение активированного комплекса в продукт; частота этой колебательной моды равна . Каждая вибрация не обязательно приводит к образованию продукта, поэтому постоянная пропорциональности , называемый коэффициентом передачи, вводится для учета этого эффекта. Так k‡ можно переписать как
- .
Для константы равновесия K‡ статистическая механика приводит к выражению, зависящему от температуры, которое имеет вид
- ().
Объединение новых выражений для k‡ и K‡можно записать новое выражение для константы скорости, которое имеет вид
- .
Поскольку по определению Δграмм‡ = ΔЧАС‡ –ТΔS‡, выражение константы скорости может быть расширено, чтобы получить альтернативную форму уравнения Эйринга:
- .
Для правильной размерности уравнение должно иметь дополнительный множитель (c⊖)1–м для реакций, которые не являются мономолекулярными:
- ,
куда c⊖ стандартная концентрация 1 моль л–1 и м это молекулярность.[12]
Выводы из теории переходных состояний и взаимосвязь с теорией Аррениуса
Выражение константы скорости из теории переходного состояния можно использовать для расчета Δграмм‡, ΔЧАС‡, ΔS‡, и даже ΔV‡ (объем активации) с использованием экспериментальных данных скорости. Эти так называемые параметры активации дать представление о природе переходное состояние, включая энергосодержание и степень упорядоченности по сравнению с исходными материалами, и стал стандартным инструментом для выяснения механизмов реакции в физическая органическая химия. Свободная энергия активации, Δграмм‡, является определенный в теории переходного состояния быть такой энергией, что держит. Параметры ΔЧАС‡ и ΔS‡ затем можно вывести, определяя Δграмм‡ = ΔЧАС‡ – ТΔS‡ при разных температурах.
Поскольку функциональная форма уравнений Эйринга и Аррениуса схожа, возникает соблазн связать параметры активации с энергией активации и предэкспоненциальными факторами лечения Аррениуса. Однако уравнение Аррениуса было получено из экспериментальных данных и моделирует макроскопическую скорость, используя только два параметра, независимо от числа переходных состояний в механизме. Напротив, параметры активации можно найти для каждого переходного состояния многоступенчатого механизма, по крайней мере, в принципе. Таким образом, хотя энтальпия активации ΔЧАС‡, часто приравнивается к энергии активации Аррениуса Eа, они не эквивалентны. Для стадии реакции в конденсированной фазе (например, в фазе раствора) или в мономолекулярной газовой фазе Eа = ΔЧАС‡ + RT. Для других газофазных реакций Eа = ΔЧАС‡ + (1 - Δп‡)RT, где Δп‡ - изменение количества молекул при образовании переходного состояния.[13] (Таким образом, для бимолекулярного газофазного процесса Eа = ΔЧАС‡ + 2RT.)
Энтропия активации, ΔS‡, показывает степень, в которой переходное состояние (включая любые молекулы растворителя, участвующие в реакции или нарушенные ею) является более неупорядоченным по сравнению с исходными материалами. Он предлагает конкретную интерпретацию предэкспоненциального множителя. А в уравнении Аррениуса; для мономолекулярного одностадийного процесса грубая эквивалентность А = (kBТ/час) ехр (1 + ΔS‡/р) (или же А = (kBТ/час) ехр (2 + ΔS‡/р) для бимолекулярных газофазных реакций) выполняется. Для мономолекулярного процесса отрицательное значение указывает на более упорядоченное, жесткое переходное состояние, чем основное состояние, в то время как положительное значение отражает переходное состояние с более слабыми связями и / или большей конформационной свободой. Важно отметить, что из соображений размерности реакции бимолекулярные и выше имеют ΔS‡ значения, которые зависят от стандартное состояние выбранная (в частности, стандартная концентрация). Для самых последних публикаций 1 моль л–1 или выбирается 1 моляр. Поскольку этот выбор сделан человеком, исходя из наших определений единиц для молярного количества и объема, величина и знак ΔS‡ поскольку единственная реакция бессмысленна сама по себе; Допустимо только сравнение значения с эталонной реакцией «известного» (или предполагаемого) механизма, сделанное в том же стандартном состоянии.[14]
Объем активации находится путем взятия частной производной от Δграмм‡ по давлению (постоянная температура выдержки): . Он дает информацию о размере и, следовательно, степени связывания в переходном состоянии. Ассоциативный механизм, вероятно, будет иметь отрицательный объем активации, а диссоциативный механизм, вероятно, будет иметь положительное значение.
Учитывая взаимосвязь между константой равновесия и константами прямой и обратной скорости, из уравнения Эйринга следует, что
- .
Еще одно значение TST - это Принцип Куртина – Хэммета: соотношение продуктов кинетически контролируемая реакция от R к двум продуктам A и B будет отражать разницу в энергиях соответствующих переходных состояний, ведущих к продукту, при условии, что для каждого из них имеется одно переходное состояние:
- ().
(В выражении для ΔΔграмм‡ выше есть дополнительная термин, если A и B образованы из двух разных видов SА и SB в равновесии.)
«Правило 1.36»: Для термодинамически управляемая реакция, каждое отличие RT ln 10 ≈ (1.987 × 10–3 ккал / моль K) (298 K) (2.303) ≈ 1,36 ккал / моль в свободных энергиях продуктов A и B приводит к 10-кратной селективности при комнатной температуре (298 К):
- ().
Аналогично, каждые 1,36 ккал / моль разницы в свободной энергии активации приводят к 10-кратному увеличению избирательность для кинетически контролируемого процесса при комнатной температуре:[15]
- ().
Примерные цифры: Используя уравнение Эйринга, существует прямая связь между Δграмм‡, константы скорости первого порядка и период полураспада реакции при данной температуре. В 298 К, реакция с Δграмм‡ = 23 ккал / моль имеет константу скорости k ≈ 8.4 × 10–5 s–1 и период полураспада т1/2 ≈ 2,3 часа, цифры, которые часто округляются до к ~ 10–4 s–1 и т1/2 ~ 2 ч.. Таким образом, свободная энергия активации такой величины соответствует типичной реакции, которая продолжается до завершения в течение ночи при комнатной температуре. Для сравнения циклогексан стул флип имеет Δграмм‡ около 11 ккал / моль с к ~ 105 s–1, что делает его динамическим процессом, который происходит быстро (быстрее, чем шкала времени ЯМР) при комнатной температуре. На другом конце шкалы цис / транс изомеризация 2-бутена имеет Δграмм‡ около 60 ккал / моль, что соответствует к ~ 10–31 s–1 при 298 К. Это ничтожно малая скорость: период полураспада на 12 порядков больше, чем у возраст вселенной.[16]
Ограничения
В целом, TST предоставила исследователям концептуальную основу для понимания того, как протекают химические реакции. Хотя теория широко применима, у нее есть ограничения. Например, применительно к каждому элементарному этапу многоступенчатой реакции теория предполагает, что каждый промежуточный продукт является достаточно долгоживущим, чтобы достичь распределения энергий Больцмана перед переходом к следующему этапу. Когда промежуточные продукты очень недолговечны, TST не работает. В таких случаях импульс траектории реакции от реагентов к промежуточному продукту может переноситься вперед, чтобы повлиять на селективность продукта (примером такой реакции является термическое разложение диазаобициклопентанов, представленное Анслином и Догерти ).
Теория переходного состояния также основана на предположении, что атомные ядра ведут себя согласно классическая механика.[17] Предполагается, что если атомы или молекулы не сталкиваются с достаточной энергией для образования переходной структуры, реакция не происходит. Однако, согласно квантовой механике, для любого барьера с конечным количеством энергии существует вероятность того, что частицы все еще могут туннелировать через барьер. Что касается химических реакций, это означает, что существует вероятность того, что молекулы будут реагировать, даже если они не столкнутся с энергией, достаточной для преодоления энергетического барьера.[18] Хотя этим эффектом можно пренебречь для реакций с большими энергиями активации, он становится важным явлением для реакций с относительно низкими энергетическими барьерами, поскольку вероятность туннелирования увеличивается с уменьшением высоты барьера.
Теория переходного состояния не работает для некоторых реакций при высокой температуре. Теория предполагает, что реакционная система пройдет через седловую точку с самой низкой энергией на поверхности потенциальной энергии. Хотя это описание согласуется с реакциями, протекающими при относительно низких температурах, при высоких температурах молекулы населяют колебательные моды более высоких энергий; их движение становится более сложным, и столкновения могут привести к переходным состояниям, удаленным от седловой точки с самой низкой энергией. Это отклонение от теории переходного состояния наблюдается даже в простой реакции обмена между двухатомным водородом и водородным радикалом.[19]
Учитывая эти ограничения, было предложено несколько альтернатив теории переходного состояния. Ниже следует краткое обсуждение этих теорий.
Обобщенная теория переходного состояния
Любая форма TST, например микроканоническая вариационная TST, каноническая вариационная ТСТ, а улучшенная каноническая вариационная TST, в которой переходное состояние не обязательно находится в седловой точке, называется обобщенной теорией переходных состояний.
Микроканоническая вариационная ТСТ
Фундаментальный недостаток теории переходного состояния состоит в том, что она считает любое пересечение переходного состояния реакцией реагентов на продукты или наоборот. В действительности молекула может пересечь эту «разделяющую поверхность» и развернуться, или пересечь ее несколько раз и только один раз по-настоящему отреагировать. Таким образом, нескорректированный TST обеспечивает верхнюю границу для коэффициентов скорости. Чтобы исправить это, вариационная теория переходного состояния изменяет положение разделяющей поверхности, которая определяет успешную реакцию, чтобы минимизировать скорость для каждой фиксированной энергии. [20] Выражения для скоростей, полученные в этой микроканонической трактовке, можно проинтегрировать по энергии с учетом статистического распределения по энергетическим состояниям, чтобы получить канонические или тепловые скорости.
Каноническая вариационная ТСТ
Развитие теории переходного состояния, в которой положение разделяющей поверхности изменяется таким образом, чтобы минимизировать константу скорости при заданной температуре.
Улучшенная каноническая вариационная TST
Модификация канонической вариационной теории переходных состояний, в которой для энергий ниже пороговой энергии положение разделяющей поверхности принимается за положение микроканонической пороговой энергии. Это заставляет вклады в константы скорости равняться нулю, если они ниже пороговой энергии. Затем выбирается компромиссная разделяющая поверхность, чтобы минимизировать вклады в константу скорости, вносимые реагентами, имеющими более высокие энергии.
Неадиабатическая TST
Распространение TST на реакции, в которых одновременно задействованы два спиновых состояния, называется теория неадиабатических переходных состояний (NA-TST).
Полуклассический ТСТ
Используя теорию колебательных возмущений, такие эффекты, как туннелирование и вариационные эффекты, можно учесть в пределах SCTST формализм.
Приложения
Ферментативные реакции
Ферменты катализируют химические реакции с поразительной скоростью по сравнению с некаталитической химией при тех же условиях реакции. Каждое каталитическое событие требует минимум трех, а часто и более шагов, каждый из которых происходит в течение нескольких миллисекунд, что характерно для типичных ферментативных реакций. Согласно теории переходного состояния, наименьшая часть каталитического цикла тратится на наиболее важный этап - этап переходного состояния. Первоначальные предложения теории абсолютной скорости реакции для химических реакций определяли переходное состояние как отдельные частицы в координатах реакции, которые определяли абсолютную скорость реакции. Вскоре после этого Линус Полинг предположил, что мощное каталитическое действие ферментов можно объяснить специфическим прочным связыванием с частицами переходного состояния. [21] Поскольку скорость реакции пропорциональна доле реагента в комплексе переходного состояния, было предложено использовать фермент для увеличения концентрации реакционноспособных частиц.
Это предложение было оформлено Вольфенденом и его коллегами в Университет Северной Каролины в Чапел-Хилл, который предположил, что увеличение скорости, вызываемое ферментами, пропорционально сродству фермента к структуре переходного состояния по отношению к комплексу Михаэлиса.[22] Поскольку ферменты обычно увеличивают скорость некаталитической реакции в 10 раз.10-1015, комплексы Михаэлиса[требуется разъяснение ] часто имеют константы диссоциации в диапазоне 10−3-10−6 M предполагается, что комплексы переходного состояния связаны с константами диссоциации в диапазоне 10−14 -10−23 М. По мере того как субстрат переходит от комплекса Михаэлиса к продукту, химические процессы происходят за счет индуцированных ферментом изменений в распределении электронов в субстрате.
Ферменты изменяют электронную структуру за счет протонирования, отрыва протона, переноса электрона, геометрического искажения, гидрофобного разделения и взаимодействия с кислотами и основаниями Льюиса. Это достигается последовательными конформационными изменениями белков и субстратов. Когда комбинация отдельных слабых сил воздействует на подложку, суммирование отдельных энергий приводит к большим силам, способным перемещать связывающие электроны, вызывая разрыв связей и образование связей. Аналоги, которые напоминают структуры переходного состояния, поэтому должны обеспечивать самые мощные известные нековалентные ингибиторы, даже если захватывается лишь небольшая часть энергии переходного состояния.
Все химические превращения проходят через нестабильную структуру, называемую переходным состоянием, которая находится между химическими структурами субстратов и продуктов. Предполагается, что переходные состояния для химических реакций имеют время жизни около 10−13 секунд, порядка времени колебания одинарной связи. Нет доступных физических или спектроскопических методов для непосредственного наблюдения за структурой переходного состояния для ферментативных реакций, однако структура переходного состояния является центральной для понимания ферментного катализа, поскольку ферменты работают за счет снижения энергии активации химического превращения.
В настоящее время принято считать, что ферменты функционируют для стабилизации переходных состояний, лежащих между реагентами и продуктами, и поэтому ожидается, что они будут прочно связывать любой ингибитор, который очень похож на такое переходное состояние. Субстраты и продукты часто участвуют в нескольких ферментативных реакциях, тогда как переходное состояние обычно характерно для одного конкретного фермента, так что такой ингибитор имеет тенденцию быть специфичным для этого конкретного фермента. Идентификация многочисленных ингибиторов переходного состояния подтверждает гипотезу стабилизации переходного состояния для ферментативного катализа.
В настоящее время известно большое количество ферментов, которые взаимодействуют с аналогами переходного состояния, большинство из которых были разработаны с целью ингибирования целевого фермента. Примеры включают протеазу ВИЧ-1, рацемазы, β-лактамазы, металлопротеиназы, циклооксигеназы и многие другие.
Адсорбция на поверхностях и реакции на поверхностях
Десорбцию, а также реакции на поверхности просто описать с помощью теории переходного состояния. Анализ адсорбции на поверхности из жидкой фазы может представлять проблему из-за отсутствия возможности оценить концентрацию растворенного вещества у поверхности. Когда полная информация недоступна, было предложено нормировать концентрации реагирующих веществ на концентрацию активных поверхностных центров, было предложено приближение, называемое приближением равной плотности поверхностных реагентов (SREA).[23]
Смотрите также
Примечания
- ^ ИЮПАК, Сборник химической терминологии 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "теория переходного состояния ". Дои:10.1351 / goldbook.T06470
- ^ Truhlar, D. G .; Garrett, B.C .; Клиппенштейн, С. Дж. (1996). «Современное состояние теории переходного состояния». J. Phys. Chem. 100 (31): 12771–12800. Дои:10.1021 / jp953748q.
- ^ Laidler, K .; Кинг, К. (1983). «Развитие теории переходного состояния». J. Phys. Chem. 87 (15): 2657. Дои:10.1021 / j100238a002.
- ^ Laidler, K .; Кинг, К. (1998). «Время существования теории переходного состояния». Химический разведчик. 4 (3): 39.
- ^ а б Лайдлер, К. Дж. (1969). Теории скорости химических реакций. Макгроу-Хилл.
- ^ Anslyn, E. V .; Догерти, Д. А. (2006). «Теория переходного состояния и связанные темы». Современная физико-органическая химия. Книги университетских наук. С. 365–373. ISBN 1891389319.
- ^ Герцфельд, К. Э. (1919). "Zur Theorie der Reaktionsgeschwindigkeiten in Gasen". Annalen der Physik. 364 (15): 635–667. Bibcode:1919АнП ... 364..635Н. Дои:10.1002 / andp.19193641504.
- ^ Кейт Дж. Лэйдлер, Химическая кинетика (3-е изд., Harper & Row, 1987), стр.88. ISBN 0-06-043862-2
- ^ Luo, G .; Kuech, T. F .; Морган, Д. (2018). «Переходное окислительно-восстановительное состояние при динамических процессах в полупроводниках и изоляторах». NPG Asia Материалы. 10 (4): 45–51. arXiv:1712.01686. Bibcode:2018npjAM..10 ... 45л. Дои:10.1038 / s41427-018-0010-0. S2CID 67780897.
- ^ Вводное описание статистической механики и элементарный вывод уравнения Эйринга см .: Lowry and Richardson, Механизм и теория органической химии, 3-е изд. (Harper & Row, 1987), стр. 248-253.
- ^ Steinfeld, Jeffrey L .; Франциско, Джозеф С .; Хасе, Уильям Л. (1999). Химическая кинетика и динамика (2-е изд.). Прентис-Холл. С. 289–293. ISBN 0-13-737123-3.
- ^ Лайдлер, Кейт Дж. (1981). «Символизм и терминология в химической кинетике» (PDF). Чистая и прикладная химия. ИЮПАК. 53: 753–771. Получено 9 августа 2019.
См. Стр.765, примечание m.
- ^ Steinfeld, Jeffrey L .; Франциско, Джозеф С .; Хасе, Уильям Л. (1999). Химическая кинетика и динамика (2-е изд.). Прентис-Холл. п. 302. ISBN 0-13-737123-3.
- ^ Карпентер, Барри К. (1984). Определение механизмов органических реакций. Нью-Йорк: Вили. ISBN 0471893692. OCLC 9894996.
- ^ Лоури, Томас Х. (1987). Механизм и теория в органической химии. Ричардсон, Кэтлин Шуэллер. (3-е изд.). Нью-Йорк: Харпер и Роу. ISBN 0060440848. OCLC 14214254.
- ^ Элиэль, Эрнест Л. (Эрнест Людвиг) (1994). Стереохимия органических соединений. Вилен, Сэмюэл Х., Мандер, Льюис Н. Нью-Йорк: Wiley. ISBN 0471016705. OCLC 27642721.
- ^ Эйринг, Х. (1935). «Активированный комплекс в химических реакциях». J. Chem. Phys. 3 (2): 107–115. Bibcode:1935ЖЧФ ... 3..107Э. Дои:10.1063/1.1749604.
- ^ Масел Р. (1996). Принципы адсорбции и реакций на твердых поверхностях.. Нью-Йорк: Вили.
- ^ Pineda, J. R .; Шварц, С. Д. (2006). «Белковая динамика и катализ: проблемы теории переходного состояния и тонкости динамического управления». Фил. Пер. R. Soc. B. 361 (1472): 1433–1438. Дои:10.1098 / rstb.2006.1877. ЧВК 1647311. PMID 16873129.
- ^ Truhlar, D .; Гарретт Б. (1984). «Теория вариационных переходных состояний». Анну. Rev. Phys. Chem. 35: 159–189. Bibcode:1984ARPC ... 35..159T. Дои:10.1146 / annurev.pc.35.100184.001111.
- ^ Полинг, Л. (1948). «Химические достижения и надежда на будущее». Американский ученый. 36: 50–58. PMID 18920436.
- ^ Radzicka, A .; Вольфенден, Р. (1995). «Опытный фермент». Наука. 267 (5194): 90–93. Bibcode:1995Научный ... 267 ... 90R. Дои:10.1126 / science.7809611. PMID 7809611.
- ^ Дойл, Питер Дж .; Савара, Адитья; Райман, Стивен С. (2020). «Извлечение значимых стандартных энтальпий и энтропий активации для поверхностных реакций из кинетических скоростей». Кинетика, механизмы и катализ реакции.. 129 (2): 551–581. Дои:10.1007 / s11144-020-01747-2. S2CID 211836011.
Рекомендации
- Анслин, Эрик V .; Doughtery, Деннис А., Теория переходных состояний и связанные темы. В Современная физико-органическая химия Книги университетских наук: 2006; стр. 365–373
- Клеланд В.В. Изотопные эффекты: определение структуры переходного состояния ферментов. Методы в энзимологии 1995, 249, 341-373
- Laidler, K .; Кинг К. Развитие теории переходного состояния. Журнал физической химии 1983, 87, (15), 2657
- Лайдлер К. Время существования теории переходного состояния. Химический разведчик 1998, 4, (3), 39
- Radzicka, A .; Уолденден, Р. Переходные состояния и мультисубстратные аналоговые ингибиторы. Методы в энзимологии 1995, 249, 284-312
- Шрамм В.Л. Ферментативные переходные состояния и аналоговый дизайн переходного состояния. Ежегодный обзор биохимии 1998, 67, 693-720
- Шрамм В.Л. Ферментативная теория переходных состояний и создание аналогов переходных состояний. Журнал биологической химии 2007, 282, (39), 28297-28300








![{displaystyle {ce {AB <=> [k_1] [k _ {- 1}] {A} + {B}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8df558c371c7f125f5833608e30f847abe2601de)



![{displaystyle {ce {{A} + {B} <=> {[AB] ^ {ddagger}} -> {P}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b873373ba74f1671f87574af29e3a0a9ba9c63d)
![{displaystyle K ^ {ddagger} = {frac {ce {[AB] ^ {ddagger}}} {ce {[A] [B]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1465c535ba1f38d0eb964550468ee6c1f19aeb98)
![{displaystyle [{ce {AB}}] ^ {ddagger} = K ^ {ddagger} [{ce {A}}] [{ce {B}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a67224b747342a2c608a96509499f845d991e801)
![{displaystyle {frac {d [{ce {P}}]} {dt}} = k ^ {ddagger} [{ce {AB}}] ^ {ddagger} = k ^ {ddagger} K ^ {ddagger} [{ ce {A}}] [{ce {B}}] = k [{ce {A}}] [{ce {B}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/618074b91e2c1707bac08640100ceed7c7da2214)












![{displaystyle {frac {[mathrm {A}]} {[mathrm {B}]}} = e ^ {- Delta Delta G ^ {ddagger} / RT}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac8276860d8cfb32f02aba8aba55acef114beb8b)


![{displaystyle {frac {[mathrm {A}]} {[mathrm {B}]}} = 10 ^ {- Delta G ^ {circ} / (1,36 mathrm {ккал / моль})}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91b01377882f2cca09a5e47e866e2f82b0a9a222)

![{displaystyle {frac {[mathrm {A}]} {[mathrm {B}]}} = 10 ^ {- Delta Delta G ^ {ddagger} / (1,36 mathrm {ккал / моль})}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b17890458cfb78285761eed11143f5343072c979)