Ангелицин - Angelicin
 | |
| Имена | |
|---|---|
| Произношение | ˈEɪn.dʒəlaɪ.sɪn |
| Название ИЮПАК 2ЧАС-фуро [2,3-ч] хромен-2-он | |
| Систематическое название ИЮПАК 2ЧАС-фуро [2,3-h] -1-бензопиран-2-он | |
| Другие имена изопсорален, 2ЧАС-фуро [2,3-h] хромен-2-он, фуро [2,3-h] хромен-2-он | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.164.795 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C11ЧАС6О3 | |
| Молярная масса | 186.166 г · моль−1 |
| Внешность | бледно-желтые кристаллы [1] |
| Температура плавления | 134 ° С |
| Точка кипения | 362,6 ° С |
| 10 мМ в ДМСО | |
| бревно п | 1.97[2] |
| Опасности | |
| Главный опасности | фотосенсибилизатор, везикант, канцероген |
| точка возгорания | 173,1 ° С |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ангелицин является исходным соединением в семействе встречающихся в природе органических соединений, известных как угловой фуранокумарины. Конструктивно его можно рассматривать как бензапира-2-он слит с фурановой группой в 7,8-положении. Ангелицин обычно содержится в некоторых Apiaceae и Fabaceae виды растений, такие как Bituminaria bituminosa. Имеет коэффициент проницаемости кожи (LogKп) -2,46.[2] Максимальное поглощение наблюдается при 300 нм.[3] В 1Доступен спектр HNMR;[1] инфракрасный и масс-спектры ангелицина можно найти в этом база данных. Сублимация ангелицина происходит при 120 ° C и давлении 0,13 Па.[4] Ангелицин - это кумарин.
История и этимология
Люди веками использовали растения, богатые ангелицином. Самая ранняя известная запись датируется 3000 годом до нашей эры, когда древние египтяне применяли масло и сок местных растений. Apiaceae виды, подвергающие кожу воздействию солнечного света, чтобы вылечить витилиго. Между тем, племена в Индии использовали Псоралея корилифолистная который содержал псорален, изомер ангелицина. Люди также пытались собирать растения в качестве альтернативного источника пищи. Однако большинство из них оказались невкусными и токсичными, например, Анжелика архангелика из-за способности раздражать кожу и повреждать внутренние органы.[5]

Название «ангелицин» происходит от вышеупомянутого растения, Анжелика. Это латинское название возникло в средневековой Европе, где это растение также использовалось как универсальное средство от многих типов болезней, не говоря уже о бубонная чума. В то время люди верили, что растение может предотвратить захват души колдовством, проклятием и злым духом (добавить ссылку). Анжелика появился бы во сне с ангелом, объясняющим его применение, отсюда и название. По иронии судьбы позже было обнаружено, что растительное масло токсично при использовании в больших количествах, особенно когда растение было свежим.[6]
Вид растений, в которых содержится ангелицин, был завезен в Британию в 19 веке. В настоящее время его можно найти в Канада и некоторые части Соединенные Штаты и Европа. Из-за токсичности определенных частей растений и способности растения размножаться, он включен в список инвазивные виды.[7]
Листья Анжелика архангелика, которые богаты ангелицином, используются для извлечения соединения.[8] Было проведено несколько исследований токсичности ангелицина, одно из которых показало, что это соединение вызывает хромосомное повреждение в клетках хомяка, подвергнутых воздействию УФ-излучения 320–380 нм.[9] Было показано, что хромосомные аберрации также индуцируются у людей.
В настоящее время обсуждается вопрос о том, Анжелика следует считать токсичным. Однако очевидно, что токсичность зависит от дозы ангелицин администрируется и является исключительно делом экспертов, когда дело доходит до его применения.
Биологический синтез
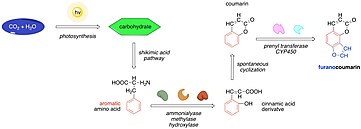
Биосинтез ангелицин можно описать как разновидность биологического синтеза фуранокумаринов. Он начинается с улавливания органического углерода путем фотосинтеза и образования углеводов. Впоследствии углеводы становятся субстратами путь шикимовой кислоты где они превращаются в фенилаланин и тирозин. Ферменты, такие как аммониализы, метилазы и гидроксилазы, затем превращают эти аминокислоты в производные коричной кислоты, которые подвергаются о-гидроксилирование дающие кумарины. Кумарины могут подвергаться дальнейшим реакциям, таким как пренилирование и окисление с образованием множества фуранокумаринов, одним из которых является ангелицин.[10]

Здесь биосинтез ангелицина описан более подробно, начиная с L-фенилаланина в качестве предшественника. Фенилаланин подвергается неокислительному дезаминированию за счет фенилаланин аммиак-лиаза (PAL) на транс-коричная кислота. Впоследствии транс-коричная кислота гидроксилирована по параграф позиция по транс-циннамат 4-монооксигеназа (C4H), который использует НАДФН, H+ и O2. Продукт, п-куаровая кислота, затем преобразуется в умбеллиферон, важный промежуточный продукт пути биосинтеза.[11]

2-гидроксилаза 4-кумаровая кислота (C2’H) гидроксилирует п-куаровая кислота в орто позиция. Примечательно, что в этой реакции используется альфа-кетоглутарат, который восстанавливается до сукцината, оба из которых участвуют в Цикл Кребса. Вновь образованный транс-дигидрокоричная кислота подвергается фотохимической изомеризации до СНГ изомер, который самопроизвольно лактонизирует чтобы получить умбелиферон.[12]

Впоследствии умбеллиферон 6-пренилтрансфераза (PT) связывает умбеллиферон с пренилдифосфатом с образованием остенола и пирофосфата. Остенол окисляется до (+) - колумбианетина с помощью (+) - колумбианетинсинтазы (CS), предполагаемой цитохром растений P450, хотя подробности этой реакции не ясны. Биосинтез завершается окислением (+) - колумбианетина с образованием ангелицина за счет ангелицин синтаза (AS), который также считается ферментом семейства цитохрома P450.[13]
Примечательно, что биосинтез ангелицина отличается от умбеллиферона, поскольку он также превращается в псорален, изомер ангелицина. Фактически, псорален, от которого происходит семейство линейных фуранокумаринов, гораздо более распространен в растениях, чем ангелицин. В результате большинство травоядных насекомых устойчивы к псоралену. Сейчас все чаще признается, что растения разработали путь, ведущий к ангелицину, как альтернативному защитному механизму. Например, ангелицин усиливает токсичность псоралена, действуя как ингибитор детоксицирующего цитохрома P450 у насекомых.[14] Более того, сравнение белковых последовательностей псораленсинтаза и ангелицинсинтаза показывает 70% личность общая и 40% идентичность в сайтах узнавания субстрата.[13] Это означает, что биосинтез ангелицина - это относительно недавно возникший признак.
Химический синтез


Йодирование имеющихся в продаже умбеллиферон (7-гидроксикумарин) дает 7-гидрокси-8-йодокумарин. Ацетокси группа может быть введен в гидроксил 7-гидрокси-8-йодокумарина, который используется для создания вагинола или вагинидиола с изопропилом Реактив Гриньяра и коммерчески доступные эпоксидные альдегиды. Последующая катализируемая кислотой фрагментация вагинола с дихлорметан в трифторуксусная кислота дает ангелицин.[15]
Соединение может быть выделено из природных источников, хотя это дает низкий выход из-за преобладания других фуранокумаринов. Популярным методом является сушка на воздухе надземных частей и наземных корней растений с последующей п-экстракция гексаном и колоночная хроматография на силикагеле.[1][16]
Медицинское использование
Производные ангелицина используются для лечения псориаз и рак. Один из способов лечения этих заболеваний - фотохимиотерапия (ПУВА ), который сочетает УФ-облучение с фотосенсибилизирующий химический.[17][18] В большинстве случаев применяется 4,5’-диметилангелицин из-за его прочного связывания и специфичности с ДНК. Также было показано, что он активно подавляет синтез нуклеиновых кислот в опухолевых клетках, тем самым замедляя их рост.[19]
В ПУВА ангелицин менее популярен, чем псорален, хотя оба фуранокумарина обладают фотосенсибилизирующими свойствами и используются в сочетании с длинноволновым УФ-облучением. Ангелицин и псорален используются при других кожных заболеваниях, таких как витилиго и микоз. Фотосвязывание ДНК - наиболее изученный аспект фотобиологии и фотохимии ангелицина. Согласно механизму, ультрафиолетовый свет дальнего действия заставляет ангелцин связываться с пиримидиновыми основаниями ДНК так же, как псорален.[20] Таким образом, ингибирование репликации ДНК за счет образования фотоэлементы может случиться. Это может быть основой для желаемого терапевтического эффекта, как в случае производных псоралена.[17]
Однако при использовании PUVA следует проявлять особую осторожность из-за возможных побочных эффектов. Таким образом, этот тип лечения иногда используется в крайнем случае, вместо него часто используются кортикостероиды.[18] Одним из основных побочных эффектов ПУВА является фототоксичность с чем можно бороться с помощью гетероаналогов ангелицина. Например, недавно исследователи показали, что если фурановое кольцо заменить 1-замещенным пиразол или же тиофен кольцо, новые гетероаналоги ангелицина практически не проявляют фототоксичности.[21]
Взаимодействие с биомолекулами

Было показано, что ангелицин проявляет многостороннее действие на различные биомолекулы, которые происходят из структуры соединения и фотореактивность. Например, планарная структура позволяет ангелицину вставлять между основаниями ДНК. Под воздействием ультрафиолета он подвергается C4-Фотоциклоприсоединение реакция с тимином и цитозином с образованием моноаддукта. Двойные связи ангелицина, участвующие в этой реакции, - это 3,4 и 4 ’, 5’.[22] Однако остальная часть ароматической системы ангелицина не может реагировать с пиримидином комплементарной цепи из-за неблагоприятного расположения реактивных двойных связей.[23] Липиды также подвержены фотоиндуцированным реакциям с ангелицином, которые могут быть аэробными или анаэробными. Аэробные реакции вызывают перекисное окисление липидов. [24] тогда как анаэробный путь приводит к конъюгации ангелицина с цепями ненасыщенных жирных кислот, такими как линоленовая кислота аналогично образованию пиримидиновых аддуктов.[25]

Было продемонстрировано, что белки взаимодействуют с ангелицином нековалентным образом. Например, есть измеримое сродство ангелицина к человеческому сывороточному альбумину (19,10 × 104 моль−1L−1), который имеет один нековалентный сайт связывания на молекулу ангелицина. Ультрафиолетовый свет (365 нм) способствует его ковалентному связыванию с белками, которое усиливается в присутствии кислорода. На этой длине волны ангелицин также может модифицировать определенные аминокислоты.[26][27][28]
Токсичность
Согласно MSDS компании Sigma-Aldrich,[29] в LD50 ангелицина составляет 322 мг / кг, что показывает острую токсичность при пероральном введении крысам. Возможные последствия - изменение циркадный ритм и восстанавливающий рефлекс, атаксия и обезболивание.
Ангелицин проявляет фототоксичность и фотомутагенный эффекты при контакте с кожей. Повышает чувствительность кожи к УФ-излучению. [30] приводит к серьезным повреждениям кожи, таким как эритема и волдыри.[31][32] При облучении УФ-светом с большей длиной волны ангелицин образует моноаддукты ДНК, которые могут вызывать рак кожи.[32] Напротив, некоторые препараты ангелицина, псорален, были в пять-десять раз более активными, чем ангелицин и сшивать ДНК . Это препятствует репликации ДНК в большей степени из-за неспособности двух нитей спирали ДНК разделиться.[33] И псорален, и ангелицин могут использоваться в терапии рака для подавления репликации ДНК в опухолевых клетках и индукции апоптоз - как указано при использовании в медицине - но с ними следует обращаться осторожно, поскольку они могут вызвать фотодерматит в здоровых клетках как побочный эффект.[30][33]
В культурах клеток млекопитающих ангелицин показал мутагенный и цитотоксический эффекты, играя роль сильного ингибитора метаболизма лекарств.[34] Ингибирование связано с тем, что ангелицин снижает активность и экспрессию CYP1A1 который регулируется рецепторы арильных углеводородов (AhR). Для объяснения этого явления предлагаются три гипотезы:[34]
- Ангелицин ослабляет каталитическая активность выполняется CYP1A1 независимо от наличия УФ-излучения.
- Ангелицин вызывает экспрессия гена CYP1A1 путем активации AhR, когда УФ-свет недоступен.
- Ангелицин приводит к экспрессии гена CYP1A1 без участия AhR.
Фототоксические свойства ангелицина проявились благодаря его использованию в качестве природного пестицида и дезинфицирующего средства. Обратите внимание, что трудно легко определить, представляет ли только ангелицин самый высокий риск фототоксичности и фотомутагенности, поскольку у растений ангелицин всегда встречается в смеси с производными ангелицина, псораленом и другими фуранокумаринами. Более того, состав фуранокумаринов большинства видов растений точно не известен, как и токсические свойства некоторых фуранокумаринов.[32]
Рекомендации
- ^ а б c Дехган, Хоссейн; Саррафи, Ягуб; Салехи, Пейман; Эбрахими, Самад Неджад (2017-04-01). «Ингибирующая α-глюкозидазу и антиоксидантная активность фуранокумаринов из Heracleum persicum». Медицинские химические исследования. 26 (4): 849–855. Дои:10.1007 / s00044-017-1796-у. ISSN 1054-2523. S2CID 31293666.
- ^ а б «Биобайт». www.biobyte.com. Получено 2018-03-15.
- ^ Бордин, Ф .; Dall'Acqua, F .; Гайотто, А. (декабрь 1991 г.). «Ангелицины, угловые аналоги псораленов: химия, фотохимические, фотобиологические и фототерапевтические свойства». Фармакология и терапия. 52 (3): 331–363. Дои:10.1016 / 0163-7258 (91) 90031-G. ISSN 0163-7258. PMID 1820581.
- ^ Бёме, Хорст; Северин, Теодор (1957). "Optische Untersuchungen an Cumarinen Mitteilung: Die Ultraviolettabsorption einiger Cumarine pflanzlicher Herkunft". Archiv der Pharmazie. 290 (10): 486–494. Дои:10.1002 / ardp.19572901010. ISSN 1521-4184. PMID 13471015. S2CID 84020911.
- ^ Ленкович, Майя; Кабриджан, Лев; Грубер, Франьо; Сафтич, Марина; Станич Згомбич, Зринка; Стасич, Адальберт; Пехарда, Весна (октябрь 2008 г.). «Фитофотодерматит в районе Риеки, Хорватия». Collegium Antropologicum. 32 Дополнение 2: 203–205. ISSN 0350-6134. PMID 19138025.
- ^ «Использование травы Анжелики, польза для здоровья и побочные эффекты». Травяной ресурс. Получено 2018-03-16.
- ^ «Борщевик гигантский: новый вклад в понимание этого растения в Великобритании». Доктор М. сходит с ума. 2014-01-09. Получено 2018-03-16.
- ^ Стек, Уоррен; Бейли, Б. К. (1969). «Листовые кумарины Анжеликаархангелики». Канадский химический журнал. 47 (13): 2425–2430. Дои:10.1139 / v69-396.
- ^ Ashwood-Smith, M.J .; Grant, E.L .; Heddle, J.A .; Фридман, Г. (1977-06-01). «Повреждение хромосом в клетках китайского хомячка, чувствительных к ближнему ультрафиолетовому свету псораленом и ангелицином». Мутационные исследования / Фундаментальные и молекулярные механизмы мутагенеза. 43 (3): 377–385. Дои:10.1016/0027-5107(77)90059-8. ISSN 0027-5107. PMID 561302.
- ^ а б Боннер, Джеймс; Варнер, Дж. Э. (29 июля 2016 г.). Биохимия растений. Эльзевир. ISBN 9781483267807.
- ^ а б Иаков, Клаус; Кирш, Гилберт; Слюсаренко, Алан; Winyard, Paul G .; Буркхольц, Торстен (25 ноября 2014 г.). Последние достижения в области редокс-активных растительных и микробных продуктов: от базовой химии до широкого применения в медицине и сельском хозяйстве. Springer. ISBN 9789401789530.
- ^ а б Арнольд, J.W.E. (1976). Биология растительных фенолов. 4. Биохимическое образование.
- ^ а б c Ларбат, Ромен; Хен, Ален; Ганс, Иоахим; Шнайдер, Сара; Жугде, Элен; Шнайдер, Бернд; Матерн, Ульрих; Бурго, Фредерик (20 февраля 2009 г.). «Выделение и функциональная характеристика CYP71AJ4, кодирующего первую монооксигеназу P450 биосинтеза углового фуранокумарина» (PDF). Журнал биологической химии. 284 (8): 4776–4785. Дои:10.1074 / jbc.M807351200. ISSN 0021-9258. PMID 19098286. S2CID 33058404.
- ^ Станек, Фолькер; Боланд, Вильгельм (1998-09-09). "Биосинтез угловых фуранокумаринов: механизм и стереохимия окислительного деалкилирования колумбианетина до ангелицина в Heracleum mantegazzianum (Apiaceae)". Helvetica Chimica Acta. 81 (9): 1596–1607. Дои:10.1002 / (SICI) 1522-2675 (19980909) 81: 9 <1596 :: AID-HLCA1596> 3.0.CO; 2-F.
- ^ а б c d Цзоу, Йефен; Лобера, Мерседес; Снайдер, Барри Б. (2005-03-04). «Синтез 2,3-дигидро-3-гидрокси-2-гидроксилалкилбензофуранов из эпоксиальдегидов. Одностадийный синтез бросимакутина G, вагинидиола, вагинола, смириндиола, ксантоарнола и авиценола А. Биомиметические синтезы ангеленицина и псора». Журнал органической химии. 70 (5): 1761–1770. Дои:10.1021 / jo047974k. ISSN 0022-3263. PMID 15730299.
- ^ Шульц, Э. Э .; Ганбаатар, Ж; Петрова, Т. Н .; Шакиров, М. М .; Багрянская, И.Ю .; Тараскин, В. В .; Раднаева, Л.Д .; Отгонсурен, Д .; Покровский, А.Г. (01.05.2012). «Растительные кумарины. IX. * Фенольные соединения Ferulopsis hystrix, произрастающие в Монголии. Цитотоксическая активность 8,9-дигидрофурокумаринов». Химия природных соединений. 48 (2): 211–217. Дои:10.1007 / s10600-012-0207-3. ISSN 0009-3130. S2CID 46726721.
- ^ а б Янг, А. Р. (июнь 1990 г.). «Фотоканцерогенность псораленов, используемых в лечении PUVA: текущий статус у мышей и людей». Журнал фотохимии и фотобиологии. B, Биология. 6 (1–2): 237–247. Дои:10.1016 / 1011-1344 (90) 85093-С. ISSN 1011-1344. PMID 2121937.
- ^ а б Мац, Хагит (январь 2010 г.). «Фототерапия псориаза: что выбрать и как применять: факты и разногласия». Клиники дерматологии. 28 (1): 73–80. Дои:10.1016 / j.clindermatol.2009.04.003. ISSN 1879-1131. PMID 20082955.
- ^ Бордин, Ф .; Carlassare, F .; Baccichetti, F .; Guiotto, A .; Rodighiero, P .; Vedaldi, D .; Далл Аква, Ф. (1 июня 1979 г.). «4,5'-Диметилангелицин: новый монофункциональный агент, связывающий ДНК *». Фотохимия и фотобиология. 29 (6): 1063–1070. Дои:10.1111 / j.1751-1097.1979.tb07821.x. ISSN 1751-1097. PMID 388472.
- ^ Dall'Acqua, F .; Тербоевич, М .; Marciani, S .; Vedaldi, D .; Речер, М. (1978-04-01). «Исследование темного взаимодействия между фурокумаринами и ДНК». Химико-биологические взаимодействия. 21 (1): 103–115. Дои:10.1016/0009-2797(78)90071-6. ISSN 0009-2797. PMID 566637.
- ^ Mosti, L .; Lo Presti, E .; Menozzi, G .; Marzano, C .; Baccichetti, F .; Falcone, G .; Filippelli, W .; Пиуччи, Б. (август 1998 г.). «Синтез гетероаналогов ангелицина: предварительные фотобиологические и фармакологические исследования». Фармако (Societa Chimica Italiana: 1989). 53 (8–9): 602–610. Дои:10.1016 / S0014-827X (98) 00076-7. ISSN 0014-827X. PMID 10081825.
- ^ а б Caffieri, S .; Lucchini, V .; Rodighiero, P .; Miolo, G .; Далл'Аква, Ф. (ноябрь 1988 г.). «3,4 и 4 ', 5'-фотоциклоаддукты между 4'-метилангелицином и тимином из ДНК». Фотохимия и фотобиология. 48 (5): 573–577. Дои:10.1111 / j.1751-1097.1988.tb02866.x. ISSN 0031-8655. PMID 3241830.
- ^ Dall'Acqua, F .; Marciani, S .; Ciavatta, L .; Родигиеро, Г. (1971). «Образование межцепочечных сшивок в фотореакциях между фуранокумаринами и ДНК». Zeitschrift für Naturforschung B. 26 (6): 561–569. Дои:10.1515 / znb-1971-0613. PMID 4397973.
- ^ Dall'Acqua, F .; Мартелли, П. (февраль 1991 г.). «Фотосенсибилизирующее действие фурокумаринов на компоненты мембраны и последующие внутриклеточные события». Журнал фотохимии и фотобиологии. B, Биология. 8 (3): 235–254. Дои:10.1016 / 1011-1344 (91) 80082-С. ISSN 1011-1344. PMID 1904925.
- ^ а б Caffieri, S .; Дага, А .; Vedaldi, D .; Далл'Акуа, Ф. (1988-12-01). «Фотодобавка ангелицина к метиловому эфиру линоленовой кислоты». Журнал фотохимии и фотобиологии B: Биология. 2 (4): 515–521. Дои:10.1016/1011-1344(88)85080-2. ISSN 1011-1344. PMID 3150003.
- ^ Веронезе, FM; Bevilacqua, R; Скьявон, О; Родигиеро, Г. (1979). «Лекарственное взаимодействие с белками: связывание фурокумаринов с белками плазмы». Il Farmaco; Edizione Scientifica. 34 (8): 716–25. ISSN 0430-0920. PMID 467637.
- ^ Veronese, F.M .; Schiavon, O .; Bevilacqua, R .; Бордин, Ф .; Родигиеро, Г. (1982-07-01). «Фотоинактивация ферментов линейными и угловыми фурокумаринами». Фотохимия и фотобиология. 36 (1): 25–30. Дои:10.1111 / j.1751-1097.1982.tb04335.x. ISSN 1751-1097. PMID 6287507.
- ^ Veronese, F.M .; Schiavon, O .; Bevilacqua, R .; Бордин, Ф .; Родигиеро, Г. (1981-09-01). «Влияние псораленов и ангелицинов на белки в присутствии УФ-излучения». Фотохимия и фотобиология. 34 (3): 351–354. Дои:10.1111 / j.1751-1097.1981.tb09369.x. ISSN 1751-1097. PMID 7280051.
- ^ «Паспорт безопасности материала» (PDF). Сигма-Олдрич.
- ^ а б Э. Горгус, К. Лор, Н. Ракет, С. Гут и Д. Шренк. Лиметтин и фурокумарины в напитках, содержащих соки или экстракты цитрусовых. Пищевая и химическая токсикология, 48 (1): 93–98, 2010.
- ^ Б. В. Давыдов А. Я. Потапенко, В. Л. Сухоруков. Сравнение фотосенсибилизирующей активности кожи 8-метоксипсоралена и ангелицина. Experientia 40, страницы 264–265, 1982.
- ^ а б c Кристиан Лор, Николь Раке и Дитер Шренк. Применение концепции относительной фотомутагенной активности к выбранным фурокумаринам в клетках V79. Токсикология in vitro, 24 (2): 558–566, 2010.
- ^ а б Элли, Аманда (август 1987 г.). «Пастернак и фурокумарины». Пищевая и химическая токсикология. 25 (8): 634–635. Дои:10.1016/0278-6915(87)90033-0.
- ^ а б Баумгарт, Аннетт; Шмидт, Мелани; Шмитц, Ханс-Иоахим; Шренк, Дитер (15 февраля 2005 г.). «Природные фурокумарины как индукторы и ингибиторы цитохрома P450 1A1 в гепатоцитах крыс». Биохимическая фармакология. 69 (4): 657–667. Дои:10.1016 / j.bcp.2004.11.017. PMID 15670584.
