Реакция Аппеля - Appel reaction
| Реакция Аппеля | |
|---|---|
| Названный в честь | Рольф Аппель |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | апелляционная реакция |
| RSC ID онтологии | RXNO: 0000406 |
В Реакция Аппеля является органическая реакция что превращает алкоголь в алкилхлорид с помощью трифенилфосфин и четыреххлористый углерод.[1] Использование тетрабромид углерода или же бром в качестве источника галогенида будет давать алкилбромиды, тогда как использование четырехиодид углерода, йодистый метил или же йод дает алкилйодиды. Реакция приписывается и названа в честь Рольф Аппель,[2] однако это было описано ранее.[3] Использование этой реакции становится все реже из-за четыреххлористый углерод ограничены Монреальский протокол.
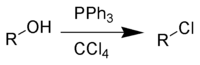
Недостатками реакции являются использование токсичных галогенирующих агентов и совместное производство фосфорорганического продукта, который необходимо отделить от органического продукта.[4] Фосфорный реагент можно использовать в каталитический количества.[5][6] Соответствующий алкилбромид можно также синтезировать путем добавления бромид лития как источник бромид-ионов. Также сообщалось о более экологичной и устойчивой каталитической реакции Аппеля, не содержащей хлорированных растворителей.[7]

Механизм
Реакция Аппеля начинается с образования фосфоний соль 3, который, как считается, существует как плотная ионная пара с 4[8] и поэтому не может пройти альфа-элиминацию, чтобы дать дихлоркарбен. Депротонирование спирта, образуя хлороформ, дает алкоксид 5. В нуклеофильное смещение хлорида алкоксидом дает промежуточное соединение 7. С первичными и вторичными спиртами галогенид реагирует в SN2 процесс образования алкилгалогенида 8 и оксид трифенилфосфина. Третичные спирты образуют продукты 6 и 7 через SN1 механизм.
Движущей силой этой и подобных реакций является образование прочной двойной связи ПО.[9] Реакция чем-то похожа на Мицунобу реакция, где комбинация органофосфин в качестве акцептора оксида азосоединение как реагент-акцептор водорода, и нуклеофил используются для преобразования спиртов в сложные эфиры и других подобных приложений.[10]

Иллюстративным использованием реакции Аппеля является хлорирование гераниол до геранилхлорида.[11]
Модификации
Реакция Аппеля также эффективна при карбоновые кислоты; это было использовано, чтобы преобразовать их в оксазолины, оксазины и тиазолины.[12]
Смотрите также
Рекомендации
- ^ Рольф Аппель (1975). «Третичный фосфан / тетрахлорметан, универсальный реагент для хлорирования, дегидратации и связи P-N». Angewandte Chemie International Edition на английском языке. 14 (12): 801–811. Дои:10.1002 / anie.197508011.
- ^ http://www.chemie.uni-bonn.de/oc/geschichte
- ^ Дауни, я; Холмс, Дж; Ли, Дж (1966). «Получение алкилхлоридов в мягких условиях». Химия и промышленность (22): 900. ISSN 0009-3068.
- ^ Cadogan, J, ed. (1979). Фосфорорганические реагенты в органическом синтезе. Лондон: Academic Press. ISBN 978-0-12-154350-1.
- ^ Дентон, Росс; Ан, Джи; Адениран, Беатрис; Блейк, Александр; Льюис, Уильям; Поултон, Эндрю (2011). "Каталитические реакции нуклеофильного замещения, опосредованные фосфором (V): развитие каталитической реакции Аппеля". Журнал органической химии. 76 (16): 6749–6767. Дои:10.1021 / jo201085r. PMID 21744876.
- ^ van Kalkeren, Henri A .; Leenders, Stefan H.A.M .; Hommersom, C. (Rianne) A .; Rutjes, Floris P. J. T .; ван Делфт, Флорис Л. (2011). "Восстановление оксида фосфина in situ: каталитическая реакция Аппеля". Химия: европейский журнал. 17 (40): 11290–11295. Дои:10.1002 / chem.201101563. PMID 21882274.
- ^ Иордания, Эндрю; Дентон, Росс М .; Снеддон, Хелен Ф. (10 февраля 2020 г.). «Развитие более устойчивой реакции Appel». ACS Устойчивая химия и инженерия. 8 (5): 2300–2309. Дои:10.1021 / acssuschemeng.9b07069.
- ^ Ван, Зеронг (2009). «22: Реакция Аппеля». Исчерпывающие органические названия реакций и реагентов. Хобокен, штат Нью-Джерси: Джон Вили. С. 95–99. Дои:10.1002 / 9780470638859.conrr022. ISBN 9780470638859.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2012-07-22. Получено 2012-07-11.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Смит, Майкл Б .; Марш, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Хосе Г. Кальсада и Джон Хуз. «Геранилхлорид». Органический синтез.; Коллективный объем, 6, п. 634
- ^ Форбрюгген, Гельмут; Кроликевич, Конрад (январь 1993 г.). «Простой синтез Δ2-оксазинов, Δ2-оксазинов, Δ2-тиазолинов и 2-замещенных бензоксазолов». Тетраэдр. 49 (41): 9353–9372. Дои:10.1016 / 0040-4020 (93) 80021-К.

