Азурин - Azurin
| Азурин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Азурин тетрамер, Pseudomonas aeruginosa | |||||||||
| Идентификаторы | |||||||||
| Символ | Медь-связка | ||||||||
| Pfam | PF00127 | ||||||||
| SCOP2 | 5azu / Объем / СУПФАМ | ||||||||
| CDD | cd13922 | ||||||||
| |||||||||
Азурин маленький периплазматический бактериальный синий медный белок нашел в Псевдомонады, Bordetella, или же Алкалигены бактерии. Азурин замедляет одноэлектронный перенос между ферменты связаны с цепью цитохрома, подвергаясь окислению-восстановлению между Cu (I) и Cu (II). Каждый мономер тетрамера азурина имеет молекулярную массу приблизительно 14 кДа, содержит один атом меди, имеет интенсивный синий цвет и имеет полосу излучения флуоресценции с центром при 308 нм.
Азурины и псевдоазурины участвуют в денитрификация процессы в бактериях.,[1] включая грамотрицательные бактерии Синегнойная палочка, за счет взаимодействия с цитохромом c551. Азурин из P aeruginosa это синий тип I медный белок (купредоксин), а цитохром c551 (9 кДа) представляет собой гем -содержащий цитохром. Азурин обладает относительно большим гидрофобным участком рядом с активным центром, и два остатка в этом гидрофобном участке, Met-44 и Met-64, как полагают, участвуют в его взаимодействии с окислительно-восстановительными партнерами. цитохром c551 и нитритредуктаза.[2]
Хотя азурин не связан со свойством переноса электронов, было обнаружено, что он обладает противораковыми свойствами благодаря взаимодействию с белком-супрессором опухолей p53.
Ферментный механизм
В окисленной форме азурин (Cu2+Az) получает электрон от своего окислительно-восстановительного партнера и восстанавливается по следующей реакции:
Cu2+Az + e− -> Cu+Аз
Редокс-потенциал составляет 310 мВ.[3]
Сильно взаимосвязанная бета-листовая структура азурина прочно связана с его центром переноса электронов (стороной, связывающей медь).[4] Существуют значительные экспериментальные данные, позволяющие предположить, что водородные связи играют роль в механизме переноса электронов азурина на большие расстояния. Взятые вместе, эти наблюдения показывают, что электроны туннелируют через фермент по его полипептидным и водородным связям, что делает азурин полезной модельной системой для изучения дальнодействующих внутрибелковых связей. перенос электронов (LRET).[4]
Структура фермента
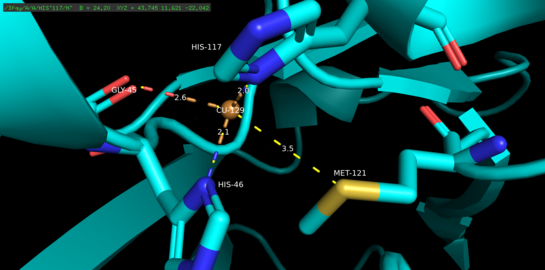
Азурин - тетрамерный белок.[5] Каждый мономер весит приблизительно 14 кДа и состоит из 128 аминокислот, образующих восемь бета-цепей, расположенных в форме бета-цилиндра.[5] Пряди соединены по очереди и одной альфа-спиральной вставкой.[5] Одноатомный сайт связывания меди расположен примерно на 7А ниже поверхности каждого мономера по направлению к его северному концу; Атом меди, который населяет его, координируется пятью лигандами, окруженными обширным гидрофобным пятном.[6]
Три экваториальных медных лиганда состоят из тиолата (Cys112) и двух имидазолов (His46, His 117), а карбонильные атомы кислорода Gly45 и Met121 служат в качестве двух слабых аксиальных лигандов.[5] За исключением Gly45, описанная выше конфигурация связывания меди является общей для структур всех голубых связывающих медь белков типа 1, определенных к настоящему времени.[7] После согласования комплекс лиганд-металл принимает искаженное, тригонально-бипирамидальный геометрия, которая стабилизирует восстановленное состояние протеина одновалентной (Cu (I)) по сравнению с окисленным состоянием двухвалентной меди (Cu (II)).[5] Структурно наложенный обратная связь между d-орбиталями меди и p-орбиталями лиганда может дополнительно стабилизировать медистое состояние.[8]
Существующая структурная информация об азурине в значительной степени получена из исследований рентгеновской кристаллографии односайтовых мутированных форм белка. Примечательные структурные особенности, выясненные кристаллографией, включают мотив бета-сэндвича, образованный из восьми взаимосвязанных бета-цепей,[5] а также альфа-спиральный сегмент за пределами цилиндра, связывающий бета-листы 4 и 5.[5]
Хотя окислительно-восстановительный потенциал Cu (I) / Cu (II) обычно выше для азурина, чем для большинства других комплексов меди, структурные исследования, в которых заменен Met121 (один из экваториальных координирующих медь лигандов азурина), показали, что отсутствие тиолата меди. лиганд не препятствует высоким потенциалам восстановления, поскольку большие гидрофобные остатки в положении 121 также повышают окислительно-восстановительный потенциал атома меди.[8] Таким образом, более высокие окислительно-восстановительные потенциалы были приписаны исключению воды из участка связывания металла, условию, усиленному наличием объемных гидрофобных остатков.[8]
И наоборот, отрицательно заряженные остатки снижают окислительно-восстановительный потенциал, так как они стабилизируют более положительно заряженную медную форму иона меди.[8]
Биологическая функция
Когда азурин экспрессируется в азотфиксирующих организмах, он служит донором электронов для нитритредуктаза, фермент в денитрификация путь азотный цикл.[9]
Поддержка Azurins окислительное дезаминирование первичных аминов, проходя электроны от ароматических аминдегидрогеназа к цитохромоксидаза, а также от некоторых с-типа цитохромы к нитритредуктазам.[10]
Актуальность болезни
Азурин привлек значительное внимание как потенциальное средство для лечения различных заболеваний, включая рак.[11] In vivo было продемонстрировано, что он вызывает регрессию меланомы человека и ткани рака груди с минимальным токсическим воздействием на организм.[11]
Азурин предпочтительно проникает в раковые клетки через домен p28 фермента, который примерно соответствует протяженной альфа-спиральной области фермента.[11] В раковых клетках азурин комплексы с p53, стабилизируя его и предотвращая ассоциацию с E3 уиквитинлигазы, которые в противном случае свяжут белок и пометят его для разрушения.[12] Четыре молекулы азурина связывают каждый мономер р53 с высоким сродством.[12] Комплекс p53 / азурин перемещается в ядро, где p53 активирует транскрипцию проапоптотических генов. Bax и Нокса.[12] P53 также активирует экспрессию ингибиторов клеточного цикла, препятствуя развитию опухолевых клеток за пределы G1 или S-фаза.[12] Хотя этот путь играет важную роль в противоопухолевой активности азурина, детали взаимодействия между азурином и p53 до конца не изучены.
Клиническое испытание фазы I в США продемонстрировало эффекты как частичной, так и полной регрессии опухоли у пятнадцати пациентов с раком стадии IV, получавших аминокислотный фрагмент p28 азурина.[13] Другое испытание фазы I с фрагментом p28 продемонстрировало терапевтические эффекты азурина в отношении педиатрических пациентов с опухолями головного мозга; впоследствии USFDA одобрило обозначение p28 как орфанного препарата для глиома.[14]
Другие домены азурина также могут проявлять сильную противораковую активность за счет связывания с рецептором клеточной поверхности. тирозинкиназы такие как рецепторы EphB2, которые вызывают ангиогенез в раковых клетках.[14] Это еще один механизм, с помощью которого азурин может проявлять свои терапевтические эффекты.
Смотрите также
Рекомендации
- ^ Де Риенцо Ф., Габдуллин Р.Р., Мензиани М.С., Уэйд Р.К. (август 2000 г.). «Белки голубой меди: сравнительный анализ свойств их молекулярного взаимодействия». Белковая наука. 9 (8): 1439–54. Дои:10.1110 / пс. 9.8.1439. ЧВК 2144732. PMID 10975566.
- ^ Ямада Т., Гото М., Пундж В., Заборина О., Кимбара К., Дас Гупта Т.К., Чакрабарти А.М. (декабрь 2002 г.). «Бактериальный окислительно-восстановительный белок азурин индуцирует апоптоз в макрофагах J774 за счет образования комплекса и стабилизации белка-супрессора опухолей р53». Инфекция и иммунитет. 70 (12): 7054–62. Дои:10.1128 / IAI.70.12.7054-7062.2002. ЧВК 133031. PMID 12438386.
- ^ ван ден Бош М., Сварт М., Снайдерс Дж. Г., Берендсен Х. Дж., Марк А. Э., Остенбринк С., ван Гунстерен В. Ф., Кантерс Г. В. (апрель 2005 г.). «Расчет окислительно-восстановительного потенциала белка азурина и некоторых мутантов». ChemBioChem. 6 (4): 738–46. Дои:10.1002 / cbic.200400244. PMID 15747387.
- ^ а б Arcangeli C, Bizzarri AR, Cannistraro S (апрель 1999 г.). «Долгосрочное молекулярно-динамическое моделирование азурина меди: структура, динамика и функциональность». Биофизическая химия. 78 (3): 247–57. Дои:10.1016 / S0301-4622 (99) 00029-0. PMID 17030312.
- ^ а б c d е ж грамм Иноуэ Т., Нишио Н., Сузуки С., Катаока К., Кодзума Т., Кай Ю. (июнь 1999 г.). «Определение кристаллической структуры окисленных и восстановленных псевдоазуринов из Achromobacter cycloclastes. Согласованное движение участка меди в окислительно-восстановительных формах с перегруппировкой водородной связи в удаленном гистидине». Журнал биологической химии. 274 (25): 17845–52. Дои:10.1074 / jbc.274.25.17845. PMID 10364229.
- ^ ван де Камп М., Сильвестрини М.С., Брунори М., Ван Бьюмен Дж., Хали ФК, Кантерс Г.В. (ноябрь 1990 г.). «Вовлечение гидрофобного участка азурина в реакции переноса электрона с цитохромом C551 и нитритредуктазой». Европейский журнал биохимии. 194 (1): 109–18. Дои:10.1111 / j.1432-1033.1990.tb19434.x. PMID 2174771.
- ^ Opella SJ, DeSilva TM, Veglia G (апрель 2002 г.). «Структурная биология металлсвязывающих последовательностей». Современное мнение в области химической биологии. 6 (2): 217–23. Дои:10.1016 / S1367-5931 (02) 00314-9. PMID 12039007.
- ^ а б c d Маклафлин М.П., Ретеган М., Билл Э., Пейн TM, Шафат Х.С., Пенья С., Судхамсу Дж., Энсин А.А., Крейн Б.Р., Низ Ф., Голландия, Польша (декабрь 2012 г.). «Азурин как белковый каркас для низкокоординированного негемового участка железа с карманом связывания малых молекул». Журнал Американского химического общества. 134 (48): 19746–57. Дои:10.1021 / ja308346b. ЧВК 3515693. PMID 23167247.
- ^ Виджгенбум Э., Буш Д.Е., Кантерс Г.В. (сентябрь 1997 г.). «Исследования in vivo опровергают обязательную роль азурина в денитрификации у Pseudomonas aeruginosa и показывают, что экспрессия азу находится под контролем rpoS и ANR». Микробиология. 143 (9): 2853–63. Дои:10.1099/00221287-143-9-2853. PMID 9308169.
- ^ Додд Ф. Е., Хаснайн С. С., Хантер В. Н., Абрахам З. Х., Дебенхэм М., Канцлер Г., Элдридж М., Иди Р. Р., Эмблер Р. П., Смит Б. Э. (август 1995 г.). «Доказательства наличия двух различных азуринов в Alcaligenes xylosoxidans (NCIMB 11015): потенциальных доноров электронов для нитритредуктазы». Биохимия. 34 (32): 10180–6. Дои:10.1021 / bi00032a011. PMID 7640272.
- ^ а б c Бернардес Н., Рибейро А.С., Серука Р., Паредес Дж., Фиалью А.М. (март 2011 г.). «Бактериальный белок азурин как новый кандидатный препарат для лечения неизлечимого рака молочной железы». 1-е совещание в Португалии по биомедицинской инженерии: 1–4. Дои:10.1109 / ENBENG.2011.6026047. ISBN 978-1-4577-0522-9.
- ^ а б c d Гао М., Чжоу Дж., Су З., Хуан И. (декабрь 2017 г.). «Бактериальный купредоксин азурин захватывает клеточные сигнальные сети: белок-белковые взаимодействия и терапия рака». Белковая наука. 26 (12): 2334–2341. Дои:10.1002 / pro.3310. ЧВК 5699490. PMID 28960574.
- ^ Варсо М.А., Ричардс Дж. М., Мехта Д., Христов К., Шеффер К., Рэй Бресслер Л., Ямада Т., Маджумдар Д., Кеннеди С. А., Битти С. В., Дас Гупта Т. К. (март 2013 г.). «Первое в своем классе, первое на людях испытание фазы I p28, пептидного ингибитора убиквитинирования p53, не опосредованного HDM2, у пациентов с развитыми солидными опухолями». Британский журнал рака. 108 (5): 1061–70. Дои:10.1038 / bjc.2013.74. ЧВК 3619084. PMID 23449360.
- ^ а б Чаудхари А., Махфуз М., Фиалхо А.М., Ямада Т., Гранджа А.Т., Чжу Й., Хашимото В., Шларб-Ридли Б., Чо В., Дас Гупта Т.К., Чакрабарти А.М. (февраль 2007 г.). «Взаимосвязь купредоксина и рака: связывание азурина с EphB2, вмешательство в фосфорилирование тирозина EphB2 и ингибирование роста рака». Биохимия. 46 (7): 1799–810. Дои:10.1021 / bi061661x. PMID 17249693.
