Бета-пептид - Beta-peptide
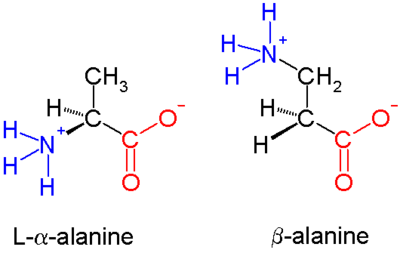
β-пептиды состоят из β-аминокислот, которые имеют свои аминогруппа связаны с β углерод а не α-углерод, как в 20 стандартных биологических аминокислоты. Единственная обычная встречающаяся в природе β-аминокислота - это β-аланин; Хотя он используется как компонент более крупных биологически активных молекул, β-пептиды в целом не встречаются в природе. По этой причине антибиотики на основе β-пептидов исследуются как способы избежать устойчивость к антибиотикам. Ранние исследования в этой области были опубликованы в 1996 г. Дитер Зеебах[1] и Сэмюэля Геллмана.[2]
Химическая структура и синтез
В α-аминокислотах (молекула слева) обе карбоновая кислота группа (красная) и амино- группа (синяя) связана с одним и тем же углеродным центром, называемым α-углеродом (), потому что он находится на расстоянии одного атома от карбоксилатной группы. В β-аминокислотах аминогруппа связана с β-углеродом (), который содержится в большинстве из 20 стандартных аминокислот. Только глицин в нем отсутствует β-углерод, что означает, что β-глицин невозможен.
Химический синтез β-аминокислот может быть сложной задачей, особенно с учетом разнообразия функциональные группы связан с β-углеродом, и необходимость поддержания хиральность. в аланин молекула показана, β-углерод является ахиральным; однако большинство более крупных аминокислот имеют хиральный атом. Был введен ряд механизмов синтеза для эффективного образования β-аминокислот и их производных.[3][4] особенно те, которые основаны на Синтез Арндта-Эйстера.
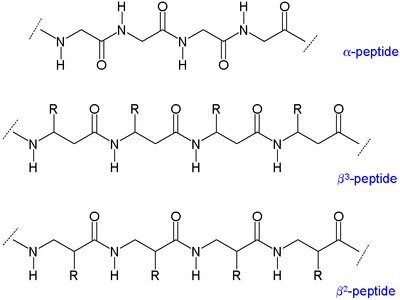
Существует два основных типа β-пептидов: те, у которых есть органический остаток (R) рядом с амином, называются β-пептидами.3-пептиды и пептиды, расположенные рядом с карбонильной группой, называются β2-пептиды.[5]
Вторичная структура
Поскольку скелеты β-пептидов длиннее, чем у пептиды которые состоят из α-аминокислот, β-пептиды образуют разные второстепенные конструкции. В алкил заместители в обоих положениях α и β в β-аминокислоте благоприятствуют грубая форма о связи между α-углеродом и β-углеродом. Это также влияет на термодинамическую устойчивость конструкции.
Сообщалось о многих типах спиральных структур, состоящих из β-пептидов. Эти типы конформации различаются количеством атомов в водородная связь кольцо, которое образуется в растворе; Сообщалось о 8-спиралях, 10-спиралях, 12-спиралях, 14-спиралях и 10/12 спиралях. Вообще говоря, β-пептиды образуют более стабильную спираль, чем α-пептиды.[6]
Клинический потенциал
β-пептиды устойчивы к протеолитическая деградация in vitro и in vivo, важное преимущество перед природными пептидами при приготовлении препаратов на основе пептидов.[7] β-пептиды использовались для имитации природных пептидных антибиотиков, таких как магайнины, которые очень эффективны, но их трудно использовать в качестве лекарств, потому что они расщепляются протеолитическими ферментами в организме.[8]
Список
Существует 8 бета-форм: формы аланина, лейцина, лизина, аргинина, глутамата, глутамина, фенилаланина, тирозина.[9] Аспарагиновая кислота рассматривается как бета- и альфа-формы, хотя бета-форма встречается в микроцистины.[9]
Смотрите также
Рекомендации
- ^ Зеебах Д., Оверхенд М., Кюнле ФНМ, Мартинони Б., Оберер Л., Хоммель Ю., Видмер Х. (июнь 1996 г.). «β-Пептиды: синтез путем гомологации Arndt-Eistert с сопутствующим пептидным связыванием. Определение структуры с помощью ЯМР и КД-спектроскопии и рентгеновской кристаллографии. Спиральная вторичная структура -гексапептида в растворе и его стабильность по отношению к пепсину». Helvetica Chimica Acta. 79 (4): 913–941. Дои:10.1002 / hlca.19960790402.
- ^ Appella DH, Кристиансон Л.А., Карл Иллинойс, Пауэлл Д.Р., Геллман С.Х. (1996). «β-пептидные фолдамеры: устойчивое образование спирали в новом семействе -аминокислотных олигомеров». Варенье. Chem. Soc. 118 (51): 13071–2. Дои:10.1021 / ja963290l.
- ^ Basler B, Schuster O, Bach T (ноябрь 2005 г.). «Конформационно ограниченные производные β-аминокислот путем внутримолекулярного [2 + 2] -фотоциклоприсоединения амида тетроновой кислоты и последующего раскрытия лактонового кольца». J. Org. Chem. 70 (24): 9798–808. Дои:10.1021 / jo0515226. PMID 16292808.
- ^ Мюррей Дж. К., Фаруки Б., Садовски Дж. Д. и др. (Сентябрь 2005 г.). «Эффективный синтез комбинаторной библиотеки β-пептидов с помощью микроволнового излучения». Варенье. Chem. Soc. 127 (38): 13271–80. Дои:10.1021 / ja052733v. PMID 16173757.
- ^ Зеебах Д., Мэтьюз Дж. Л. (1997). «β-Пептиды: сюрпризы на каждом шагу». Chem. Commun. (21): 2015–22. Дои:10.1039 / a704933a.
- ^ Гадеманн К., Хинтерманн Т., Шрайбер СП (октябрь 1999 г.). «Бета-пептиды: скручивание и поворот». Curr. Med. Chem. 6 (10): 905–25. PMID 10519905.
- ^ Беке Т., Сомлай С., Перчел А. (январь 2006 г.). «К рациональному дизайну структур β-пептидов». J Comput Chem. 27 (1): 20–38. Дои:10.1002 / jcc.20299. PMID 16247761.
- ^ Портер Э.А., Вайсблюм Б., Геллман С.Х. (2002). «Мимикрия пептидов защиты хозяина с помощью неестественных олигомеров: антимикробные β-пептиды». Варенье. Chem. Soc. 124 (25): 7324–30. Дои:10.1021 / ja0260871. PMID 12071741.
- ^ а б Энантиоселективный синтез бета-аминокислот Раздел 2.2, Эусебио Хуаристи, Вадим А. Солошонок