Циклогексенон - Википедия - Cyclohexenone
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 2-циклогексенон | |||
| Другие имена 1-циклогекс-2-енон | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| 1280477 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.012.021 | ||
| Номер ЕС |
| ||
| 2792 | |||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C6ЧАС8О | |||
| Молярная масса | 96.129 г · моль−1 | ||
| Внешность | Бесцветная прозрачная жидкость | ||
| Плотность | 0,993 г / мл [1] | ||
| Температура плавления | -53 ° С (-63 ° F, 220 К)[1] | ||
| Точка кипения | От 171 до 173 ° C (от 340 до 343 ° F, от 444 до 446 K)[1] | ||
| 41,3 г / л (25 ℃) | |||
| Опасности | |||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| H226, H301, H310, H319, H330, H331 | |||
| P210, P233, P240, P241, P242, P243, P260, P261, P262, P264, P270, P271, P280, P284, P301 + 310, P302 + 350, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P311, P320, P321, P322, P330 | |||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 220 мг кг−1 (крыса, орально) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Циклогексенон является органическое соединение который является универсальным промежуточным продуктом, используемым в синтез различных химических продуктов, таких как фармацевтические препараты и ароматизаторы.[2] Это бесцветная жидкость, но коммерческие образцы часто бывают желтыми.
В промышленности циклогексенон получают из фенол к Сокращение березы.[3]
Циклогексенон - это кетон, а точнее Enone. Общие реакции включают: добавление нуклеофильного конъюгата с медьорганические реагенты, Майкл реакции и Аннуляции Робинсона.[4][5]
Синтез
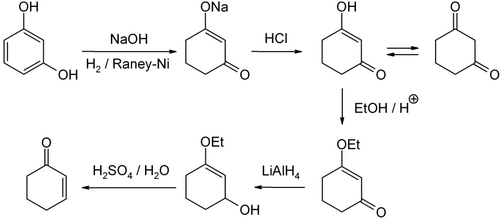
Существует несколько путей производства циклогексенона. Для лабораторных масштабов он может быть изготовлен из резорцин через 1,3-циклогександион.[6]
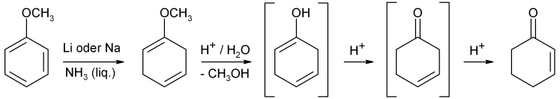
Циклогексенон получают Сокращение березы из анизол с последующим кислотным гидролизом.
Его можно получить из циклогексанона путем α-бромирования с последующей обработкой основанием. Еще один путь - гидролиз 3-хлорциклогексена с последующим окислением циклогексенола.
Циклогексенон получают в промышленности путем каталитического окисления циклогексена, например, с помощью пероксид водорода и ванадий катализаторы. В нескольких патентах описываются различные окислители и катализаторы.
Реакции
Циклогексенон является широко используемым строительным блоком в химии органического синтеза, поскольку он предлагает множество различных способов расширения молекулярных каркасов.
Как Enone, циклогексенон легко адаптируется к Майкл дополнение с нуклеофилами (такими как енолирует или эфиры силил енола), или он может быть использован Реакция Дильса-Альдера с электронно-богатым диены. Кроме того, это соединение реагирует с медноорганические соединения от 1,4-присоединения (присоединение Михаэля) или с реактивами Гриньяра 1,2-присоединение, т.е. с атакой нуклеофила по карбонильному атому углерода. Циклогексенон также используется в многостадийном синтезе при создании полициклических природных продуктов. Это прохирально.
При сильных основаниях позиции 4 и 6 (два CH2-группы карбонильной группы и соседней двойной связи C-C) депротонированы.
Циклогексенон является in vitro катализатор для относительно мягкого декарбоксилирование из альфа-аминокислоты.[7] [8]
Рекомендации
- ^ а б c Циклогексенон в Сигма-Олдрич
- ^ Подразе, К.Ф. Орг. Prep. Процедуры. Int., 1991, 23, с. 217.
- ^ Органические строительные блоки химической промышленности, Гарри Х. Шмант, ISBN 978-0-471-85545-3
- ^ Майкл Г. Орган и Пол Андерсон (1996). «Карбонильные и конъюгированные добавки к циклогексенону: эксперименты, иллюстрирующие избирательность реагентов». Журнал химического образования. 73 (12): 1193. Дои:10.1021 / ed073p1193.
- ^ Tetrahedron Lett. 34, 3881, (1993)
- ^ Р. Б. Томпсон (1947). «Дигидрорезорцин». Органический синтез. 27: 21. Дои:10.15227 / orgsyn.027.0021.
- ^ Исследователи в Японии пытались использовать трет-бутилпероксид в качестве катализатора декарбоксилирования с использованием растворителя на выбор циклогексанол. Любопытно, что они обнаружили, что при использовании циклогексанола низкой чистоты (например, 98% технической чистоты) реакция протекала в 4 раза быстрее, чем при использовании относительно чистого циклогексанола (> 99,3%). Они обнаружили, что циклогексанол содержит циклогексенон в качестве естественной примеси, которой в три раза больше в циклогексеноне технической чистоты по сравнению с более очищенным циклогексанолом (~ 0,3% против ~ 0,1%). Дальнейшие исследования показали, что 1% циклогексенона в циклогексаноле декарбоксилирует большинство альфа-аминокислот, в том числе нестандартные, с выходом 80-95% в течение нескольких часов. Исключение составляют некоторые аминокислоты, например гистидин, который, как сообщалось, занимает более 26 часов, и полиаминокислоты, которые не могут декарбоксилировать с использованием 2-циклогексенона, и вместо этого необходимо найти другой путь.Хашимото, М; Еда, Y; Ясутомо, О; Тошиаки, я; Аоки, S (1986). «Новое декарбоксилирование альфа-аминокислот. Простой метод декарбоксилирования с использованием 2-циклогексен-1-она в качестве катализатора». Письма по химии. 15 (6): 893–896. Дои:10.1246 / кл.1986.893. Получено 4 января 2016.
- ^ Лаваль, G; Голдинг, Б. (2003). «Последовательность в одном горшке для декарбоксилирования α-аминокислот». Synlett (4): 542–546. Дои:10.1055 / с-2003-37512. Получено 4 января 2016.