Дитиотреитол - Dithiothreitol
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC (2S,3S) -1,4-бис (сульфанил) бутан-2,3-диол | |
| Другие имена (2S,3S) -1,4-Димеркаптобутан-2,3-диол D-трео-1,4-димеркаптобутан-2,3-диол D-трео-1,4-димеркапто-2,3-бутандиол 1,4-дитио-D-треитол Реагент Клеланда Редуктакрил | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.020.427 |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| C4ЧАС10О2S2 | |
| Молярная масса | 154,253 г / моль |
| Внешность | Белое твердое вещество |
| Температура плавления | От 42 до 43 ° C (от 108 до 109 ° F, от 315 до 316 K) |
| Точка кипения | От 125 до 130 ° C (от 257 до 266 ° F, от 398 до 403 K) при 2 мм рт. |
| Растворимый | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
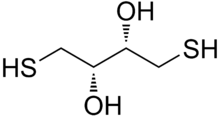
Дитиотреитол (DTT) - общее название небольшой молекулы редокс реагент, также известный как Cleland's реагент.[2] Формула DTT - C4ЧАС10О2S2 и химическая структура одного из энантиомеры в уменьшенном виде показан справа; его окисленная форма представляет собой дисульфидная связь 6-членное кольцо (показано ниже). Реагент обычно используется в его рацемической форме, так как оба энантиомера реакционноспособны. Его название происходит от четырехуглеродного сахар, треоза. DTT имеет эпимерный ('сестра') соединение, дитиоэритрит (DTE).
Восстановитель
DTT - это Восстановитель; после окисления он образует стабильное шестичленное кольцо с внутренним дисульфидная связь. Он имеет окислительно-восстановительный потенциал -0,33 В при pH 7.[1] Восстановление типичной дисульфидной связи происходит двумя последовательными тиол-дисульфидный обмен реакции и проиллюстрировано ниже. Восстановление обычно не останавливается на смешанных дисульфидных соединениях, потому что второй тиол DTT имеет высокую склонность закрывать кольцо, образуя окисленный DTT и оставляя восстановленный дисульфидная связь. Снижающая способность DTT ограничена значениями pH выше 7, поскольку только отрицательно заряженные тиолат форма -S− является реактивным (протонированный тиол форма -SH нет); в pKa тиоловых групп составляет 9,2 и 10,1.

Приложения
DTT используется в качестве восстанавливающего или «снимающего защиту» агента для тиолированной ДНК. Концевые атомы серы тиолированного ДНК имеют тенденцию образовывать димеры в растворе, особенно в присутствии кислорода. Димеризация значительно снижает эффективность последующих реакций связывания, таких как иммобилизация ДНК на золоте в биосенсорах. Обычно DTT смешивают с раствором ДНК и оставляют реагировать, а затем удаляют фильтрацией (для твердого катализатора) или хроматография (для жидкой формы). Процедуру удаления DTT часто называют «обессоливанием». Как правило, DTT используется в качестве защитного агента, предотвращающего окисление тиоловые группы.
DTT часто используется для уменьшения дисульфидные связи из белки и, в более общем плане, для предотвращения внутримолекулярный и межмолекулярный дисульфидные связи от образования между цистеин остатки белков. Однако даже DTT не может восстанавливать скрытые (недоступные для растворителя) дисульфидные связи, поэтому восстановление дисульфидных связей иногда проводят при денатурирующие условия (например, при высоком температуры, или в присутствии сильного денатуранта, такого как 6 M гуанидин хлорид, 8 м мочевина, или 1% додецилсульфат натрия ). DTT часто используется вместе с додецилсульфатом натрия в SDS-СТРАНИЦА для дальнейшей денатурации белков за счет уменьшения их дисульфидных связей, чтобы обеспечить лучшее разделение белков во время электрофорез. Из-за способности уменьшать дисульфидные связи, DTT можно использовать для денатурирования CD38 на красных кровяных тельцах. И наоборот, воздействие растворителя на различные дисульфидные связи можно оценить по скорости их восстановления в присутствии DTT.
DTT также может использоваться как окислитель. Его главное преимущество состоит в том, что практически не заселяются никакие смешанные дисульфидные виды, в отличие от других агентов, таких как глутатион. В очень редких случаях DTT аддукт могут образовываться, т.е. два атома серы DTT могут образовывать дисульфидные связи к разным атомам серы; в таких случаях DTT не может циклизоваться, поскольку в нем нет таких оставшихся свободных тиолов.
Свойства
ДТТ нестабилен в окружающих атмосферных условиях, так как окисляется кислородом; DTT следует хранить и обрабатывать в среде инертных газов, чтобы предотвратить окисление. Срок годности дитиотреитола можно продлить при охлаждении до 2–8 ° C.[3] Окисление представляет дополнительные осложнения, поскольку окисленный DTT показывает сильный пик поглощения при 280 нм. Поскольку тиолы менее нуклеофильны, чем их конъюгированные основания, тиолаты, DTT становится менее мощным нуклеофилом при падении pH. (2S) -2-амино-1,4-димеркаптобутан (дитиобутиламин или DTBA) представляет собой новый агент, восстанавливающий дитиол, который в некоторой степени преодолевает это ограничение DTT.[4] Трис (2-карбоксиэтил) фосфин (TCEP ) является альтернативным восстанавливающим агентом, который более стабилен и эффективен при низком pH, но объемный и медленно восстанавливает цистины в свернутых белках.[5]
Период полувыведения DTT составляет 40 часов при pH 6,5 и 1,4 часа при pH 8,5 и 20 ° C; его период полураспада дополнительно уменьшается при повышении температуры. Наличие EDTA (этилендиаминтетрауксусная кислота) для хелатирования ионов двухвалентных металлов (Fe2+, Cu2+ и др.) значительно увеличивает период полураспада ДТТ в растворе.[6]
использованная литература
- ^ а б М.Дж. О'Нил, изд. автор: (2001). Индекс Мерк: энциклопедия химикатов, лекарств и биологических препаратов: 13-е изд. (13. ред.). США: MERCK & CO INC. ISBN 0-911910-13-1.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Cleland, W. W. (1964). «Дитиотреитол - новый защитный реагент для SH-групп». Биохимия. 3 (4): 480–482. Дои:10.1021 / bi00892a002. PMID 14192894.
- ^ "Индекс NLM PubChem CID", Справочник по витамину D, John Wiley & Sons, Inc., стр. 239–244, 2007 г., Дои:10.1002 / 9780470238165.indsp1, ISBN 978-0-470-23816-5
- ^ Lukesh, III, J.C .; Palte, M. J .; Рейнс, Р. Т. (2012). «Мощный универсальный восстановитель из аспарагиновой кислоты». Журнал Американского химического общества. 134 (9): 4057–4059. Дои:10.1021 / ja211931f. ЧВК 3353773. PMID 22353145.
- ^ Cline, D. J .; Redding, S.E .; Brohawn, S.G .; Psathas, J. N .; Schneider, J. P .; Торп, К. (2004). «Новые водорастворимые фосфины как восстановители дисульфидных связей пептидов и белков: реакционная способность и проницаемость мембран». Биохимия. 43 (48): 15195–15203. Дои:10.1021 / bi048329a. PMID 15568811.
- ^ Стивенс, Р.; Стивенс, L; Price, N.C (1983) Стабильность различных тиоловых соединений, используемых при очистке белков. Биохимическое образование, 11 (2), 70. Дои:10.1016/0307-4412(83)90048-1
внешние ссылки
 СМИ, связанные с Дитиотреитол в Wikimedia Commons
СМИ, связанные с Дитиотреитол в Wikimedia Commons
