Гласдегиб - Википедия - Glasdegib
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Даурисмо |
| Другие имена | PF-04449913 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a619004 |
| Беременность категория |
|
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.244.738 |
| Химические и физические данные | |
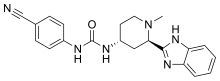
| Формула | C21ЧАС22N6О |
| Молярная масса | 374.448 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Гласдегиб, продается под торговой маркой Даурисмо, представляет собой лекарство для лечения впервые диагностированного острого миелоидного лейкоза (ОМЛ) у взрослых старше 75 лет или тех, у кого есть сопутствующие заболевания, препятствующие использованию интенсивной индукционной химиотерапии.[3][4] Его принимают внутрь и используют в сочетании с низкими дозами. цитарабин.[4]
Рекомендуемая доза гласдегиба составляет 100 мг перорально один раз в день в дни с 1 по 28 в сочетании с цитарабином 20 мг подкожно два раза в день в дни с 1 по 10 каждого 28-дневного цикла при отсутствии неприемлемой токсичности или потери контроля над заболеванием.[4]
Наиболее частыми побочными реакциями являются анемия, усталость, кровотечение, фебрильная нейтропения, скелетно-мышечная боль, тошнота, отек, тромбоцитопения, одышка, снижение аппетита, дисгевзия, мукозит, запор и сыпь.[3]
Это низкомолекулярный ингибитор звуковой еж, который является сверхэкспрессируемым белком при многих типах рака. Подавляет рецептор звукового ежа. сглаженный (SMO), как и большинство препаратов этого класса.[5]
История
Гласдегиб был одобрен для медицинского применения в США в декабре 2018 года.[3][4][6][7]
Одобрение FDA было основано на многоцентровом открытом рандомизированном исследовании (BRIGHT AML 1003, NCT01546038), в которое вошли 115 субъектов с впервые диагностированным ОМЛ, которые соответствовали по крайней мере одному из следующих критериев: а) возраст 75 лет и старше, б) тяжелое сердечное заболевание, c) исходный статус эффективности Восточной кооперативной онкологической группы 2, или d) исходный уровень креатинина сыворотки> 1,3 мг / дл.[3] Субъекты были рандомизированы 2: 1 для получения гласдегиба, 100 мг в день, с LDAC 20 мг подкожно два раза в день в дни с 1 по 10 28-дневного цикла (N = 77) или только LDAC (N = 38) в 28-дневных циклах. до прогрессирования заболевания или неприемлемой токсичности.[3] Испытание проводилось в США, Канаде и Европе.[8]
Эффективность была установлена на основании улучшения общей выживаемости (дата рандомизации до смерти от любой причины).[3] При среднем сроке наблюдения 20 месяцев медиана выживаемости составила 8,3 месяца (95% ДИ: 4,4, 12,2) для группы гласдегиб + LDAC и 4,3 месяца (95% ДИ: 1,9, 5,7) для группы, получавшей только LDAC, а HR 0,46 (95% ДИ: 0,30, 0,71; p = 0,0002).[3]
Гласдегиб получил приоритетный обзор и орфанный препарат обозначение США Управление по контролю за продуктами и лекарствами (FDA).[3][9] Было предоставлено орфанный препарат обозначение Европейское агентство по лекарствам (EMA) в октябре 2017 года.[10]
Гласдегиб был одобрен для медицинского применения в Европейском Союзе в июне 2020 года.[2]
Рекомендации
- ^ «Гласдегиб (Даурисмо) Применение во время беременности». Drugs.com. 14 декабря 2018 г.. Получено 25 марта 2020.
- ^ а б "Даурисмо ЕПАР". Европейское агентство по лекарствам (EMA). 28 апреля 2020 г.. Получено 25 сентября 2020.
- ^ а б c d е ж грамм час «FDA одобряет применение гласдегиба для лечения ОМЛ у взрослых в возрасте 75 лет и старше или с сопутствующими заболеваниями». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 21 ноября 2018 г.. Получено 25 марта 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б c d «Даурисмо-гласдегиб таблетка, покрытая пленочной оболочкой». DailyMed. 26 ноября 2019 г.. Получено 25 марта 2020.
- ^ "Гласдегиб - АдисИнсайт". Adisinsight.springer.com. Получено 2017-05-22.
- ^ «Пакет одобрения лекарственных средств: Даурисмо (гласдегиб)». НАС. Управление по контролю за продуктами и лекарствами (FDA). 17 декабря 2018 г.. Получено 25 марта 2020.
- ^ «Daurismo: лекарства, одобренные FDA». НАС. Управление по контролю за продуктами и лекарствами (FDA). Получено 25 марта 2020.
- ^ "Снимок испытания препарата: Даурисмо". НАС. Управление по контролю за продуктами и лекарствами (FDA). 21 ноября 2018 г.. Получено 25 марта 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Поиск обозначений и одобрений орфанных лекарств». НАС. Управление по контролю за продуктами и лекарствами (FDA). 24 декабря 1999 г.. Получено 25 марта 2020.
- ^ "EU / 3/17/1923". Европейское агентство по лекарствам (EMA). 17 сентября 2018 г.. Получено 25 марта 2020.
внешняя ссылка
- "Гласдегиб". Портал информации о наркотиках. Национальная медицинская библиотека США.
- Номер клинического исследования NCT01546038 для «Исследования по оценке PF-04449913 с химиотерапией у пациентов с острым миелоидным лейкозом или миелодиспластическим синдромом» в ClinicalTrials.gov
| Этот противоопухолевый или же иммуномодулирующий препарат, средство, медикамент статья - это заглушка. Вы можете помочь Википедии расширяя это. |
