MAPK фосфатаза - MAPK phosphatase
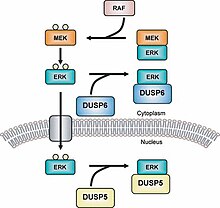
МАРК фосфатазы (МКП) - самый большой класс фосфатазы участвует в понижающем регулировании Митоген-активированные протеинкиназы (MAPK) сигнализация.[1][2] MAPK сигнальные пути регулировать несколько функций разработка и гомеостаз.[3][4] Это может включать регуляцию генов, пролиферацию клеток, запрограммированную гибель клеток и стрессовые реакции.[5] Таким образом, фосфатазы MAPK являются важными регуляторами этих путей.
Функция

Фосфатазы MAPK обнаружены только в эукариоты и негативно регулируют Киназы MAP действовать как отрицательная обратная связь.[5] MKP также известны как фосфатазы с двойной специфичностью (DUSP)[6] потому что они деактивируют MAPK дефосфорилирование то Треонин и Тирозин остатки, находящиеся в сайте активации MAPK.[7] МКП имеют каталитическая область на их C-конец и регулирующий регион на их N-конец.[8] Положение, где MAPK связывается с MKP, находится рядом с N-концом MKP. Привязка происходит из-за электростатические взаимодействия положительно заряженных остатков на участке связывания MKP с отрицательно заряженными остатками на участке связывания MAPK.[9]
Классификация
Есть 10[10] основные MKP, которые можно далее разбить на три подкласса, которые представляют либо их геномная структура или тип субстрат (MAPK) они привязаны к.[11] К ним относятся DUSP1, DUSP2, DUSP4 и DUSP5, которые принадлежат подгруппе 1. DUSP6, DUSP7, DUSP9 и DUSP10 принадлежат к подгруппе 2. DUSP8 и DUSP16 принадлежат к подгруппе 3, эти подгруппы основаны на геномной структуре MKP.[12] Новейший MKP-8 доводит общее количество MKP до 11, MKP-8 играет роль в ингибировании киназы p38.[13]
Фосфатазы с двойной специфичностью (DUSP) также принадлежат к семейству протеинтирозинфосфатазы.[14] MKP делятся на типы I, II и III; в которых МКП типа I расположены в ядерный регион, тип II расположены в цитоплазматический область и тип III расположены как в ядерной, так и в цитоплазматической области.[15] Различное расположение этих трех типов MKP позволяет им вызывать разные типы сигнализации. Например, MKP-1 (тип I MKP) контролирует экспрессию гена путем инактивации субклеточной группы MAPK.[16] Обратите внимание, что без мотива LXXLL (GFP-MKP-147-367) MKP-1 не может локализоваться внутри ядра и предшествует домену CH2A.[17] Новейший MKP, MKP-8, принадлежит к группе I, потому что он расположен в ядерной области клетки.[18] Недавнее исследование показывает, что изоформы гистондеацетилазы (HDAC1, -2 и -3) деацетилат МКП-1 и что это посттрансляционная модификация увеличивает сигнализацию MAPK и врожденный иммунитет сигнализация.[19]
Несмотря на то, что N-концевой регион является совершенно разным между каждым MKP, все они обычно содержат CH2 домены.[20] В MKP-1 MAPK связывается с активным сайтом, который находится между доменами CH2A и CHB, расположенными на N-конце.[21][22]
Примером МКП типа II является МКП-3 который регулирует деятельность ERK2 к депонирование его и удерживая в области цитоплазмы.[23] MKP-3 также связывается с ERK2 независимо от того, фосфорилирован он или нет.[24] MKP-4 - это еще один MKP, который принадлежит к типу I и отличается от других MKP в этой подгруппе, поскольку он обнаружен только в клетках плаценты, почек и эмбриональной печени.[25] МКП-5 представляет собой MKP типа III, который специфически связывается с стр.38 и СПК /JNK и обнаруживается как в цитоплазматической, так и в ядерной областях клетки.[26] MKP-5 находится только в клетках сердца, легких, печени, почек и скелетных мышц.[27]Есть также MKP, которые принадлежат к группе под названием Atypical MKP. Например, Vaccina H1-related (VHR) является атипичным MKP, потому что он имеет только область DUSP.[28] VHR можно найти только в лимфоидный и гемопоэтические клетки, и он деактивирует ERK1 /2 и JNKs в Рецепторы Т-клеток.[29] VHR также вызывает клеточный цикл арестовать.[30][31]
| Имя | Альт. имя | Подгруппа |
|---|---|---|
| DUSP1 | МКП-1 | я |
| DUSP2 | я | |
| DUSP4 | МКП-2 | я |
| DUSP5 | я | |
| DUSP6 | МКП-3 | II |
| DUSP7 | II | |
| DUSP8 | III | |
| DUSP9 | МКП-4 | II |
| DUSP10 | МКП-5 | ? |
| DUSP14 | МКП-6 | ? |
| DUSP16 | МКП-7 | III |
| DUSP26 | МКП-8 | я |
Рекомендации
- ^ МАРК + фосфатазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Дикинсон, Робин Дж .; Кейз, Стивен М. (15 ноября 2006 г.). «Разнообразные физиологические функции фосфатаз киназы МАР с двойной специфичностью». J Cell Sci. 119 (22): 4607–4615. Дои:10.1242 / jcs.03266. PMID 17093265.
- ^ Caunt, Кристофер Дж .; Кейз, Стивен М. (январь 2013 г.). «Фосфатазы киназы MAP с двойной специфичностью (MKP)». Журнал FEBS. 280 (2): 489–504. Дои:10.1111 / j.1742-4658.2012.08716.x. ЧВК 3594966. PMID 22812510.
- ^ Низкий, Хэн Бун; Чжан, Юнлян (2016). «Регуляторная роль MAPK фосфатаз при раке». Иммунная сеть. 16 (2): 85–98. Дои:10.4110 / дюйм 2016.16.2.85. ЧВК 4853501. PMID 27162525.
- ^ а б Чанг, Луфэн; Карин, Майкл (1 марта 2001 г.). «Сигнальные каскады MAP-киназы млекопитающих». Природа. 410 (6824): 37–40. Дои:10.1038/35065000. PMID 11242034.
- ^ Комалада, Моника; Льоберас, Хорхе; Селада, Антонио (1 августа 2012 г.). «MKP-1: критическая фосфатаза в биологии макрофагов, контролирующая переключение между пролиферацией и активацией». Европейский журнал иммунологии. 42 (8): 1938–1948. Дои:10.1002 / eji.201242441. PMID 22865045.
- ^ Кондо, Кунио; Нисида, Эйсуке (1 августа 2007 г.). «Регулирование MAP-киназ с помощью MAP-киназных фосфатаз». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1773 (8): 1227–1237. Дои:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Дикинсон, Робин Дж .; Кейз, Стивен М. (15 ноября 2006 г.). «Разнообразные физиологические функции фосфатаз киназы MAP с двойной специфичностью». J Cell Sci. 119 (22): 4607–4615. Дои:10.1242 / jcs.03266. PMID 17093265.
- ^ Феодосио, Аспасия; Ашворт, Алан (1 января 2002 г.). «МАР киназные фосфатазы». Геномная биология. 3 (7): reviews3009.1 – reviews3009.10. Дои:10.1186 / gb-2002-3-7-reviews3009. ISSN 1465-6906. ЧВК 139386. PMID 12184814.
- ^ Caunt, Кристофер Дж; Кейз, Стивен М. (7 ноября 2016 г.). «Фосфатазы киназы MAP с двойной специфичностью (MKP)». Журнал FEBS. 280 (2): 489–504. Дои:10.1111 / j.1742-4658.2012.08716.x. ISSN 1742-464X. ЧВК 3594966. PMID 22812510.
- ^ Теодосиу, Аспасия; Ашворт, Алан (1 января 2002 г.). «МАР киназные фосфатазы». Геномная биология. 3 (7): reviews3009.1 – reviews3009.10. Дои:10.1186 / gb-2002-3-7-reviews3009. ЧВК 139386. PMID 12184814.
- ^ Феодосио, Аспасия; Ашворт, Алан (1 января 2002 г.). «МАР киназные фосфатазы». Геномная биология. 3 (7): reviews3009.1 – reviews3009.10. Дои:10.1186 / gb-2002-3-7-reviews3009. ЧВК 139386. PMID 12184814.
- ^ Васудеван, Санджив А .; Скоко, Джон; Ван, Куан; Burlingame, Susan M .; Patel, Parul N .; Lazo, John S .; Nuchtern, Jed G .; Ян, Цзяньхуа (6 мая 2005 г.). «MKP-8, новая фосфатаза MAPK, которая ингибирует киназу p38». Сообщения о биохимических и биофизических исследованиях. 330 (2): 511–518. Дои:10.1016 / j.bbrc.2005.03.028. PMID 15796912.
- ^ Джеффри, Кейт Л .; Лагеря, Монтсеррат; Роммель, Кристиан; Маккей, Чарльз Р. (май 2007 г.). «Ориентация на фосфатазы с двойной специфичностью: управление передачей сигналов киназы MAP и иммунными ответами». Обзоры природы Drug Discovery. 6 (5): 391–403. Дои:10.1038 / nrd2289. PMID 17473844.
- ^ Кондо, Кунио; Нисида, Эйсуке (1 августа 2007 г.). «Регулирование MAP-киназ с помощью MAP-киназных фосфатаз». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1773 (8): 1227–1237. Дои:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Wu, J. J .; Zhang, L .; Беннетт А. М. (16 мая 2005 г.). «Некаталитический амино-конец митоген-активированной протеинкиназы фосфатазы 1 направляет ядерное нацеливание и регуляцию транскрипции элемента ответа сыворотки». Молекулярная и клеточная биология. 25 (11): 4792–4803. Дои:10.1128 / MCB.25.11.4792-4803.2005. ЧВК 1140620. PMID 15899879.-
- ^ Wu, J. J .; Zhang, L .; Беннетт А. М. (16 мая 2005 г.). «Некаталитический амино-конец митоген-активированной протеинкиназы фосфатазы 1 направляет ядерное нацеливание и регуляцию транскрипции элемента ответа сыворотки». Молекулярная и клеточная биология. 25 (11): 4792–4803. Дои:10.1128 / MCB.25.11.4792-4803.2005. ЧВК 1140620. PMID 15899879.
- ^ Васудеван, Санджив А .; Скоко, Джон; Ван, Куан; Burlingame, Susan M .; Patel, Parul N .; Lazo, John S .; Nuchtern, Jed G .; Ян, Цзяньхуа (6 мая 2005 г.). «MKP-8, новая фосфатаза MAPK, которая ингибирует киназу p38». Сообщения о биохимических и биофизических исследованиях. 330 (2): 511–518. Дои:10.1016 / j.bbrc.2005.03.028. PMID 15796912.
- ^ Jeong, Y; Ду, Р; Чжу, X (2014). «Изоформы гистон-деацетилазы регулируют врожденный иммунный ответ путем деацетилирования митоген-активируемой протеинкиназы фосфатазы-1». J Leukoc Biol. 95 (4): 651–9. Дои:10.1189 / jlb.1013565. PMID 24374966.
- ^ Wu, JJ; Чжан, Л; Беннетт AM (2005). «Некаталитический амино-конец митоген-активированной протеинкиназы фосфатазы 1 направляет ядерное нацеливание и регуляцию транскрипции элемента ответа сыворотки». Молекулярная и клеточная биология. 25 (11): 4792–4803. Дои:10.1128 / MCB.25.11.4792-4803.2005. ЧВК 1140620. PMID 15899879.
- ^ Wu, J. J .; Zhang, L .; Беннетт А. М. (16 мая 2005 г.). «Некаталитический амино-конец митоген-активированной протеинкиназы фосфатазы 1 направляет ядерное нацеливание и регуляцию транскрипции элемента ответа сыворотки». Молекулярная и клеточная биология. 25 (11): 4792–4803. Дои:10.1128 / MCB.25.11.4792-4803.2005. ЧВК 1140620. PMID 15899879.
- ^ БАРДУЭЛЛ, А. Джейн; АБДОЛЛАХИ, Махса; БАРДУЭЛЛ, Ли (15 марта 2003 г.). «Сайты стыковки митоген-активированных протеинкиназ (MAPK) киназ, MAPK-фосфатаз и фактора транскрипции Elk-1 конкурируют за связывание MAPK и имеют решающее значение для ферментативной активности». Биохимический журнал. 370 (3): 1077–1085. Дои:10.1042 / BJ20021806. ЧВК 1223246. PMID 12529172.
- ^ Карлссон, Мария; Мазерс, Джоанна; Дикинсон, Робин Дж .; Мандл, Маргрет; Кейз, Стивен М. (1 октября 2004 г.). «Как ядерно-цитоплазматическое челночное движение фосфатазы с двойной специфичностью MKP-3, так и его способность закреплять MAP-киназу в цитоплазме опосредуются консервативным сигналом ядерного экспорта». Журнал биологической химии. 279 (40): 41882–41891. Дои:10.1074 / jbc.M406720200. ISSN 0021-9258. PMID 15269220.
- ^ Кэмпс, М. (22 мая 1998 г.). «Каталитическая активация фосфатазы MKP-3 с помощью ERK2-митоген-активированной протеинкиназы». Наука. 280 (5367): 1262–1265. Дои:10.1126 / science.280.5367.1262. PMID 9596579.
- ^ Muda, M .; Boschert, U .; Smith, A .; Antonsson, B .; Gillieron, C .; Chabert, C .; Лагеря, М .; Martinou, I .; Ashworth, A .; Аркинстолл, С. (21 февраля 1997 г.). «Молекулярное клонирование и функциональная характеристика новой митоген-активируемой протеинкиназы фосфатазы, MKP-4». Журнал биологической химии. 272 (8): 5141–5151. Дои:10.1074 / jbc.272.8.5141. PMID 9030581.
- ^ Тануэ, Т. (9 июля 1999 г.). «Молекулярное клонирование и характеристика новой фосфатазы двойной специфичности, MKP-5». Журнал биологической химии. 274 (28): 19949–19956. Дои:10.1074 / jbc.274.28.19949. PMID 10391943.
- ^ Кондо, Кунио; Нисида, Эйсуке (1 августа 2007 г.). «Регулирование MAP-киназ с помощью MAP-киназных фосфатаз». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1773 (8): 1227–1237. Дои:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Кондо, Кунио; Нисида, Эйсуке (1 августа 2007 г.). «Регулирование MAP-киназ с помощью MAP-киназных фосфатаз». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1773 (8): 1227–1237. Дои:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Алонсо, А .; Saxena, M .; Уильямс, S .; Мустелин, Т. (20 ноября 2000 г.). «Ингибирующая роль фосфатазы с двойной специфичностью VHR в рецепторе Т-клеточного антигена и CD28-индуцированной активации Erk и Jnk». Журнал биологической химии. 276 (7): 4766–4771. Дои:10.1074 / jbc.M006497200. PMID 11085983.
- ^ Рахмуни, Суад; Чериньоли, Фабио; Алонсо, Андрес; Цутджи, Тошия; Хенкенс, Рэйчел; Чжу, Чанцзюнь; Луи-дит-Салли, Кристина; Маутшен, Мишель; Цзян, Вэй; Мустелин, Томас (9 апреля 2006 г.). «Потеря двойной специфической фосфатазы VHR вызывает остановку клеточного цикла и старение». Природа клеточной биологии. 8 (5): 524–531. Дои:10.1038 / ncb1398. PMID 16604064.
- ^ Рахмуни, Суад; Чериньоли, Фабио; Алонсо, Андрес; Цутджи, Тошия; Хенкенс, Рэйчел; Чжу, Чанцзюнь; Луи-дит-Салли, Кристина; Маутшен, Мишель; Цзян, Вэй; Мустелин, Томас (1 мая 2006 г.). «Потеря двойной специфической фосфатазы VHR вызывает остановку клеточного цикла и старение». Природа клеточной биологии. 8 (5): 524–531. Дои:10.1038 / ncb1398. ISSN 1465-7392. PMID 16604064.
