Агонист рецепторов мелатонина - Melatonin receptor agonist
| Агонист рецепторов мелатонина | |
|---|---|
| Класс препарата | |
 Мелатонин, прототипный агонист рецепторов мелатонина | |
| Идентификаторы класса | |
| Использовать | Нарушения сна, депрессия, СДВГ и др. |
| Код УВД | N05CH |
| Биологическая мишень | Рецептор мелатонина |
| Клинические данные | |
| WebMD | RxList |
| внешняя ссылка | |
| MeSH | D008550 |
| В Викиданных | |
Агонисты рецепторов мелатонина являются аналогами мелатонин которые связывают и активируют рецептор мелатонина.[1] Агонисты рецептора мелатонина имеют ряд терапевтических применений, включая лечение нарушений сна и депрессии. Открытие и разработка агонистов рецепторов мелатонина были мотивированы потребностью в более мощных аналогах, чем мелатонин, с лучшим фармакокинетика и дольше период полураспада. Агонисты рецепторов мелатонина были разработаны на основе структуры мелатонина в качестве модели.[1]
Рецепторы мелатонина: G-белковые рецепторы и экспрессируются в различных тканях тела. Есть два подтипа рецептора у человека: рецептор мелатонина 1 (MT1) и рецептор мелатонина 2 (MT2).[2] Мелатонин и рецептор мелатонина агонисты, на рынке или в клинические испытания все они связываются с рецепторами обоих типов и активируют их.[1] Связывание агонистов с рецепторами исследуется с 1986 г., но до сих пор полностью не изучено.[1][3][4] Когда агонисты рецепторов мелатонина связываются с их рецепторами и активируют их, это вызывает многочисленные физиологические процессы.[2][4][5]
История

В 1917 году МакКорд и Аллен открыли сам мелатонин.[6] В 1958 г. Аарон Б. Лернер и его коллеги выделили вещество N-ацетил-5-метокситриптамин и назвал его мелатонином.[1][6] Сайты связывания мелатонина с высоким сродством были фармакологически охарактеризованы в бык мозга в 1979 году. Первый мелатонинергический рецептор был клонирован из меланофоры из Xenopus laevis в 1994 г.[6] В 1994-1995 годах рецепторы мелатонина были охарактеризованы и клонированы у человека Реппертом и его коллегами.[7]
ТИК-301 (ПД-6735, г. LY-156,735 ) находится в фазе II клинических испытаний в Соединенных Штатах (США) с 2002 года.[1] В мае 2004 г. FDA присвоило лекарству TIK-301 статус орфанного препарата для лечения нарушение циркадного ритма сна у слепых людей без восприятия света и людей с поздняя дискинезия.[1] В 2005 году Рамелтеон (Розерем) был одобрен в США для лечения бессонница, характеризующееся трудностью засыпания у взрослых.[нужна цитата ] Мелатонин в форме пролонгированного высвобождения (торговое наименование Circadin ) был одобрен в 2007 году в Европе (ЕС) для использования в качестве краткосрочного лечения первичной бессонницы (плохого качества сна) у пациентов 55 лет и старше.[нужна цитата ] Продукты, содержащие мелатонин, доступны в качестве пищевых добавок в США.[нужна цитата ] и Канада. В 2009 агомелатин (Вальдоксан, Мелитор, Тиманакс) также был[требуется разъяснение ] одобрен в Европе и показан для лечения сильное депрессивное расстройство у взрослых.[нужна цитата ] Тасимелтеон завершила III фазу клинических испытаний первичной бессонницы в США в 2010 г.[8] В Управление по контролю за продуктами и лекарствами (FDA) предоставил тасимелтеон орфанный препарат статус обозначения слепых без световосприятия с расстройство сна и бодрствования не 24 часа в сутки в январе того же года,[нужна цитата ] и окончательное одобрение FDA для той же цели было получено в январе 2014 года под торговой маркой Hetlioz.[9]
Рецепторы мелатонина

У людей существует два подтипа рецепторов мелатонина, на которые нацелены агонисты мелатонина: MT1 и MT2. Они представляют собой рецепторы, связанные с G-белком, и экспрессируются в различных тканях организма вместе или по отдельности.[2] MT1 рецепторы экспрессируются во многих областях Центральная нервная система (ЦНС): супрахиазматическое ядро (SCN) гипоталамуса, гиппокамп, черная субстанция, мозжечок, центральный дофаминергические пути, вентральная тегментальная область и прилежащее ядро.[2][5] MT1 также выражается в сетчатка, яичник, яичко, молочная железа, коронарное кровообращение и аорта, желчного пузыря, печень, почки, кожа и иммунная система. MT2 рецепторы экспрессируются в основном в ЦНС, а также в ткани легких, сердца, коронарных сосудов и аорты, миометрий и клетки гранулезы, иммунные клетки, двенадцатиперстная кишка и адипоциты.[2]
Механизм действия
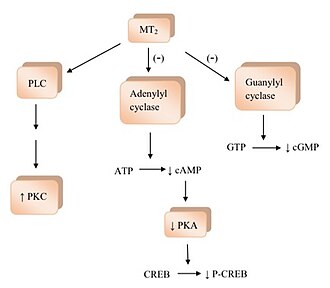
Связывание мелатонина с рецепторами мелатонина активирует несколько сигнальных путей.[1] MT1 активация рецептора подавляет аденилилциклаза и его ингибирование вызывает эффект отсутствия активации; начиная с уменьшения образования циклический аденозинмонофосфат (цАМФ), а затем прогрессирует до менее протеинкиназа А (PKA), которая, в свою очередь, препятствует фосфорилированию белка, связывающего цАМФ-элемент (CREB-связывающий белок ) в P-CREB.[4] MT1 рецепторы также активируют фосфолипаза C (PLC), влияют на ионные каналы и регулируют поток ионов внутри клетки.[1][2][4] Связывание мелатонина с МТ2 рецепторы ингибируют аденилилциклазу, что снижает образование цАМФ.[4] Также это мешает гуанилилциклаза и, следовательно, формирование циклический гуанозинмонофосфат (cGMP). Привязка к МТ2 рецепторы, вероятно, влияют на PLC, который увеличивает протеинкиназа C (PKC) деятельность. Активация рецептора может привести к ионному потоку внутри клетки.[1][4]
Когда агонисты рецепторов мелатонина активируют свои рецепторы, это вызывает множество физиологических процессов.[2][4][5] MT1 и MT2 рецепторы могут быть мишенью для лечения циркадных и нецикадных нарушений сна из-за их различий в фармакологии и функции в SCN. SCN отвечает за поддержание 24-часового цикла, который регулирует множество различных функций организма, от сна до иммунных функций.[10] Рецепторы мелатонина были идентифицированы в сердечно-сосудистой системе. Данные исследований на животных указывают на двойную роль мелатонина в сосудистой сети.[2] Активация МТ1 рецепторы опосредуют сужение сосудов и активацию MT2 рецепторы опосредуют вазодилатацию. Мелатонин участвует в регулировании иммунных ответов как у человека, так и у животных за счет активации обоих МТ.1 и MT2 рецепторы.[2][4] MT1 и MT2 рецепторы широко распространены в глазу и участвуют в регуляции секреции водянистой влаги, что важно для глаукома, И в фототрансдукция. Это не полный список, поскольку многие из возможных процессов требуют дальнейшего подтверждения.[2]
Дизайн и разработка лекарств
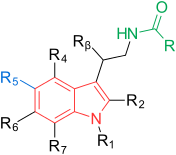
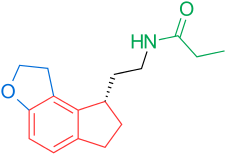
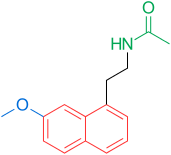
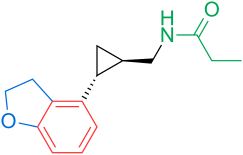
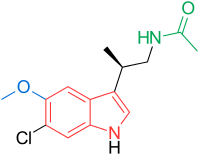
Рецепторы и структура мелатонина известны. Поэтому исследователи начали изучать модуляцию основной структуры для разработки более эффективных агонистов, чем мелатонин; более мощный, с лучшей фармакокинетикой и более длительным периодом полувыведения. ТИК-301 (рисунок 1) - агонист ранних классов. Он очень похож на мелатонин и прошел клинические испытания.[1] Это привело к дальнейшим исследованиям молекулы, в основном замещения ароматического кольца. Различные модуляции показали многообещающую активность, особенно нафталин кольцо, которое присутствует в агомелатине (рисунок 1).[1][6] Другие кольцевые системы также показали активность агонистов мелатонина. Среди них есть индан который присутствует в рамелтеоне (рисунок 1) и кольцевой системе тазимелтеона (рисунок 1).[1][3]
Связь структура-деятельность
Общая структура мелатонина - это индол кольцо с метокси группа в положении 5 (5-метоксигруппа) и ациламиноэтильная боковая цепь в положении 3.[1] Две боковые цепи важны для связывания и активации рецепторов.[3] Индольное кольцо оценивали во всех положениях по эффекту замен, как показано на рисунке 1.[1] Каждая позиция поясняется ниже:[1]
| Должность | Сокращение | Действие |
|---|---|---|
| 1 | р1 | Возможна замена небольшими группами, такими как метил, без небольшого изменения сродства связывания. Объемные группы снижают аффинность связывания и внутренняя активность. |
| 2 | р2 | Добавление йода, брома и фенил функциональные группы приводят к агонистам с более высокой аффинностью связывания примерно в десять раз. |
| 3 | р3 | Как упоминалось ранее, важна ациламиноэтильная боковая цепь. В этом положении можно контролировать активность агонистов и антагонистов. |
| 4 | р4 | Часто участвует в замыкании кольца у агонистов мелатонина, хотя эта позиция мало изучена. |
| 5 | р5 | Как упоминалось ранее, важна метоксигруппа. Замена галогенами, такими как хлор (Cl) и бром (Br), показала более низкую аффинность связывания. Перемещение метоксигруппы в другие положения индольного кольца, например 4, 6 или 7, приводит к снижению сродства связывания. |
| 6 | р6 | Замена приводит к снижению аффинности связывания, но это положение важно для фармакокинетики. Основным метаболитом in vivo является 6-гидроксимелатонин. |
| 7 | р7 | Введение групп в это положение обычно приводит к снижению сродства связывания. |
| β | рβ | Возможна замена небольшими группами, такими как метил, без небольшого изменения сродства связывания. Более объемные группы снижают сродство связывания. |
Связывание и фармакофор
2-Йодомелатонин был синтезирован в 1986 г. и его радиолиганд 2- [125I] -мелатонин был полезен для поиска клеточных мишеней мелатонина. Хотя рецептор мелатонина не был охарактеризован и клонирован у человека до 1994 года, до этого времени можно было начать проводить исследования связывания в различных тканях.[1] Как упоминалось выше в главе о взаимоотношениях структуры и деятельности, определенные группы важны для деятельности. Наиболее важными группами являются 5-метоксигруппа и ациламиноэтильная боковая цепь, поскольку они связываются с рецепторами и активируют их.[3][4] Группа –NH индольного кольца не важна для связывания и активации. Поэтому его можно заменить другими ароматическими кольцевыми системами. Ароматическое кольцо и этильная боковая цепь поддерживают правильное расстояние между этими двумя группами. Правильное расстояние является ключом к хорошему связыванию и более важно, чем тип ароматической кольцевой системы, содержащейся в аналоге. Следовательно, можно использовать различные кольцевые системы в аналогах рецепторов мелатонина, если расстояние является правильным.[1][3][4]
Рецепторы мелатонина состоят из белков около 40 кДа каждый. МТ1 рецептор кодирует 350 аминокислот и MT2 кодирует 362 аминокислоты. Связывание мелатонина и его аналогов с рецепторами полностью не известно. Связывающее пространство для мелатонина и аналогов на МТ1 рецептор меньше, чем на МТ2.[4] Исследования обычно сосредоточены на двух кармашках для крепления двух боковых цепей. Связывающий карман 5-метоксигруппы изучен больше, чем другой карман.[4][5] Исследователи согласны с тем, что кислород в группе связывается с гистидин (His) остатки в трансмембранном 5 (TM5) домене рецептора с водородной связью; His195 в МП1 и His208 в МП2.[3][4] Еще одна аминокислота, валин 192 (Val), также участвует в связывании 5-метоксигруппы, связываясь с метильной частью группы.[4]
Связывание N-ацетильной группы более сложное и менее известное. Важные аминокислоты в связывающем кармане для этой группы рецепторов различаются. Серины, Ser110 и Ser114 в домене TM3, по-видимому, важны для связывания с MT1 рецептор. Однако, аспарагин 175 (Asn) в домене TM4, вероятно, важен для MT2 рецептор.[4] Система ароматических колец в мелатонине и аналогах, скорее всего, вносит некоторую аффинность связывания за счет связывания с ароматическими кольцами аминокислот. фенилаланин (Phe) и триптофан (Trp) в рецепторе. Образующиеся облигации Ван-дер-Ваальсовы взаимодействия.[3] Связывание и карман связывания N-ацетила, связывание кольцевой системы и важные домены в некоторой степени известны и требуют дальнейшего изучения.[1][3][4]
Карбаматные инсектициды нацелены на рецепторы мелатонина человека.[11]
Текущее состояние
Сегодня (февраль 2014 г.) на рынке представлены три агониста мелатонина; Рамелтеон (Розерем), агомелатин (Вальдоксан, Мелитор, Тиманакс) и тасимелтеон (Гетлиоз). Рамелтеон был разработан Фармацевтическая компания Такеда и одобрен в США в 2005 году. Агомелатин был разработан фармацевтической компанией Сервье и одобрен в Европе в 2009 году. Tasimelteon был разработан Vanda Pharmaceuticals и завершил фазу III испытания в 2010 году. Он был одобрен FDA 31 января 2014 года для лечения расстройство сна и бодрствования не 24 часа в сутки у полностью слепых людей.[9]
Один агонист мелатонина получил статус орфанного препарата и проходит клинические испытания в США: TIK-301. Первоначально ТИК-301 разрабатывался Эли Лилли и компания и назвали LY-156,735, только в июле 2007 года компания Tikvah Pharmaceuticals взяла на себя разработку и назвала ее TIK-301. В настоящее время он проходит II фазу испытаний с 2002 года.[1][12] В июле 2010 года в Европе мелатонин пролонгированного действия (Circadin, Neurim Pharmaceuticals) был одобрен для использования в течение 13 недель для пациентов с бессонницей старше 55 лет.[13] Кроме того, Neurim Pharmaceuticals сообщила о результатах положительного исследования фазы II своего исследуемого соединения пиромелатина (Neu-P11) в феврале 2013 года.[14]
| Circadin | Рамелтеон | Агомелатин | Тасимелтеон | ТИК-301 | |
|---|---|---|---|---|---|
| Связывание сродства | — | MT1: Ki = 0,014 нМ MT2: Ki = 0,045 нМ | MT1: Ki = 0,062 нМ MT2: Ki = 0,268 нМ 5-HT2C: IC50 = 270 нМ * | MT1: Ki = 0,35 нМ MT2: Ki = 0,17 нМ | MT1: Ki = 0,081 нМ MT2: Ki = 0,042 нМ |
| Биодоступность | 15% | < 2% | < 5% | не определяется у людей | — |
| Период полураспада | 40–50 мин. 3,5–4 ч (терминал) | 1–2 часа | 1–2 часа | 0,9–1,7 ч 0,8–5,9 ч (терминал) | — |
| Связывание с белками | 60% | 82% | 95% | 89–90% | — |
| Объем распространения | — | 73,6 л | 35 л | 56–126 л | — |
| Компания | Neurim Pharmaceuticals | Фармацевтическая компания Такеда | Сервье | Vanda Pharmaceuticals | Tikvah Pharmaceuticals |
| * Антагонист серотонина. | |||||
Смотрите также
- ТИК-301 (LY-156,735, ПД-6735)
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты Ривара, С., Мор, М., Бедини, А., Спадони, Г., Тарзия, Г. (2008). «Агонисты рецепторов мелатонина: SAR и применение для лечения нарушений сна и бодрствования». Актуальные темы медицинской химии. 8 (11): 954–68. Дои:10.2174/156802608784936719. PMID 18673165.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c d е ж грамм час я j Панди-Перумал, С. Р., Трахт, И., Сринивасан, В., Спенс, Д. В., Маэстрони, Г. Дж. М., Зисапель, Н., Кардинали, Д. П. (2008). «Физиологические эффекты мелатонина: роль рецепторов мелатонина и пути передачи сигнала». Прогресс в нейробиологии. 85 (3): 335–53. Дои:10.1016 / j.pneurobio.2008.04.001. PMID 18571301.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c d е ж грамм час Сагден, Д., Дэвидсон, К., Хаф, К. А., Тех, М. Т. (2004). «Мелатонин, рецепторы мелатонина и меланофоры: движущаяся история». Исследование пигментных клеток. 17 (5): 454–60. Дои:10.1111 / j.1600-0749.2004.00185.x. PMID 15357831.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c d е ж грамм час я j k л м п о п Дубокович, М. Л., Делагранж, П., Краузе, Д. Н., Сагден, Д., Кардинали, Д. П., Олчезе, Дж. (2010). "Международный союз фундаментальной и клинической фармакологии. LXXV. Номенклатура, классификация и фармакология рецепторов мелатонина, связанных с G-белком". Фармакологические обзоры. 62 (3): 343–80. Дои:10.1124 / пр.110.002832. ЧВК 2964901. PMID 20605968.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c d Витт-Эндерби, П. А., Беннет, Дж., Ярзинка, М. Дж., Файерстайн, С., Мелан, М. А. (2003). «Рецепторы мелатонина и их регуляция: биохимический и структурный механизм». Науки о жизни. 72 (20): 2183–98. Дои:10.1016 / S0024-3205 (03) 00098-5. PMID 12628439.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б c d де Бодинат, К., Гвардиола-Леметр, Б., Мокаэр, Э., Ренар, П., Муньос, К., Миллан, М. Дж. (2010). «Агомелатин, первый мелатонинергический антидепрессант: открытие, характеристика и разработка». Обзоры природы Drug Discovery. 9 (8): 628–42. Дои:10.1038 / nrd3140. PMID 20577266.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б Фергюсон, С. А., Раджаратнам, С. М. У., Доусон, Д. (2010). «Агонисты мелатонина и бессонница». Экспертный обзор нейротерапии. 10 (2): 305–38. Дои:10.1586 / ern.10.1. PMID 20136385.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Раджаратнам, С. М. У., Коэн, Д. А., Роджерс, Н. Л. (2009). «Мелатонин и аналоги мелатонина». Клиники медицины сна. 4 (2): 179–93. Дои:10.1016 / j.jsmc.2009.02.007.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б «FDA одобряет Гетлиоз: первое средство от нарушения сна и бодрствования у слепых людей» (Пресс-релиз). FDA. 31 января 2014 г. Архивировано с оригинал 2 февраля 2014 г.
- ^ Дубокович, М. Л. (2007). «Рецепторы мелатонина: роль в регуляции сна и циркадного ритма». Снотворное. 8: 34–42. Дои:10.1016 / j.sleep.2007.10.007. PMID 18032103.
- ^ Поповская-Горевски, Марина; Дубокович, Маргарита Л .; Раджнараянан, Раджендрам В. (20 февраля 2017 г.). «Карбаматные инсектициды нацелены на рецепторы мелатонина человека». Химические исследования в токсикологии. 30 (2): 574–582. Дои:10.1021 / acs.chemrestox.6b00301. ЧВК 5318275. PMID 28027439.
- ^ «Будущие методы лечения депрессии, тревоги, нарушений сна, психоза и СДВГ». Neurotransmitter.net. 2011-06-17. Получено 2012-02-10.[ненадежный источник? ]
- ^ «Циркадин одобрен в ЕС для лечения первичной бессонницы у пациентов в возрасте 55 лет и старше на срок до 3 месяцев» (Пресс-релиз). Neurim Pharmaceuticals. 5 июля 2010 г.. Получено 19 февраля, 2020.
- ^ «Neurim Pharmaceuticals объявляет о положительных результатах клинических испытаний фазы 2 пиромелатина для лечения бессонницы» (Пресс-релиз). Neurim Pharmaceuticals. 18 февраля 2013 г.. Получено 19 февраля, 2020.
- ^ «Основные сведения о назначении Гетлиоза» (PDF).
- ^ «Материалы заседания Консультативного комитета Tasimelteon» (PDF). Vanda Pharmaceuticals. Ноябрь 2013 г. Архивировано с оригинал (PDF) 25 ноября 2013 г.