Эпителиоидная саркома - Epithelioid sarcoma
| Эпителиоидная саркома | |
|---|---|
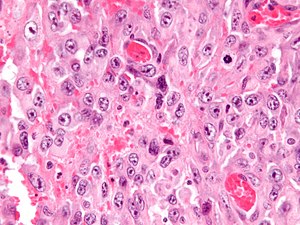 | |
| Микрофотография эпителиоидной саркомы. H&E пятно. | |
| Специальность | Онкология |
Эпителиоидная саркома редкий саркома мягких тканей вытекающие из мезенхимальный ткани и характеризуется эпителиоидный -подобные особенности. На его долю приходится менее 1% всех саркомы мягких тканей. Впервые он был четко охарактеризован Ф. Энцингер в 1970 году.[1] Обычно он проявляется в дистальный конечности (пальцы, руки, предплечья или ступни) молодых людей в виде небольшой мягкой массы или серии ударов. А проксимальный также описана версия, часто возникающая в верхних конечностях.[2] Сообщалось о редких случаях в области таза, вульвы, полового члена и позвоночника.
Гистологически эпителиоидная саркома образует узелки с центральным некрозом, окруженные мягкими полигональными клетками с эозинофильной цитоплазмой и периферическим веретеном.[3] Эпителиоидные саркомы обычно выражаются виментин, цитокератины, эпителиальный мембранный антиген, и CD34, тогда как они обычно отрицательны для S100, десмин, и FLI1 (FLI-1).[3] Обычно они дают положительный результат на CA125.[4]
Эпителиоидная саркома чаще всего поражает молодых людей, но ни одна возрастная группа не застрахована от нее. Заболевание имеет тенденцию к развитию местных рецидивов и метастаз затем в регионарные лимфатические узлы, легкие, кости, мозг и другие участки, включая кожу головы.[3] Вообще говоря, эпителиоидная саркома имеет высокий уровень рецидивов после первоначального лечения и имеет тенденцию рецидивировать локально (в месте первоначальной опухоли или рядом с ним). Эпителиоидная саркома также имеет лимфатическое распространение (в 22-48% случаев) и метастазирование (в 21-63% случаев).[5] Эти события, а также продвинутая стадия (прогрессирование) и степень (агрессивность) позволяют прогнозировать худший исход в целом. Общая пятилетняя выживаемость при эпителиоидной саркоме составляет от 25 до 78%.[5] Важно отметить, что 10-летняя и 15-летняя выживаемость значительно снижаются.[6][7] Более положительный результат связан с более молодым возрастом, женским и мужским полом, дистальным или проксимальным расположением, меньшим размером опухоли и отрицательными границами после удаления опухоли.[1][7][8]
Признаки и симптомы
Эпителиоидная саркома - это медленнорастущая и относительно безболезненная опухоль, которая часто приводит к длительному периоду времени между представлением и постановкой диагноза.[6] Из-за своей неоднозначности его часто ошибочно принимают за стойкую бородавку или кисту. Чаще всего проявляется в дистальный конечности (пальцы, кисти, предплечья или ступни) в виде небольшой мягкой массы или серии ударов. Это чаще всего описывается как пальпируемое образование от твердого до твердого либо в глубоких мягких тканях, либо в дерме. Часто изъязвление вызывает ошибочный диагноз плохо заживающей травматической раны или бородавки. Около 13% пациентов будут иметь мультифокальные опухоли, а около 13% пациентов будут иметь метастазы.[9]
Генетика
Наиболее частая генетическая мутация (обнаруживается в 80-90% эпителиоидных сарком) - это инактивация SMARCB1 ген, или потеря функции INI-1,[10][11] который считается основным фактором прогрессирования заболевания. Эпителиоидная саркома обычно содержит мутации или делеции хромосомы 22q11.2 и прирост 8q, особенно i (8) (> q10). Также наблюдались аберрации 18q и 8q, а также периодический рост 11q13.[12][13][14]
Ген SMARCB1 (также называемый BAF47, INI1 или hSNF5) расположен на хромосоме. 22q11.2[10] и коды для члена SWI / SNF комплекс ремоделирования хроматина. Утрата функции SMARCB1 - наиболее распространенная генетическая мутация, наблюдаемая при эпителиоидной саркоме, и эта дисфункция, вероятно, является основным фактором прогрессирования заболевания. SMARCB1 - это субъединица корового белка из 15 субъединичного комплекса SWI / SNF (или BAF), участвующего в регуляции нуклеосомной архитектуры нашего генома.[10] и было показано, что он мощный ген-супрессор опухоли,[11][15] Это означает, что его основная роль состоит в том, чтобы контролировать деление клеток и даже останавливать деление при определенных обстоятельствах (то есть сигналы для чрезмерной репликации). Поскольку этот опухолевый супрессор обычно инактивирован при эпителиоидной саркоме, деление клеток может не останавливаться надлежащим образом, что приводит к нерегулируемому клеточному росту и образованию раковых опухолей. Несколько исследовательских групп в настоящее время разрабатывают методы, чтобы обратить вспять эту потерю генетической функции, характерную для эпителиоидной саркомы.[6]
Молекулярная биология
VEGF
VEGF (фактор роста эндотелия сосудов) часто сверхэкспрессируется при эпителиоидной саркоме.[16] Это важный путь в ангиогенез, процесс, который раковые клетки используют для формирования новых кровеносных сосудов, которые обеспечивают необходимые элементы для опухоль для выживаемости опухоли. Агенты против VEGF, такие как пазопаниб показали многообещающие результаты при лечении нескольких различных карцином и сарком мягких тканей.[17] В одном тематическом исследовании у пациента с метастатической эпителиоидной саркомой вульвы на поздней стадии наблюдалось частичное разрешение метастазов в легких и плевре при введении пазопаниба, в то время как все другие методы лечения не дали результатов[18]
ВСТРЕТИЛИСЬ
ВСТРЕТИЛИСЬ (переход от мезенхимы к эпителию) - еще один биологический путь, который, вероятно, участвует в развитии и прогрессировании эпителиоидной саркомы.[19][20] c-MET - это тирозинкиназа онкоген, и его сигнальный путь участвует во множестве злокачественных новообразований, включая многие виды рака.[нужна цитата ]
Соник-ежик и Нотч
В Соник ежик и Сигнальные пути Notch также подозревают, что их активность повышается при эпителиоидной саркоме. Эти сигнальные пути клеток контролируют клеточную пролиферацию и дифференцировку. Они также участвуют в раковые стволовые клетки координация и инвазивность болезни и метастазирование. Ингибиторы Hhat (такие как RU-SKI 43) блокируют сигнальный путь Sonic hedgehog путем ингибирования пальмитоилацитл-трансферазы hedgehog. Текущие испытания изучают ингибиторы Notch против эпителиоидной саркомы.[21]
mTOR
Частая гиперактивация mTOR Передача сигналов (мишень рапамицина у млекопитающих) также наблюдалась при эпителиоидной саркоме.[20][22] Путь mTOR был описан как «главный переключатель» для клеточного катаболизм и анаболизм, и это может улучшить развитие клеточного цикла, выживаемость клеток и блокирование нормальной гибели клеток (апоптоз ).[17] Было продемонстрировано, что простая блокировка передачи сигналов mTOR может привести к реактивации AKT путь, сводя на нет большую часть эффективности anti-mTOR.[20] Было показано, что реактивация AKT зависит от c-MET,[20] Это привело к тому, что одновременное блокирование mTOR и c-MET может продемонстрировать повышенную эффективность.
EGFR
Чрезмерное выражение рецептор эпидермального фактора роста (EGFR) был зарегистрирован в большинстве эпителиоидных сарком.[22][23] EGFR является членом Семейство рецепторов HER. На связывание лиганда, Фосфорилирование EGFR запускает активацию нижестоящих сигнальных путей, участвующих в критических клеточных функциях, таких как распространение, выживание и ангиогенез.[24] В пробирке и in vivo лабораторные эксперименты продемонстрировали, что блокада EGFR при эпителиоидной саркоме приводит к снижению пролиферации клеток, усилению апоптоза и отмене способности к инвазии и миграции.[22] Хотя простая блокада EGFR одним агентом показала ограниченные результаты в клинических условиях, при использовании в составе комбинированного режима (где ингибитор EGFR комбинируется с ингибитором mTOR), синергизм наблюдалось, и было продемонстрировано превосходное ингибирование роста опухоли.[22]
CD109
CD109 часто выражается в развитой эпителиоидной саркоме и считается раковые стволовые клетки (или клетка, инициирующая рак) болезни.[25] Также было показано, что его уровень экспрессии позволяет предсказать исход. Раковые стволовые клетки представляют собой небольшую популяцию опухолевых клеток, характеризующуюся общей химиорезистентностью, способностью к самообновлению, потенциалом множественной дифференцировки, способностью к покою и туморогенезом. Поэтому считается, что раковые стволовые клетки играют ключевую роль в прогрессировании и рецидиве рака.
Циклин D1
Циклин D1 является белком, необходимым для прогрессирования клеточного цикла, и было показано, что его активность повышается при эпителиоидной саркоме.[14] Циклин D-1 - регулятор циклинзависимых киназ (CDK4 и CDK6 ). Было показано, что он взаимодействует с белок ретинобластомы (ген-супрессор опухоли), CDK4 и CDK6, рецептор гормона щитовидной железы бета, и коактиватор ядерного рецептора 1, среди прочего.[14] Циклин D и CDK способствуют развитию клеточного цикла, высвобождая факторы транскрипции которые важны для начала Репликация ДНК. Аномальные уровни циклина D-1 могут способствовать быстрому делению клеток эпителиоидной саркомы.
Диагностика
Ткань биопсия - это предпочтительный диагностический метод. Из-за высокой частоты поражения лимфатических узлов биопсия сторожевого лимфатического узла часто выполняется. Общей характеристикой эпителиоидной саркомы (наблюдается в 80% всех случаев) является потеря функции SMARCB1 ген (также называемый BAF47, INI1 или hSNF5). Иммуногистохимическое окрашивание INI1 доступно и может использоваться для диагностики эпителиоидной саркомы. МРТ это диагностический метод выбора для визуализации перед биопсией и патологической диагностикой, при этом основная роль заключается в определении анатомических границ.[нужна цитата ]
Постановка
При определении стадии эпителиоидной саркомы учитываются размер и расположение первичной опухоли, поражение лимфатических узлов, наличие и расположение метастазов, а также гистологическая степень (показатель агрессивности заболевания).[26]
Уход
Хирургическая резекция опухоли с широкими краями остается предпочтительным методом лечения,[27] и показал наибольший успех против болезни.[27][28][29] Недавно, щадящая хирургия был исследован с умеренным успехом.[30]
В случаях запущенного, рецидивирующего или метастазирующего заболевания или если опухоль неоперабельна, химиотерапия и лучевая терапия являются стандартом лечения.[31] хотя общий уровень успеха с ними остается низким.[32]
В январе 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило Тазверик (таземетостат), соединение, которое блокирует EZH2 метилтрансфераза для лечения эпителиоидной саркомы у пациентов в возрасте 16 лет и старше с метастатическим или местнораспространенным (не поддающимся полностью хирургическому удалению) заболеванием.[33]
Прогноз
5-летняя выживаемость пациентов с эпителиоидной саркомой составляет 50-70%, а 10-летняя выживаемость - 42-55%. Дети с эпителиоидной саркомой, как правило, имеют несколько лучшие результаты, чем взрослые, с 5-летней выживаемостью около 65%.[7] У педиатрических пациентов также наблюдается меньшее лимфатическое распространение и метастазирование.[7] Было показано, что помимо стадии и степени опухоли на прогноз влияют пол, локализация, возраст на момент постановки диагноза, размер опухоли и микроскопическая патология.[9][34] Продвинутая стадия и оценка связаны с худшими результатами. У женщин, как правило, более благоприятные исходы, чем у мужчин, проксимальные случаи показывают худшие результаты, чем дистальные, а более молодой возраст ассоциируется с более положительными результатами. Опухоли диаметром более 2 см и опухоли с некроз и сосудистая инвазия коррелировали с худшим исходом.[34]
Золотой стандарт химиотерапии - это сочетание доксорубицин и ифосфамид. Однако недавние исследования показали, что добавление ифосфамида к доксорубицину не обязательно приводит к увеличению общей выживаемости.[35] Этопозид, винкристин, дактиномицин, и циклофосфамид также традиционно давались.[31] Новые химиотерапевтические препараты, такие как гемцитабин и пазопаниб, в настоящее время проходят клинические испытания.[нужна цитата ]
Радиационная терапия также вариант лечения, когда опухоли считаются неоперабельными или недоступны широкие хирургические границы. Лучевая терапия в сочетании с химиотерапией до сих пор приводила лишь к минимальному улучшению показателей ответа. Испытания с брахитерапия (внутренняя лучевая терапия, при которой высокая доза облучения направляется непосредственно на опухоль и, как считается, имеет меньше долгосрочных побочных эффектов) дала некоторые положительные результаты.[нужна цитата ]
Исследование
Было показано, что эпителиоидная саркома (особенно запущенная стадия, рецидивирующая или метастазирующая болезнь) устойчива к традиционным методам лечения рака, что требует дальнейшего изучения новых методов и методов лечения. Из-за относительно слабого ответа эпителиоидной саркомы на традиционные методы лечения рака (хирургия, химиотерапия и лучевая терапия) ищут новые стратегии лечения.[нужна цитата ]
Химиотерапия
Новые химиотерапевтические методы изучаются в текущих клинических испытаниях эпителиоидной саркомы, хотя до сих пор ни один из них не показал значительного улучшения по сравнению с эффективностью доксорубицина / ифосфамида. Эти новые агенты включают гемцитабин, пазопаниб, циксутумумаб, темозоломид, дасатаниб, бевацизумаб, таксаны и винорелбин.[31]
Альдоксорубицин это новый пролекарство доксорубицина. Доксорубицин является стандартом лечения запущенной или метастической эпителиоидной саркомы, но имеет ограничивающую дозу токсичность, а именно острую и хроническую. сердечная токсичность.[36][37] Доксорубицин обеспечивает частоту ответа в диапазоне 12–23% у пациентов с саркомой мягких тканей. Альдоксорубицин - это новая версия доксорубицина, которая предназначена для безопасной доставки более высокой дозы препарата непосредственно в опухоль, что приводит к повышению эффективности и меньшей токсичности. Он работает, попадая в кровоток, связываясь с альбумин в крови, путешествуя по телу и высвобождая полезную нагрузку доксорубицина, когда он сталкивается с кислым микроокружением опухоли.[38] Несколько исследований фазы I и II продолжаются, и, по крайней мере, до сих пор, сердечная токсичность практически не наблюдалась. Установлено, что максимальная переносимая доза альдоксорубицина в 3,5 раза превышает МПД доксорубицина, и исследования показали повышенную частоту ответа у пациентов с саркомами мягких тканей. Что в настоящее время неизвестно, так это потенциальные долгосрочные побочные эффекты этой повышенной дозы доксорубицина. Несколько исследований показали повышенный риск развития вторичного рака, связанный с воздействием высоких доз антрациклинов (таких как доксорубицин).[39]
TH-302 является еще одним новым пролекарством, находящимся в стадии разработки. Он нацелен опухолевая гипоксия, обычное явление в онкогенезе, когда микроокружение опухоли истощается кислородом и становится гипоксический.[40] Гипоксические ниши в опухолях, как правило, содержат более медленно растущие раковые клетки,[41] делая многие виды химиотерапии неэффективными в этих областях. TH-302 непосредственно нацелен на эти глубокие гипоксические области, и, оказавшись внутри них, он высвобождает цитотоксическую нагрузку в виде бромизофосфорамидного иприта непосредственно в раковые клетки.[40] Учитывая, что эпителиоидная саркома представляет собой медленнорастущую опухоль, разумно предположить, что опухоли ES будут сильно гипоксичны и проявлять благоприятный ответ на TH-302. В нескольких исследованиях наблюдалась повышенная эффективность TH-302, когда микросреда гипоксической опухоли была нарушена.[42] Несколько испытаний фазы I, II и III с TH-302 и TH-302 в комбинации с доксорубицином продолжаются, и к настоящему времени получены многообещающие результаты.[43] Два испытания фазы 3 потерпели неудачу в 2015 году.
Иммунотерапия
Иммунотерапия это стратегия использования собственной иммунной системы организма для борьбы с раком. Обычно это включает в себя «обучение» или «настройку» иммунной системы, чтобы она могла лучше распознавать и отторгать раковые клетки. Различные виды иммунотерапии могут включать манипуляции с телом. Т-клетки, NK-клетки, или же Дендритные клетки поэтому они более эффективны против раковых клеток. Они также могут включать введение лабораторных антитела специфично для опухоли антигены для создания или повышения иммунная реакция.[нужна цитата ]
Вакцинотерапия возможно иммунотерапевтический стратегия с самыми постоянными исследованиями сарком в настоящее время,[44] хотя, по крайней мере, до сих пор появилось мало доказательств того, что одна активная вакцинация может привести к регрессии опухоли.[45] В настоящее время изучаются различные методы и стратегии лечения с целью повышения объективного ответа на вакцинацию.[44] Вакцины могут доставлять в иммунную систему различные связанные с опухолью факторы (опухолевые антигены), что приводит к естественному антителу и Т-клеточному ответу на опухоль.[44][46]
Адоптивная иммунотерапия стремится увеличить популяцию Т-клеток организма, которые распознают определенный опухолевый антиген. Т-клетки могут быть собраны, а затем размножены и генетически изменены для распознавания определенных опухолевых маркеров.[44][46] В одном случае пациент с продвинутой эпителиоидной саркомой, у которого не удалось пройти несколько терапий, показал сильный ответ на увеличение лимфоцитов и естественных клеток-киллеров.[47]
Ингибиторы иммунных контрольных точек недавно показали многообещающие результаты против нескольких видов рака и могут также обещать против саркомы. Опухоли часто развиваются во время прогрессирования заболевания, и они могут развивать экспрессию ингибирующих белков, которые препятствуют распознаванию иммунной системой и позволяют опухоли избежать иммунного надзора.[45] Нацеливаясь на эти ингибирующие белки, иммунная система открывает путь для распознавания опухоли. Два из этих ингибирующих белков, которые были недавно изучены, являются CTLA-4 и PD1,[45] и лекарства, нацеленные на эти белки, находятся в стадии разработки и имеют определенные перспективы.
Антиангиогенная терапия
Несколько антиангиогенный агенты исследуются при эпителиоидной саркоме,[нужна цитата ] рак, который, вероятно, зависит от ангиогенеза для выживания и прогрессирования. Эти агенты взаимодействуют с различными проангиогенными факторами, некоторые из которых, как известно, чрезмерно экспрессируются при эпителиоидной саркоме.[16][23] (Например, VEGF и EGFR).[48][49] Опухоли требуют кровоснабжения, чтобы обеспечить их кислородом и питательными веществами, необходимыми для их выживания. По мере того, как опухоли расширяются и растут, они посылают различные сигналы (например, HIF1), которые способствуют развитию новых кровеносных сосудов опухоли.[50] Антиангиогенные агенты, такие как бевацизумаб, пытаются замедлить или заблокировать рост опухолей, по существу перекрыв их кровоснабжение.
Целенаправленная терапия
Учитывая множественные генетические аномалии и нарушенные биологические пути, наблюдаемые при эпителиоидной саркоме, лекарства, направленные на эти уникальные характеристики опухоли, рассматриваются для более эффективного лечения.
Ингибиторы тирозинкиназы
Ингибиторы тирозинкиназы (Такие как сунитиниб, пазопаниб, и дазатиниб ) показали некоторый эффект против нескольких типов рака, в первую очередь Иматиниб -мезилат в опухоли стромы желудочно-кишечного тракта (ГИСО).[51] Тирозинкиназа (подкласс протеинкиназ) представляет собой фермент который передает фосфатная группа из АТФ молекула в белок в камере.[52] Он функционирует как переключатель «включено» или «выключено» для многих клеточных функций, включая передачу сигналов внутри клетки и деление клетки.
Тирозинкиназы могут содержать мутации, которые заставляют их становиться конститутивно активными,[53] или застревает в положении «включено», что приводит к нерегулируемому делению клеток (признак рака). Ингибиторы тирозинкиназы блокируют действие этих ферментов. Было показано, что ингибиторы тирозинкиназы ингибируют VEGF, EGFR и MET,[52] пути, которые часто сверхэкспрессируются при эпителиоидной саркоме. Их также можно использовать против c-KIT и Сигнальные пути JAK-STAT,[52] которые вовлечены во многие виды рака и могут быть вовлечены в эпителиоидную саркому. Темсиролимус представляет собой ингибитор тирозинкиназы, который блокирует действие белка mTOR и ингибирует путь mTOR. Из-за перекрестных помех между клеточными сигнальными путями было показано, что, хотя вмешательство в один только путь mTOR дает только ограниченные результаты в прекращении туморогенеза, ингибирование как путей mTOR, так и EGFR одновременно демонстрирует повышенный эффект.[22]
СИНУС
Селективные ингибиторы ядерного экспорта (СИНУС ) соединения, такие как селинексор и CBS9106, исследуются на нескольких саркомах и недавно показали многообещающие результаты по широкому спектру обоих гематологические злокачественные новообразования и солидные опухоли.[54][55] Эти соединения работают, блокируя экспорт генов-супрессоров опухолей из ядра клетки в цитоплазму клетки,[54][56] где они оказываются нефункциональными.[57] Экспорт 1 (также известный как XPO1 или CRM1) - это ядерный экспортный белок, отвечающий за экспорт более 200 белков, включая подавляющее большинство белков-супрессоров опухолей.[54] Чтобы гены-супрессоры опухолей выполняли свою нормальную функцию (соответственно инициируя апоптоз), они должны быть расположены в ядре клетки.[57] Было показано, что многие раковые клетки экспрессируют высокие уровни экспортина1,[54][56] что приводит к увеличению экспорта белков-супрессоров опухолей из ядра и, следовательно, противодействует естественным апоптическим процессам, которые защищают организм от рака. Соединения SINE предотвращают транспортировку этих белков-супрессоров опухолей из ядра, позволяя им нормально функционировать и способствуя апоптозу. Недавно исследователи наблюдали синергетический эффект при использовании соединений SINE в сочетании с традиционными химиотерапевтическими средствами (такими как доксорубицин).[58] Было продемонстрировано, что потеря экспрессии INI1 может привести к «демаскированию» сигнала ядерного экспорта,[59] приводя к транспорту белков-супрессоров опухоли из ядра клетки, что способствует онкогенезу. Поэтому разумно подозревать, что ингибитор SINE будет проявлять эффективность против эпителиоидной саркомы, поскольку заболевание характеризуется потерей функции INI1.
Ингибиторы HDAC
Гистоновая деацетилаза (HDAC ) ингибиторы, такие как вориностат, показали некоторые перспективы при эпителиоидной саркоме. Исследователи из Техаса выясняют, действительно ли Ингибиторы HDAC может обратить вспять потерю функции INI1, характерную для эпителиоидной саркомы.[6] Ингибиторы HDAC действуют путем блокирования событий, участвующих в репликации ДНК и, следовательно, в делении клеток.[60] Было показано, что блокирование HDAC стимулирует апоптоз раковых клеток.[6] Несколько диетических фитохимические вещества было показано, что они являются эффективными ингибиторами HDAC.[61] К ним относятся сульфофан, индол-3-карбинол и фенэтилизотиоцианаты, содержащиеся в брокколи, капусте и кресс-салате, и эпигаллокатецехин-3-галлат, содержащийся в зеленом чае.[нужна цитата ]
Ингибиторы CDK
Из-за ассоциации (см. Выше) с циклин D1 Ингибиторы CDK изучаются.
палбоциклиб это Ингибитор CDK (одобрено для некоторых рак молочной железы К другим экспериментальным ингибиторам CDK относятся: абемациклиб и рибоциклиб.
Нацелены на раковые стволовые клетки
Раковые стволовые клетки (или клетки, вызывающие рак), как полагают, представляют собой небольшую популяцию клеток внутри опухоли, которые непосредственно ответственны за образование опухоли. Считается, что они устойчивы к лечению и способны образовывать все клетки, необходимые для развития опухоли. Предполагается, что они являются основным фактором, способствующим прогрессированию рака и рецидивам после лечения. Определенные «стволовые» клетки были обнаружены в эпителиоидной саркоме, которые отмечены CD109 (кластер дифференциации 109),[25] обеспечение потенциально лекарственной мишени на раковых стволовых клетках для заболевания. Однако существуют определенные проблемы с нацеливанием на CD109, поскольку CD109 экспрессируется в других областях тела, а не только в опухолевых клетках.[нужна цитата ]
Онколитическая вирусная терапия
Онколитическая вирусная терапия это развивающаяся терапия рака, которая пытается заразить раковые клетки с помощью генно-инженерного вируса, который может проникать в ДНК клетки. Затем вирус 1.) наносит прямой ущерб раковой клетке, 2.) распространяется по клеткам опухоли посредством клеточного (ДНК) размножения (деления и репликации опухолевых клеток), и 3.) обеспечивает мишень для прямого иммунного ответа. ответ пациента.[17][62]
Было отмечено, что терапевтический потенциал онколитическая виротерапия не является простым следствием цитопатический эффект но сильно зависит от индукции эндогенного иммунного ответа против трансформированных клеток.[62][63] Превосходные противоопухолевые эффекты наблюдались, когда онколитические вирусы были сконструированы для экспрессии (или совместного введения с) иммуностимулирующих молекул, таких как GM-CSF.[63]
Теломелизин (OBP-301) - аденовирус, поражающий теломераза,[64] фермент, который экспрессируется практически во всех раковых клетках, но не в нормальных клетках. OBP-301 был изучен при эпителиоидной саркоме, и было показано, что он способствует апоптозу и гибели клеток [.[64]
CGTG-102
CGTG-102 (разработан Oncos Therapeutics) - аденовирус, который в настоящее время статус орфанных препаратов при саркомах мягких тканей. Он модифицирован для селективной репликации в p16 / Rb-дефектных клетках, которые включают большинство раковых клеток человека. Кроме того, CGTG-102 кодирует колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF ),[63][65] мощная иммуностимулирующая молекула.
Хотя онколитический аденовирус CGTG-102 продемонстрировал эффективность в качестве единственного агента против нескольких сарком мягких тканей, его также было бы привлекательно использовать в сочетании с другими режимами, так как онколитические вирусы продемонстрировали очень небольшое совпадение побочных эффектов с традиционными методами лечения, такими как химиотерапия и лучевая терапия.[62][63] CGTG-102 недавно был изучен в комбинации с доксорубицином, и был обнаружен синергетический эффект.[66] По крайней мере, часть доксорубицина механизм действия является индуктором гибели иммуногенных клеток, и было высказано предположение, что иммунный ответ способствует его общей противоопухолевой активности. Доксорубицин также увеличивает репликацию аденовирусов в клетках саркомы мягких тканей,[66] потенциально способствуя наблюдаемому синергетическому эффекту в комбинации вирус / доксорубицин.
Дополнительные изображения

Intermed. mag.

Высокая маг.

Высокая маг. (SMARCB1)
Смотрите также
- Саркома мягких тканей
- Саркома
- Злокачественная рабдоидная опухоль
- Атипичная тератоидная / рабдоидная опухоль
Рекомендации
- ^ а б Энцингер, Ф. М. (1970). «Эпителиоидная саркома. Саркома, имитирующая гранулему или карциному». Рак. 26 (5): 1029–41. Дои:10.1002 / 1097-0142 (197011) 26: 5 <1029 :: AID-CNCR2820260510> 3.0.CO; 2-R. PMID 5476785.
- ^ Guillou, L; Wadden, C; Coindre, JM; Krausz, T; Флетчер, CD (1997). "'Эпителиоидная саркома проксимального типа, характерное агрессивное новообразование с рабдоидными чертами. Клинико-патологическое, иммуногистохимическое и ультраструктурное исследование серии ». Американский журнал хирургической патологии. 21 (2): 130–46. Дои:10.1097/00000478-199702000-00002. PMID 9042279.
- ^ а б c Армах, Генри Б. Армах; Парвани, Анил В. (2009). «Эпителиоидная саркома». Архив патологии и лабораторной медицины. 133 (5): 814–9. Дои:10.1043/1543-2165-133.5.814 (неактивно 10.11.2020). PMID 19415960.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Като, Хироши; Тори, Масахито; Кокубун, Шоичи; Ватанабэ, Мика; Смит, Ричард А; Хотта, Тецуо; Огосе, Акира; Морита, Тетсуро; Мураками, Такаши; Айба, Сэцуя (2004). «Экспрессия CA125 в эпителиоидной саркоме». Японский журнал клинической онкологии. 34 (3): 149–54. Дои:10.1093 / jjco / hyh027. PMID 15078911.
- ^ а б Леви, Антонин; Ле Пешу, Сесиль; Терьер, Филипп; Буаита, Райан; Домонт, Жюльен; Мир, Оливье; Коппола, Сара; Оноре, Шарль; Ле Сесн, Аксель; Бонвало, Сильви (2014).«Эпителиоидная саркома: потребность в мультимодальном подходе для максимального увеличения шансов консервативного лечения». Анналы хирургической онкологии. 21 (1): 269–76. Дои:10.1245 / с10434-013-3247-4. PMID 24046109. S2CID 21163484.
- ^ а б c d е Лев, Дина. «Эпигенетическое репрограммирование эпителиолдной саркомы: роль перекрестных помех INI1-HDAC». Архивировано из оригинал 2015-04-22.
- ^ а б c d Казанова, Микела; Феррари, Андреа; Коллини, Паола; Бизоньо, Джанни; Аладжио, Рита; Чеккетто, Джованни; Гронки, Алессандро; Меацца, Кристина; Гаравента, Альберто; Ди Катальдо, Андреа; Карли, Модесто (2006). «Эпителиоидная саркома у детей и подростков». Рак. 106 (3): 708–17. Дои:10.1002 / cncr.21630. PMID 16353216. S2CID 25321347.
- ^ Джавад, Мухаммад Умар; Экштейн, Джейсон; Мин, Элайджа С .; Скалли, Шон П. (2009). «Прогностические факторы выживания пациентов с эпителиоидной саркомой: 441 случай из базы данных SEER». Клиническая ортопедия и смежные исследования. 467 (11): 2939–48. Дои:10.1007 / s11999-009-0749-2. ЧВК 2758965. PMID 19224301.
- ^ а б Bos, GD; Причард, диджей; Рейман, HM; Добинс, JH; lstrup, DM; Лэндон, GC (1988). «Эпителиоидная саркома. Анализ 51 случая». Журнал костной и суставной хирургии. Американский объем. 70 (6): 862–70. Дои:10.2106/00004623-198870060-00011. PMID 3392084.
- ^ а б c Хорник, Джейсон Л.; Даль Син, Паола; Флетчер, Кристофер Д. (2009). «Потеря экспрессии INI1 характерна как для обычной эпителиоидной саркомы, так и для проксимального типа». Американский журнал хирургической патологии. 33 (4): 542–50. Дои:10.1097 / PAS.0b013e3181882c54. PMID 19033866. S2CID 5167769.
- ^ а б Модена, Пьерджиорджо; Луальди, Елена; Факкинетти, Федерика; Галли, Лиза; Тейшейра, Мануэль Р .; Пилотти, Сильвана; Соцци, Габриэлла (2005). "SMARCB1 / INI1 Ген супрессора опухолей часто инактивируется при эпителиоидных саркомах ». Исследования рака. 65 (10): 4012–9. Дои:10.1158 / 0008-5472.CAN-04-3050. PMID 15899790.
- ^ Лушникова, Тамара; Кнуутила, Сакари; Миеттинен, Маркку (2000). "Изменения числа копий ДНК в эпителиоидной саркоме и ее вариантах: сравнительное исследование геномной гибридизации". Современная патология. 13 (10): 1092–6. Дои:10.1038 / modpathol.3880203. PMID 11048803. S2CID 23521276.
- ^ Нисио, Джун; Ивасаки, Хироши; Набешима, Кадзуки; Исигуро, Масако; Науманн, Сабина; Исаяма, Теруто; Найто, Масатоши; Канеко, Ясухико; Кикучи, Масахиро; Мост, Юлия (2005). «Создание новой линии клеток эпителиоидной саркомы человека, FU-EPS-1: молекулярно-цитогенетическая характеристика с использованием спектрального кариотипирования и сравнительной геномной гибридизации». Международный журнал онкологии. 27 (2): 361–9. Дои:10.3892 / ijo.27.2.361. PMID 16010416.
- ^ а б c Линь, Линь; Хикс, Дэвид; Сюй, Бо; Сигель, Джессика Э; Бергфельд, Вильма Ф; Монтгомери, Элизабет; Фишер, Кирилл; Хартке, Мэрибет; Таббс, Раймонд; Голдблюм, Джон Р. (2005). «Профиль экспрессии и молекулярно-генетическая регуляция экспрессии циклина D1 в эпителиоидной саркоме». Современная патология. 18 (5): 705–9. Дои:10.1038 / modpathol.3800349. PMID 15578074. S2CID 24821026.
- ^ Кахали, Бхаскар; Ю, Цзиньлун; Marquez, Stefanie B .; Томпсон, Кеннет У .; Liang, Shermi Y .; Лу, Ли; Райзман, Дэвид (2014). «Молчание субъединицы SWI / SNF и противоракового гена BRM в рабдоидных опухолях». Oncotarget. 5 (10): 3316–32. Дои:10.18632 / oncotarget.1945. ЧВК 4102812. PMID 24913006.
- ^ а б Кунен, Корнелиус; Ленхардт, Маркус; Толнай, Эдина; Мюльбергер, Томас; Фогт, Питер М .; Мюллер, Клаус-Михаэль (2000). «Паттерны экспрессии и секреции фактора роста эндотелия сосудов при злокачественных опухолях мягких тканей». Журнал исследований рака и клинической онкологии. 126 (4): 219–25. Дои:10.1007 / s004320050036. PMID 10782895. S2CID 21613610.
- ^ а б c Мартин Либерал, Хуан; Лагарес-Тена, Лаура; Саинс-Джаспедо, Мигель; Матео-Лозано, Сильвия; Гарсиа дель Муро, Ксавьер; Тирадо, Оскар М. (2012). «Целенаправленная терапия сарком: бросая вызов вызову». Саркома. 2012: 1–13. Дои:10.1155/2012/626094. ЧВК 3372278. PMID 22701332.
- ^ Чанг, Хе Вон (2014). "Лечение пазопанибом эпителиоидной саркомы вульвы: отчет о болезни и обзор литературы". 대한 산부인과 학회 학술 발표 논문집. 100: 373.[ненадежный медицинский источник? ]
- ^ Kuhnen, C .; Толнай, Эдина; Стейнау, Ганс Ульрих; Восс, Бруно; Мюллер, Клаус-Михаэль (1998). «Экспрессия рецептора c-Met и фактора роста гепатоцитов / фактора рассеяния при синовиальной саркоме и эпителиоидной саркоме». Вирховский архив. 432 (4): 337–42. Дои:10.1007 / s004280050175. PMID 9565343. S2CID 30726514.
- ^ а б c d Имура, Йошинори; Ясуи, Хирохико; Оутани, Хидэтацу; Вакамацу, Тору; Хамада, Кеничиро; Накаи, Такааки; Ямада, Шутаро; Мьюи, Акира; Араки, Нобухито; Уэда, Такафуми; Ито, Казуюки; Йошикава, Хидеки; Нака, Норифуми (2014). «Комбинированное нацеливание на сигнальные пути mTOR и c-MET для эффективного лечения эпителиоидной саркомы». Молекулярный рак. 13: 185. Дои:10.1186/1476-4598-13-185. ЧВК 4249599. PMID 25098767.
- ^ Номер клинического исследования NCT01154452 на "Vismodegib и ингибитор пути гамма-секретазы / Notch сигнального пути RO4929097 в лечении пациентов с прогрессирующей или метастатической саркомой" ClinicalTrials.gov
- ^ а б c d е Се, X .; Гадими, М. П. Х .; Янг, E. D .; Белоусов, Р .; Zhu, Q.-s .; Liu, J .; Lopez, G .; Коломбо, К .; Peng, T .; Reynoso, D .; Hornick, J. L .; Lazar, A.J .; Лев, Д. (2011). «Комбинирование блокады EGFR и mTOR для лечения эпителиоидной саркомы». Клинические исследования рака. 17 (18): 5901–12. Дои:10.1158 / 1078-0432.CCR-11-0660. ЧВК 3176924. PMID 21821699.
- ^ а б Cascio, Майкл Дж; О'Доннелл, Ричард Дж; Хорвай, Эндрю Э (2010). «Эпителиоидная саркома экспрессирует рецептор эпидермального фактора роста, но амплификация гена и мутации киназного домена встречаются редко». Современная патология. 23 (4): 574–80. Дои:10.1038 / modpathol.2010.2. PMID 20118913. S2CID 11592703.
- ^ Yang, J.-L .; Hannan, M.T .; Рассел, П.Дж .; Кроу, П.Дж. (2006). «Экспрессия белка HER1 / EGFR в саркомах мягких тканей человека». Европейский журнал хирургической онкологии. 32 (4): 466–8. Дои:10.1016 / j.ejso.2006.01.012. PMID 16524687.
- ^ а б Ахмад, Амир; Эмори, Макото; Цукахара, Томохидэ; Мурасе, Масаки; Кано, Масанобу; Мурата, Кенджи; Такахаши, Акари; Кубо, Теруфуми; Асанума, Хироко; Ясуда, Кадзуё; Кочин, Виталий; Кая, Мицунори; Нагоя, Сатоши; Нисио, Джун; Ивасаки, Хироши; Сонода, Томоко; Хасэгава, Тадаши; Торигоэ, Тошихико; Вада, Такуро; Ямасита, Тошихико; Сато, Нориюки (2013). «Высокая экспрессия антигена CD109 регулирует фенотип раковых стволовых клеток / инициирующих рак клеток в новой линии клеток эпителиоидной саркомы ESX и связана с плохим прогнозом саркомы мягких тканей». PLOS ONE. 8 (12): e84187. Bibcode:2013PLoSO ... 884187E. Дои:10.1371 / journal.pone.0084187. ЧВК 3869840. PMID 24376795.
- ^ Стадия саркомы мягких тканей в eMedicine
- ^ а б де Вишер, Себастьян А. Х. Дж .; ван Гинкель, Робберт Дж .; Воббс, Тео; Вет, Рене П. Х .; ten Heuvel, Suzanne E .; Suurmeijer, Albert J. H .; Хоэкстра, Харад Дж. (2006). «Эпителиоидная саркома: все еще болезнь, излечимая хирургическим путем». Рак. 107 (3): 606–12. Дои:10.1002 / cncr.22037. PMID 16804932. S2CID 25833518.
- ^ Rao, Bhaskar N .; Родригес-Галиндо, Карлос (2003). «Местный контроль сарком конечностей у детей: спасательные конечности и щадящая функция». Медицинская и детская онкология. 41 (6): 584–7. Дои:10.1002 / MPO.10405. PMID 14595726.
- ^ Феррари, Андреа; Мичели, Розальба; Рей, Энни; Оберлин, Одиллия; Орбах, Даниэль; Бреннан, Бернадетт; Мариани, Луиджи; Карли, Модесто; Бизоньо, Джанни; Чеккетто, Джованни; Сальво, Джан Лука Де; Казанова, Микела; Vannoesel, Max M .; Келси, Анна; Стивенс, Майкл С .; Девидас, Минакши; Паппо, Альберто С .; Спант, Шери Л. (2011). «Неметастатические нерезецированные детские саркомы мягких тканей без рабдомиосаркомы: результаты объединенного анализа, проведенного в США и Европе». Европейский журнал рака. 47 (5): 724–31. Дои:10.1016 / j.ejca.2010.11.013. ЧВК 3539303. PMID 21145727.
- ^ ДеГрут, Генри; Эллисон, Брюс. «Хирургия спасения конечностей при саркомах конечностей». Архивировано из оригинал на 2015-02-08. Получено 2015-04-23.[ненадежный медицинский источник? ]
- ^ а б c Саркома мягких тканей. Руководство по клинической практике онкологии. Национальная всеобъемлющая онкологическая сеть.[страница нужна ]
- ^ Вольф, Патрик С .; Flum, David R .; Tanas, Munir R .; Рубин, Брайан П .; Манн, Гэри Н. (2008). «Эпителиоидная саркома: опыт Вашингтонского университета». Американский журнал хирургии. 196 (3): 407–12. Дои:10.1016 / j.amjsurg.2007.07.029. PMID 18436180.
- ^ «FDA одобряет первый вариант лечения специально для пациентов с эпителиоидной саркомой, редким раком мягких тканей» (Пресс-релиз). FDA. 23 января 2020 г.. Получено 2020-03-03.
- ^ а б Чейз, Д.Р .; Энцингер, FM (1985). «Эпителиоидная саркома. Диагностика, прогностические показатели, лечение». Американский журнал хирургической патологии. 9 (4): 241–63. Дои:10.1097/00000478-198504000-00001. PMID 4014539. S2CID 36504524.
- ^ Джадсон, Ян; Verweij, Jaap; Гельдерблом, Ганс; Hartmann, Jörg T; Шёффски, Патрик; Блей, Жан-Ив; Керст, Дж. Мартейн; Суфлярский, Йозеф; Уилан, Джереми; Хоэнбергер, Питер; Краруп-Хансен, Андерс; Альсиндор, Тьерри; Марро, Сандрин; Литьер, Саския; Германс, Екатерина; Фишер, Кирилл; Hogendoorn, Pancras C W; деи Тос, А Паоло; ван дер Грааф, Винетт Т.А. (2014). «Доксорубицин в отдельности по сравнению с активированным доксорубицином плюс ифосфамид для лечения первой линии прогрессирующей или метастатической саркомы мягких тканей: рандомизированное контролируемое исследование фазы 3». Ланцет онкологии. 15 (4): 415–23. Дои:10.1016 / S1470-2045 (14) 70063-4. PMID 24618336.
- ^ Лефрак, Эдвард А .; Пиша, Ян; Розенхайм, Сидней; Готтлиб, Джеффри А. (1973). «Клинико-патологический анализ кардиотоксичности адриамицина». Рак. 32 (2): 302–14. Дои:10.1002 / 1097-0142 (197308) 32: 2 <302 :: AID-CNCR2820320205> 3.0.CO; 2-2. PMID 4353012.
- ^ Липшульц, Стивен Э .; Колан, Стивен Д .; Гелбер, Ричард Д .; Perez-Atayde, Antonio R .; Саллан, Стивен Э .; Сандерс, Стивен П. (1991). «Поздние кардиологические эффекты терапии доксорубицином при остром лимфобластном лейкозе в детстве». Медицинский журнал Новой Англии. 324 (12): 808–15. Дои:10.1056 / NEJM199103213241205. PMID 1997853.
- ^ Chawla, Sant P .; Chua, Victoria S .; Хендифар, Эндрю Ф .; Quon, Дорис В .; Соман, Нилеш; Sankhala, Kamalesh K .; Виланд, Д. Скотт; Левитт, Дэниел Дж. (2015). «Фаза 1B / 2 исследования альдоксорубицина у пациентов с саркомой мягких тканей». Рак. 121 (4): 570–9. Дои:10.1002 / cncr.29081. PMID 25312684. S2CID 30710443.
- ^ Хендерсон, Т. О .; Whitton, J .; Стовалл, М .; Mertens, A.C .; Mitby, P .; Friedman, D .; Strong, L. C .; Hammond, S .; Neglia, J. P .; Meadows, A. T .; Робисон, Л .; Диллер, Л. (2007). «Вторичные саркомы у выживших после рака в детстве: отчет об исследовании выживших после рака в детстве». Журнал Национального института рака. 99 (4): 300–8. Дои:10.1093 / jnci / djk052. PMID 17312307.
- ^ а б Meng, F .; Evans, J. W .; Bhupathi, D .; Banica, M .; Lan, L .; Lorente, G .; Duan, J.-X .; Cai, X .; Mowday, A.M .; Guise, C.P .; Мороз, А .; Андерсон, Р. Ф .; Паттерсон, А. В .; Stachelek, G.C .; Glazer, P.M .; Matteucci, M.D .; Харт, К. П. (2012). "Молекулярная и клеточная фармакология гипоксически-активированного пролекарства TH-302". Молекулярная терапия рака. 11 (3): 740–51. Дои:10.1158 / 1535-7163.MCT-11-0634. PMID 22147748. S2CID 11701323.
- ^ Уилсон, Уильям Р .; Хэй, Майкл П. (2011). «Ориентация на гипоксию в терапии рака». Обзоры природы Рак. 11 (6): 393–410. Дои:10.1038 / nrc3064. PMID 21606941. S2CID 36040922.
- ^ Войтковяк, Джонатан В.; Корннелл, Хизер С; Мацумото, Синго; Сайто, Кейта; Такакусаги, Йоичи; Дутта, Прасанта; Ким, Мунджу; Чжан, Сяомэн; Леос, Рафаэль; Бейли, Кейт М; Мартинес, Гэри; Ллойд, Марк С; Вебер, Крейг; Митчелл, Джеймс Б. Линч, Рональд М; Бейкер, Аманда Ф; Гейтенби, Роберт А; Рейняк, Катаржина А; Харт, Чарльз; Кришна, Мурали Ч .; Гиллис, Роберт Дж (2015). «Пируват сенсибилизирует опухоли поджелудочной железы к активированному гипоксией пролекарству TH-302». Рак и метаболизм. 3 (1): 2. Дои:10.1186 / s40170-014-0026-z. ЧВК 4310189. PMID 25635223.
- ^ Chawla, S.P .; Cranmer, L.D .; Van Tine, B.A .; Рид, Д. Р .; Okuno, S.H .; Бутринский, Дж. Э .; Adkins, D. R .; Hendifar, A.E .; Kroll, S .; Ганджу, К. Н. (2014). «Фаза II исследования безопасности и противоопухолевой активности гипоксически-активированного пролекарства TH-302 в комбинации с доксорубицином у пациентов с развитой саркомой мягких тканей». Журнал клинической онкологии. 32 (29): 3299–306. Дои:10.1200 / JCO.2013.54.3660. ЧВК 4588714. PMID 25185097.
- ^ а б c d Уилки, Брилин; Голдберг, Джон М. (14 апреля 2014 г.). «Иммунотерапия при саркоме: новый рубеж». Открытие медицины. 17 (94): 201–6. PMID 24759624.
- ^ а б c Ху, Джеймс С; Скит, Джозеф Джи; Каст, Вейбе Мартин (2014). «Иммунотерапия при саркоме: краткий обзор». Sarcoma Research International. 1 (1): id1003.
- ^ а б Педраццоли, Паоло; Секондино, Симона; Перфетти, Витторио; Комоли, Патриция; Монтанья, Даниэла (2011). «Иммунотерапевтическое вмешательство против сарком». Журнал рака. 2: 350–6. Дои:10.7150 / jca.2.350. ЧВК 3119402. PMID 21716856.
- ^ Ратнавелу, Кананатан; Субрамани, Баскар; Пуллай, Читра Раманатан; Кришнан, Кохила; Сугадан, Шила Деви; Рао, Манджунатх Садананда; Виракумарасивам, Абхи; Дэн, Сюэвэнь; Хироши, Терунума (2013). «Аутологичная терапия для повышения иммунитета против продвинутой эпителиоидной саркомы: отчет о болезни». Письма об онкологии. 5 (5): 1457–1460. Дои:10.3892 / ol.2013.1247. ЧВК 3678875. PMID 23761810.
- ^ Ciardiello, F; Троиани, Т; Bianco, R; Orditura, M; Morgillo, F; Мартинелли, Э; Морелли, депутат; Каскон, Т; Tortora, G (2006). «Взаимодействие между рецептором эпидермального фактора роста (EGFR) и путями фактора роста эндотелия сосудов (VEGF): рациональный подход к многоцелевой противоопухолевой терапии». Анналы онкологии. 17 (Приложение 7): vii109–14. Дои:10.1093 / annonc / mdl962. PMID 16760272.
- ^ Хирата, Акира; Огава, Сох-ичиро; Кометани, Такуро; Кувано, Такаши; Наито, Сейджи; Кувано, Мичихико; Оно, Маюми (2002). «ZD1839 (Iressa) вызывает антиангиогенные эффекты за счет ингибирования тирозинкиназы рецептора эпидермального фактора роста». Исследования рака. 62 (9): 2554–60. PMID 11980649.
- ^ Кармелье, Питер; Дор, Юваль; Герберт, Жан-Марк; Фукумура, Дай; Брюссельманс, Коэн; Деверчин, Мике; Neeman, Michal; Боно, Франсуаза; Абрамович, Ринат; Максвелл, Патрик; Кох, Кэмерон Дж .; Рэтклифф, Питер; Луны, Лив; Джайн, Ракеш К .; Коллен, Дезире; Кешет, Эли (1998). «Роль HIF-1α в апоптозе, опосредованном гипоксией, пролиферации клеток и ангиогенезе опухоли». Природа. 394 (6692): 485–90. Bibcode:1998Натура.394..485C. Дои:10.1038/28867. PMID 9697772. S2CID 4419118.
- ^ Деметри, GD (2002). «Выявление и лечение химиорезистентного неоперабельного или метастатического GIST: опыт применения селективного ингибитора тирозинкиназы иматиниба мезилата (STI571)». Европейский журнал рака. 38 (Дополнение 5): S52–9. Дои:10.1016 / s0959-8049 (02) 80603-7. PMID 12528773.
- ^ а б c Арора, Амит; Ученый, Эрик М. (2005). «Роль ингибиторов тирозинкиназы в терапии рака». Журнал фармакологии и экспериментальной терапии. 315 (3): 971–9. Дои:10.1124 / jpet.105.084145. PMID 16002463. S2CID 33720.
- ^ Лендьель, Эрнст; Савада, Кенджиро; Салгия, Рави (2007). «Мутации тирозинкиназы при раке человека». Современная молекулярная медицина. 7 (1): 77–84. Дои:10.2174/156652407779940486. PMID 17311534.
- ^ а б c d Геречитано, Джон (2014). «SINE (селективный ингибитор ядерного экспорта) - перевод науки в новый класс противораковых средств». Журнал гематологии и онкологии. 7: 67. Дои:10.1186 / s13045-014-0067-3. ЧВК 4197302. PMID 25281264.
- ^ Сакакибара, К .; Saito, N .; Сато, Т .; Сузуки, А .; Hasegawa, Y .; Friedman, J.M .; Kufe, D. W .; VonHoff, D. D .; Iwami, T .; Кавабе, Т. (2011). «CBS9106 представляет собой новый обратимый пероральный ингибитор CRM1 с активностью по разложению CRM1». Кровь. 118 (14): 3922–31. Дои:10.1182 / кровь-2011-01-333138. PMID 21841164. S2CID 16936188.
- ^ а б Гравина, Джованни; Сенапедис, Уильям; Макколи, Дилара; Балоглу, Эркан; Шахам, Шарон; Festuccia, Клаудио (2014). «Нуклео-цитоплазматический транспорт как терапевтическая мишень рака». Журнал гематологии и онкологии. 7: 85. Дои:10.1186 / s13045-014-0085-1. ЧВК 4272779. PMID 25476752.
- ^ а б Хилл, Ричард; Каутен, Бастьен; де Педро, Нурия; Ссылка, Вольфганг (2014). «Нацеливание на ядерно-цитоплазматический транспорт в терапии рака». Oncotarget. 5 (1): 11–28. Дои:10.18632 / oncotarget.1457. ЧВК 3960186. PMID 24429466.
- ^ Тернер, Джоэл Дж .; Доусон, Яна; Cubitt, Christopher L .; Баз, Рашид; Салливан, Дэниел М. (2014). «Ингибирование CRM1-зависимого ядерного экспорта сенсибилизирует злокачественные клетки к цитотоксическим и таргетным агентам». Семинары по биологии рака. 27: 62–73. Дои:10.1016 / j.semcancer.2014.03.001. ЧВК 4108511. PMID 24631834.
- ^ Крейг, Эррол; Чжан, Чжи-Кай; Дэвис, Кельвин П .; Калпана, Гянджам В. (2002). «Замаскированный NES в INI1 / hSNF5 опосредует hCRM1-зависимый ядерный экспорт: последствия для туморогенеза». Журнал EMBO. 21 (1–2): 31–42. Дои:10.1093 / emboj / 21.1.31. ЧВК 125819. PMID 11782423.
- ^ Демикко, Элизабет Дж .; Маки, Роберт Дж .; Лев, Дина Ц .; Лазарь, Александр Дж. (2012). «Новые терапевтические цели при саркоме мягких тканей». Достижения в анатомической патологии. 19 (3): 170–80. Дои:10.1097 / PAP.0b013e318253462f. ЧВК 3353406. PMID 22498582.
- ^ Раджендран, Правин; Хо, Эмили; Уильямс, Дэвид Э; Дэшвуд, Родерик H (2011). «Диетические фитохимические вещества, ингибирование HDAC и дефекты повреждения / восстановления ДНК в раковых клетках». Клиническая эпигенетика. 3 (1): 4. Дои:10.1186/1868-7083-3-4. ЧВК 3255482. PMID 22247744.
- ^ а б c Пол, Джонатан Дж. Рессегье, Жюльен; Личти, Брайан Д. (2012). «Онколитические вирусы: шаг в иммунотерапию рака». Адаптация и лечение вирусов. 4: 1–21. Дои:10.2147 / VAAT.S12980.
- ^ а б c d Хемминки, Аксели (2014). «Онколитическая иммунотерапия: где мы находимся в клинической практике?». Scientifica. 2014: 1–7. Дои:10.1155/2014/862925. ЧВК 3914551. PMID 24551478.
- ^ а б Ли, Гуй-Донг; Кавасима, Хироюки; Огосе, Акира; Ариидзуми, Такаши; Хотта, Тецуо; Кувано, Риозо; Урата, Ясуо; Фудзивара, Тосиёси; Эндо, Наото (2013). «Теломелизин проявляет сильную противоопухолевую активность через апоптотическую и неапоптотическую гибель клеток в клетках саркомы мягких тканей». Наука о раке. 104 (9): 1178–88. Дои:10.1111 / cas.12208. PMID 23718223. S2CID 33300842.
- ^ Браманте, Симона; Коски, Анниина; Кипар, Аня; Дьякону, Юлия; Лийканен, Илкка; Хемминки, Отто; Василев, Лотта; Парвиайнен, Суви; Серулло, Винченцо; Песонен, Сайла К.; Оксанен, Минна; Хейсканен, Райта; Рувинен-Лагерстрём, Нура; Мерисало-Сойккели, Майджу; Хаконен, Тиина; Йоэнсуу, Тимо; Канерва, Анна; Песонен, Сари; Хемминки, Аксели (2014). «Серотип химерного онколитического аденовируса, кодирующего GM-CSF для лечения саркомы у грызунов и людей». Международный журнал рака. 135 (3): 720–30. Дои:10.1002 / ijc.28696. PMID 24374597. S2CID 22657446.
- ^ а б Сирала, Микко; Браманте, Симона; Василев, Лотта; Хирвинен, Мари; Парвиайнен, Суви; Тяхтинен, Сири; Гус, Килиан; Серулло, Винченцо; Канерва, Анна; Кипар, Аня; Вяха-Коскела, Маркус; Хемминки, Аксели (2015). «Онколитический аденовирус и химиотерапия на основе доксорубицина приводит к синергическому противоопухолевому действию против саркомы мягких тканей». Международный журнал рака. 136 (4): 945–54. Дои:10.1002 / ijc.29048. PMID 24975392. S2CID 27535394.
дальнейшее чтение
- Ласкин, Уильям Б .; Миеттинен, Маркку (2003). «Эпителиоидная саркома: новые идеи, основанные на расширенном иммуногистохимическом анализе». Архив патологии и лабораторной медицины. 127 (9): 1161–8. Дои:10.1043 / 1543-2165 (2003) 127 <1161: ESNIBO> 2.0.CO; 2 (неактивно 10.11.2020). PMID 12946229.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
внешняя ссылка
| Классификация |
|---|



